HT 2 – Chemie trifft Kunst – Radierungen
Die Radierung ist eine Tiefdrucktechnik aus dem 16. Jahrhundert, die noch heute in der Kunst Verwendung findet. Die Vertiefungen in den Druckplatten zur Aufnahme der Druckfarben werden abhängig vom Plattenmaterial auf unterschiedlichen Wegen erzeugt. Unter anderem werden hierfür elektrochemische Verfahren genutzt.
Beschreibe den Versuchsaufbau zum galvanischen Gravieren (M 2).
Begründe anhand der Versuchsbeobachtungen, dass beim Versuch zum galvanischen Gravieren eine Kupferplatte und nicht eine Zinkplatte als Druckplatte verwendet wurde (M 1, M 2).
Gib die Teilgleichungen für die Elektrodenreaktionen für die beim galvanischen Gravieren ablaufenden Prozesse an (M 2).
Beurteile die Wahl des Elektrodenmaterials und des Elektrolyten beim galvanischen Gravieren unter Beachtung der Vorgabe, dass wenig Abfall anfallen und wenig Energie aufgewendet werden soll (M 2).
Zeichne ein zur Ätzradierung analoges beschriftetes galvanisches Element mit dem Zelldiagramm (Graphit-Kathode) (M 3).
Ermittle die ablaufenden Prozesse bei Betrieb des galvanischen Elements sowie die Spannung des galvanischen Elements unter Standardbedingungen.
Erläutere, dass Druckplatten aus Zink nicht mit Eisen(III)-chloridlösung geätzt werden können, wenn zuvor Druckplatten aus Kupfer mit dieser Ätzlösung behandelt wurden.
M 1: Vorbereitung der Druckplatte
Eine Metallplatte aus Zink oder Kupfer wird zunächst mit einem nichtleitenden Lack überzogen. In die Lackschicht wird die Zeichnung seitenverkehrt eingeritzt, sodass das Metall durch das Ritzen freigelegt wird. Die so vorbereitete Platte kann weiterverarbeitet werden.
M 2: Versuch – Galvanisches Gravieren
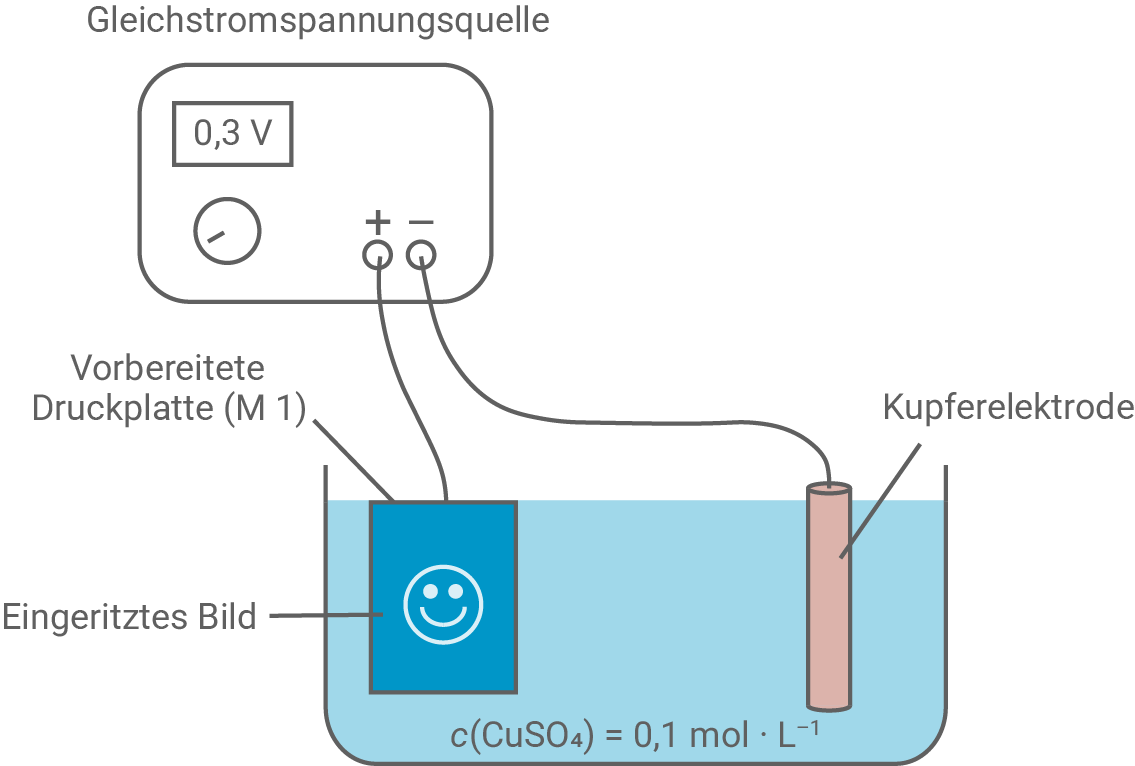
Man beobachtet, dass an der Druckplatte am Pluspol erst nach Einschalten der Spannungsquelle an allen nicht mit Lack bedeckten Stellen Vertiefungen entstehen.
M 3: Versuch – Ätzradierung mit Eisen(III)-Ionen
Eine nach M 1 vorbereitete Druckplatte aus Kupfer wird für einige Minuten in eine Ätzlösung gelegt. Als Ätzlösung wird eine Eisen(III)-chloridlösung genutzt.
An den durch Ritzen freigelegten Stellen färbt sich die Lösung hellblau und es bilden sich mit der Zeit Vertiefungen an diesen Stellen. Zum Beenden des Ätzvorgangs wird die Platte aus der Ätzlösung herausgenommen und gründlich mit Wasser gespült.
Vorbereitete Druckplatten aus Zink können gleichermaßen mit Eisen(III)-chloridlösung geätzt werden, jedoch nicht, wenn zuvor Druckplatten aus Kupfer mit dieser Ätzlösung behandelt wurden.
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Versuchsaufbau zum galvanischen Gravieren
Der Versuchsaufbau für das galvanische Gravieren besteht aus einer Kupferplatte, die mit einem nichtleitenden Lack überzogen wird. In diesen Lack wird das Motiv eingeritzt, sodass das Metall an den freigelegten Stellen sichtbar wird. Die beschichtete Kupferplatte dient als Anode, während die Kathode eine unbeschichtete Kupferelektrode ist. Der Elektrolyt besteht aus einer Lösung, die Kupfersulfat enthält.
Es ist eine äußere Stromquelle angeschlossen, es handelt sich also um eine Elektrolysezelle (Pluspol an die Anode und Minuspol an die Kathode).
Nutzung einer Kupferplatte statt einer Zinkplatte
Die Wahl einer Kupferplatte beim galvanischen Gravieren ist vor allem darauf zurückzuführen, dass sie eine präzise Kontrolle der Gravierungstiefe ermöglicht. Kupfer oxidiert gleichmäßig und nur nach Anschluss der Spannungsquelle, wodurch die Gravur schrittweise und kontrolliert vertieft werden kann.
Eine Zinkplatte hingegen würde aufgrund ihres deutlich negativeren Standardelektrodenpotentials schneller oxidieren, was zu einer unregelmäßigen und schwer kontrollierbaren Gravur führen würde.
Daher wird Kupfer bevorzugt, um die gewünschte Feinheit und Gleichmäßigkeit der Gravur sicherzustellen.
Teilgleichungen
Anode (Oxidation)
Kathode (Reduktion)
Beurteilung der Wahl des Elektrodenmaterials und des Elektrolyten beim galvanischen Gravieren
Die Wahl von Kupfer als Elektrodenmaterial und Kupfersulfat als Elektrolyten bringen mehrere Vorteile mit sich. Der Aufbau erinnert an eine Konzentrationszelle; gehen im Laufe der Elektrolyse Kupfer-Kationen der Druckplatte in Lösung, so scheidet sich parallel elementares Kupfer an der Kathode ab. Dies ist energietechnisch vorteilhaft, da die effektive Elektrolytkonzentration und so auch die notwendige Spannung aufrechterhalten bleiben. Außerdem ist die Gravur, wie bereits in Aufgabe 1 erläutert, mit Kupfer gut kontrollierbar und es kommt nicht spontan zur Oxidation der Druckplatte.
Nichtsdestotrotz ist festzuhalten, dass die entstehenden Abfälle durch das Kupfer schwermetallhaltig und besondere Entsorgungsmaßnahmen zu beachten sind.
Hinweis: Zur Erreichung der vollen Punktzahl sind andere Aspekte zur Beurteilung, sofern sinnvoll, auch möglich.
Zur Ätzradierung analoges galvanisches Element
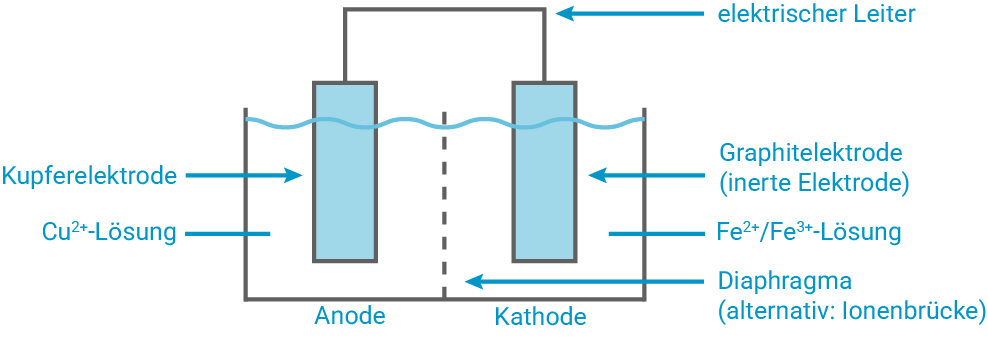
Ermittlung ablaufender Prozesse
Anhand des Zelldiagramms aus der Aufgabenstellung und der Standardelektrodenpotentiale aus der Formelsammlung lassen sich die ablaufenden Prozesse und schließlich die vorherrschende Zellspannung berechnen:
Anode (Oxidation, links)
Kathode (Reduktion, rechts)
Gesamtgleichung
Zellspannung
Die Zelle liefert unter Standardbedingungen und läuft somit spontan in der angegebenen Richtung.
Warum Zinkplatten nicht mit Eisen(III)-Chloridlösung geätzt werden können, wenn zuvor Kupferplatten damit behandelt wurden
Wenn die Ätzlösung zuerst bei einer Kupferplatte zum Einsatz kommt, so gehen bei diesem Prozess Kupfer-Kationen in Lösung.
Dies wird durch die Beobachtungen in M 3 klar, da zum einen Vertiefungen an der Druckplatte aus Kupfer entstehen und sich zum anderen die umgebende Lösung blau färbt.
Will man diese Lösung nun zum Ätzen einer Zinkplatte benutzen, so wurde schon ein großer Teil des gelösten Eisens reduziert, sodass als nächstes das vorher gelöste Kupfer zu elementarem Kupfer reduziert wird. Das reduzierte, elementare Kupfer fällt aus bzw. scheidet sich ab und stört so die präzise Gravur der Zinkplatte.
Der Ablauf der Redoxschritte wird an den entsprechenden Standardelektrodenpotentialen ersichtlich:
Gewünschte Oxidation (Radierung)
Da man mit der Reduktion von Eisen(III)-Ionen eine höhere Potentialdifferenz und somit Spannung erhält als mit Kupfer, läuft diese Reduktionsreaktion bevorzugt ab. Dennoch scheidet sich unerwünschterweise nach einiger Zeit das Kupfer nach Verbrauch des Eisens ab und stört somit die Radierung.