Vorschlag A: Korallenbleiche – Eine Symbiose in Gefahr
(Ökologische und stoffwechselphysiologische Zusammenhänge, Genetik und Gentechnik)
Tropische Korallenriffe sind Hotspots der marinen Artenvielfalt. Die Symbiose zwischen Algen und Korallenpolypen macht es erst möglich, dass winzige Polypen Korallenriffe aufbauen, welche die größten von Lebewesen erschaffenen Bauwerke darstellen. Doch in den letzten Jahren leiden die Riffe zunehmend unter der Korallenbleiche. Die Korallenpolypen verlieren dabei ihre symbiontischen Algen und sterben im Extremfall ab. Die Temperaturtoleranz der Korallen hängt unter anderem von der Aktivität von Hitzeschockproteinen ab. Die Expression der betreffenden Gene wird in Abhängigkeit von Außenfaktoren reguliert.
Aufgaben
Ökologie der Steinkorallen und ihrer Symbionten
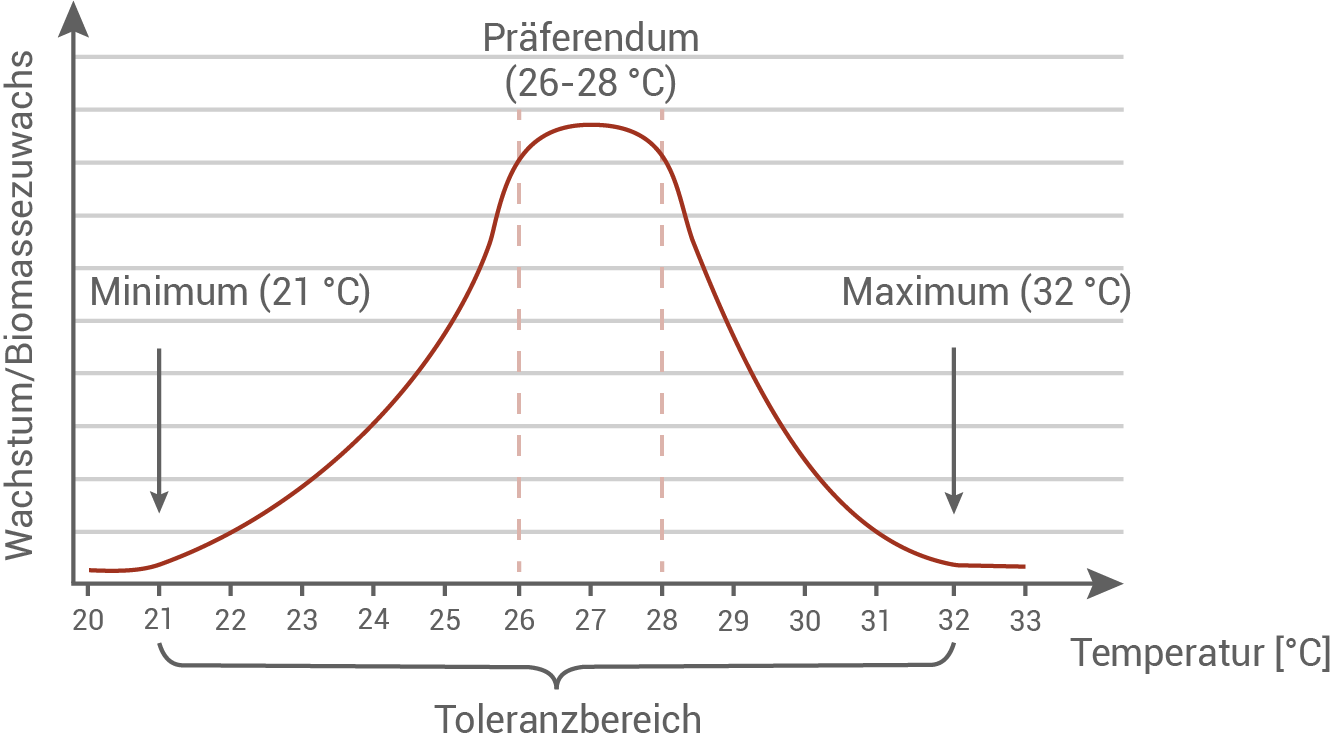
Zeichne und beschrifte die Toleranzkurve einer Steinkoralle bezüglich des Faktors Temperatur.
Beschreibe die charakteristischen Merkmale einer Symbiose am Beispiel von Steinkoralle und Algen. (Material 1)
Beschreibe die Funktionen der Blattpigmente bei der Fotosynthese grüner Pflanzen.
Stelle die Unterschiede zwischen dem Absorptionsspektrum grüner Laubblätter von Sparmannia africana und dem von Algen der Gattung Symbiodinium dar.
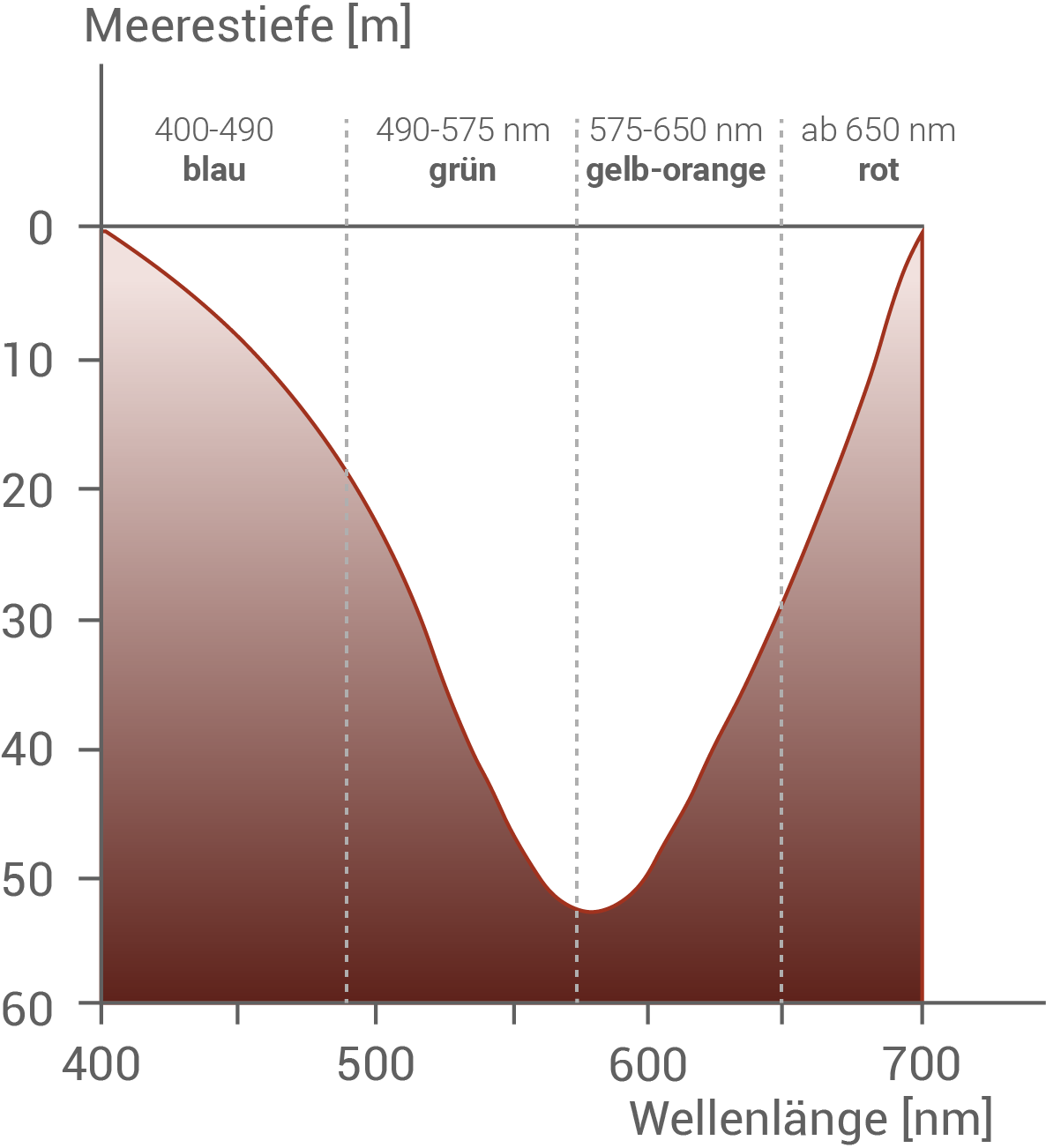
Erkläre die Besonderheiten des Absorptionsspektrums von Symbiodinium als Angepasstheit an den Lebensraum Meer. (Material 2)
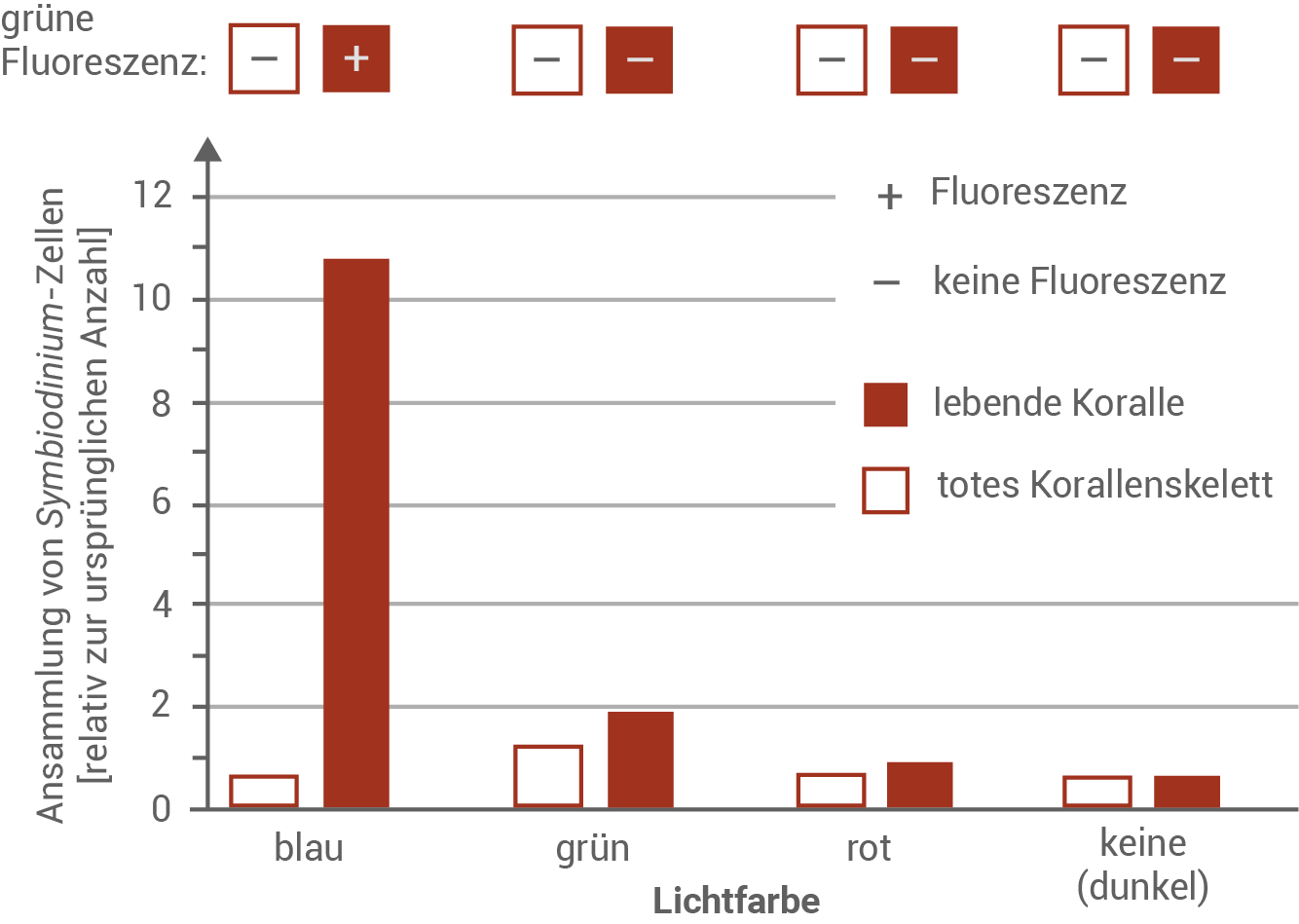
Werte die Untersuchungsergebnisse in Material 3 aus.
Untersuche die biologische Funktion der Fluoreszenz für Steinkorallen und Algen. (Material 1, 2 und 3)
Erläutere den Einfluss der Wassertemperatur auf die Korallen. (Material 4)
Analysiere die Ergebnisse aus Material 5 und werte diese in Bezug auf die Fähigkeit der einzelnen Holobiontentypen zur Akklimatisierung aus. (Material 1, 4 und 5)
Genregulation und Hitzetoleranz
Beschreibe die vier Strukturebenen von Proteinen.
Beschreibe die Genregulation durch Substratinduktion bei Prokaryoten nach dem Operon-Modell (Jacob-Monod-Modell).
Erläutere die Regulation der Hsp70-Menge.
Erkläre, wie dieser Regulationsmechanismus zu einer verstärkten Hitzetoleranz beiträgt. (Material 6)
Werte die Untersuchungen aus Material 7 aus und prüfe einen möglichen Nutzen von Hsp70 zum Nachweis der Wirkung von Stressfaktoren. (Material 6, 7 und 8)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Material 1
Tropische Steinkorallen
Eine Steinkoralle ist eine festsitzende Kolonie aus etwa 100 000 Einzeltieren, den Korallenpolypen, die ein kalkhaltiges Skelett produzieren. Eine Ansammlung von Tausenden von Steinkorallen bildet die Grundlage des Ökosystems Korallenriff.
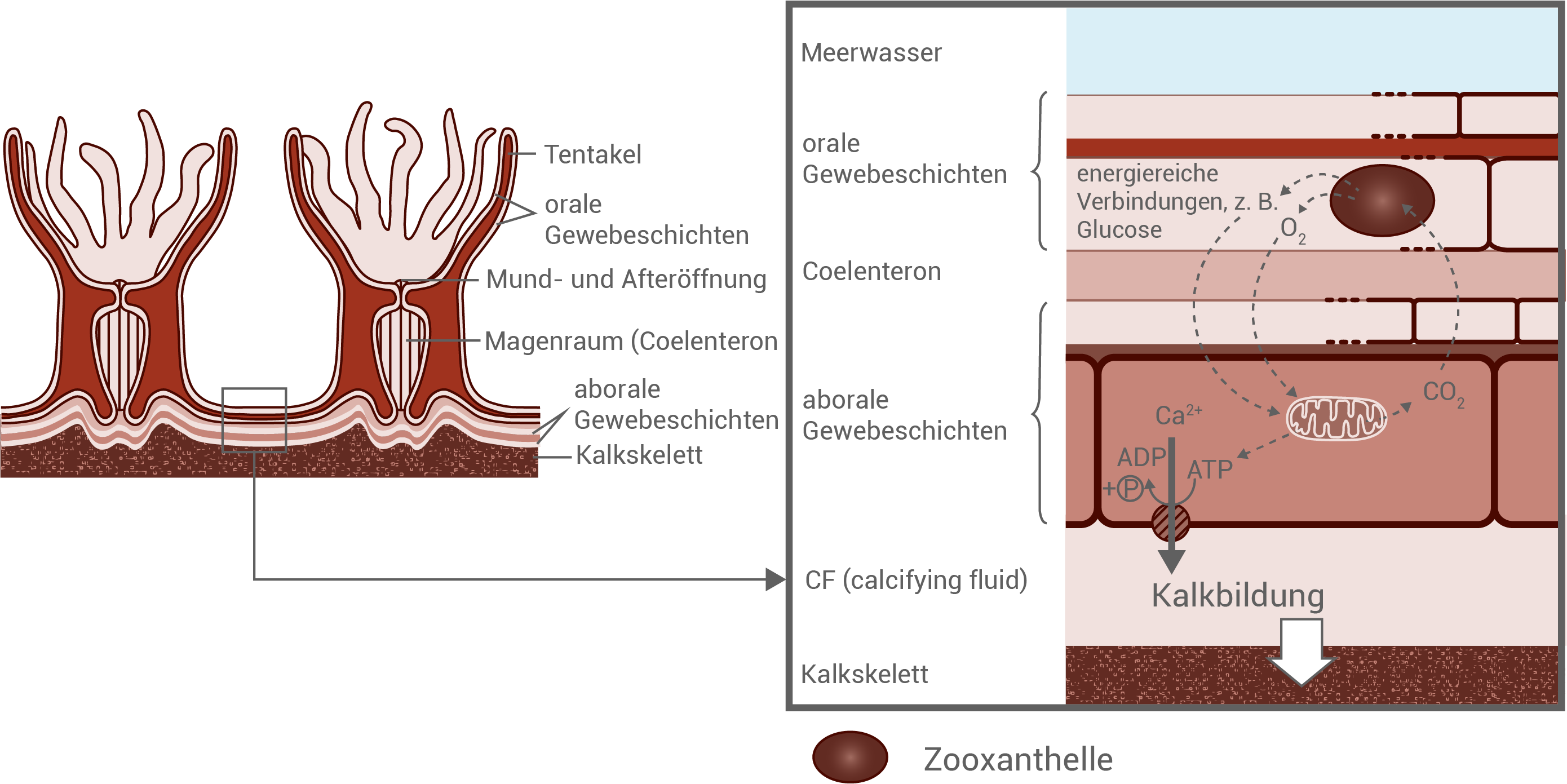
Korallenpolypen gehören zu den Nesseltieren und ernähren sich heterotroph, indem sie mithilfe von in den Tentakeln befindlichen Nesselzellen Plankton fangen. Die Öffnung zwischen den Tentakeln ist gleichzeitig Mund und After. Zusätzlich beherbergen Korallenpolypen in ihren oralen Gewebeschichten auf einem Quadratzentimeter bis zu einer Million einzellige, fotosynthetisch aktive symbiontische Algen, z. B. der Gattung Symbiodinium. Diese sogenannten Zooxanthellen verleihen den lebenden Korallen ihre gelblich-braune Farbe. Die Korallenpolypen decken über die Fotosyntheseprodukte der Algen bis zu 80 % ihres Energiebedarfs. Außerdem hilft die Symbiose mit den Zooxanthellen bei der Bildung des Kalkskeletts.
Zur geschlechtlichen Vermehrung der Korallen werden Eizellen und Spermien ins Wasser abgegeben. Nach der Befruchtung entstehen frei bewegliche Larven, die sich nach einigen Tagen bis Wochen auf geeigneten Oberflächen festsetzen und zu Korallenpolypen entwickeln. Die symbiontischen Algen werden dabei in der Regel nicht an die Larven weitergegeben, sondern müssen jeden Korallenpolypen neu besiedeln.
Steinkorallen wachsen nur im flachen, klaren, sediment- und nährstoffarmen Wasser mit Temperaturen zwischen 21 und 32 °C, am besten bei 26 bis 28 °C. Sie sind überwiegend auf Wassertiefen bis 20 m beschränkt (in sehr klarem Wasser können es auch 40 m sein) und brauchen eine Salzkonzentration zwischen 2,7 und 3,8 %. Die enge physiologische Potenz der Korallen erklärt, warum weltweit nur ca. 2 % der Meere von Korallenriffen eingenommen werden. Fast alle Riffe befinden sich in den küstennahen Randbereichen tropischer Meere und wachsen nur sehr langsam (2 bis 5 cm pro Jahr).
Abbildung 1.1: Aufbau von Korallenpolypen (Längsschnitt)
Abbildung 1.2: Wechselwirkung zwischen Koralle und Zooxanthelle
Material 2
Der Lebensraum von Algen der Gattung Symbiodinium
Algen der Gattung Symbiodinium leben in unterschiedlichen Tiefen tropischer Meere. Dabei können sie sich entweder frei im Meerwasser mittels Geißeln fortbewegen oder in Symbiose mit Steinkorallen als Zooxanthellen vorkommen. Je nach Umweltbedingungen können die Algen zwischen den Lebensweisen wechseln, wobei sie in beiden Fällen fotosynthetisch aktiv sind. Ihre Pigmentmoleküle unterscheiden sich von denen grüner Landpflanzen. Die Algen meiden starkes blaues Licht, da dessen hohe Energie die zur Fotosynthese notwendigen Moleküle schädigen und sogar zerstören kann.
Abbildung 2.1: Absorptionsspektren von Algen der Gattung Symbiodinium und von Laubblättern grüner Landpflanzen am Beispiel von Sparmannia africana
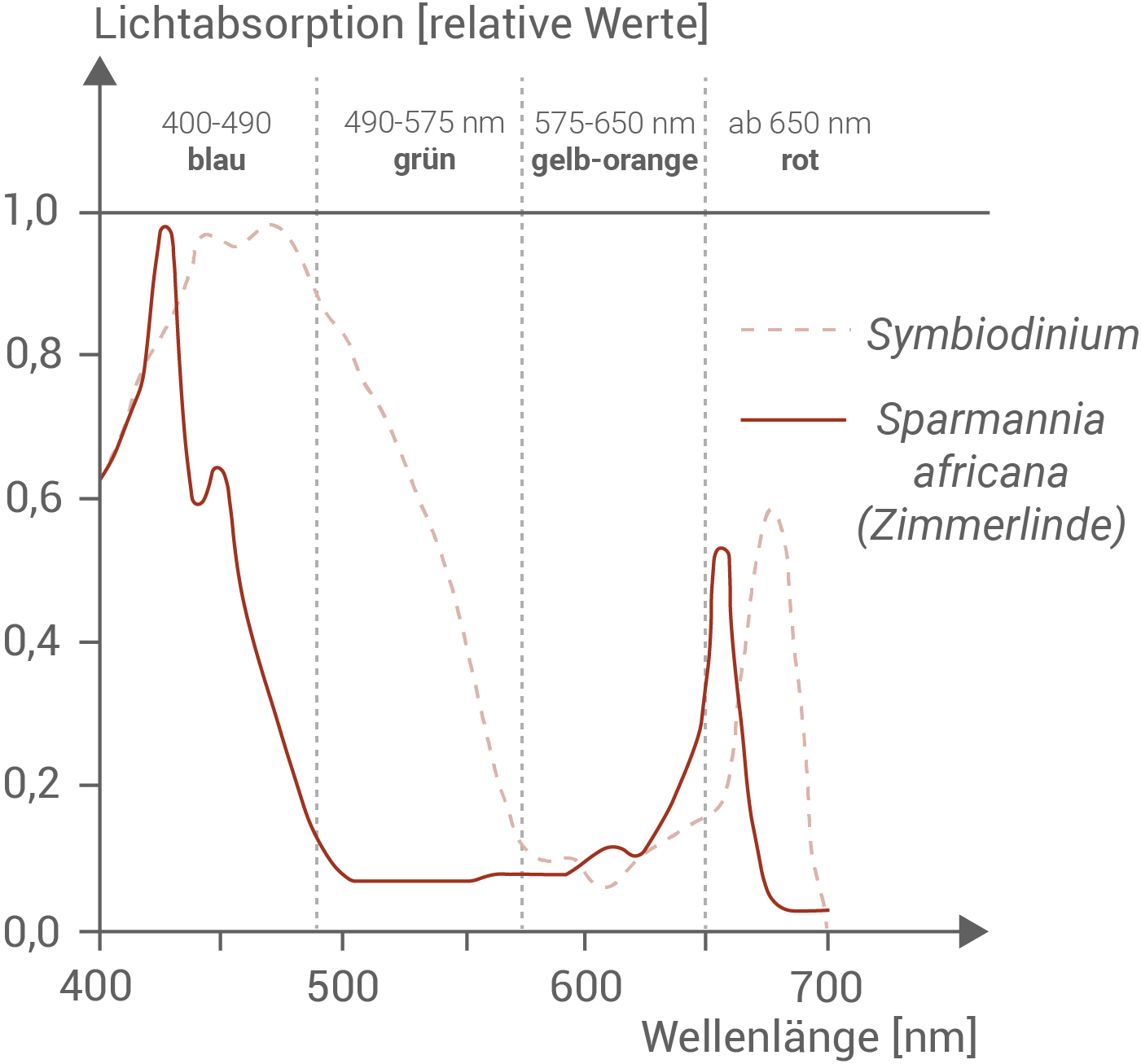
Abbildung 2.2: Eindringtiefe von unterschiedlichen Wellenlängen des sichtbaren Lichts in küstennahe Bereiche des Meeres
Material 3
Grüne Fluoreszenz bei Steinkorallen
Verschiedene Arten von Steinkorallen besitzen ein spezielles Protein (green fluorescent protein / GFP), das bei Absorption bestimmter Lichtwellenlängen grünes Licht der Wellenlänge 505 nm abstrahlt (Fluoreszenz). Dadurch leuchten die gesamten Korallen grünlich. Lange Zeit blieb unklar, welche biologische Funktion dieses Leuchten für die Korallen hat.
Eine japanisch-australische Arbeitsgruppe führte im Hinblick auf diese Fragestellung Experimente mit der Steinkoralle Echinophyllia aspera durch. Dabei wurden jeweils kleine Stücke von lebenden Korallen bzw. von Kalkskeletten abgestorbener Korallen in einer Glasschale fixiert und mit Kunstharz umschlossen. In die Schalen wurden zusätzlich frei bewegliche Algenzellen der Gattung Symbiodinium gegeben. Die Schalen wurden anschließend mit verschieden farbigem Licht für jeweils 10 Minuten bestrahlt bzw. in Dunkelheit gehalten. Einerseits wurde geprüft, ob eine grüne Fluoreszenz an den Korallenstücken nachweisbar war, andererseits wurde nach der Belichtung die Anzahl der Algen relativ zur ursprünglichen Anzahl („Ansammlung“) in der nahen Umgebung der Korallenstücke bestimmt.
Wirkung von unterschiedlichen Lichtfarben auf Korallen sowie auf Algen der Gattung Symbiodinium
Material 4
Korallenbleiche durch Temperaturstress


Ein entscheidender Stressfaktor, der zu Korallenbleiche führt, ist die Temperaturerhöhung. Durch den Klimawandel nehmen weltweit Hitzewellen zu. Auch die Durchschnittstemperaturen der Ozeane haben schon mehrere Jahre in Folge neue Höchstwerte erreicht. Eine Erhöhung der Wassertemperatur beeinflusst die Fotosynthese der Zooxanthellen. Es entstehen freie Sauerstoffradikale mit sehr großer Reaktionsbereitschaft. Diese wirken toxisch auf die Wirtszellen. Die Korallen reagieren darauf mit einem Ausstoßen der Zooxanthellen, die als einzellige, frei schwimmende Planktonalgen weiterleben. Sie können diese oder auch andere Zooxanthellen später wieder aufnehmen. Korallen können auch ohne Zooxanthellen überleben, zeigen jedoch geringere Wachstumsraten, eine verminderte Reproduktionsfähigkeit und erhöhte Anfälligkeit für Krankheiten.
Die Bleichempfindlichkeit der Korallen wird u. a. von dem Standort, der Art ihrer Zooxanthellen und der Wuchsform beeinflusst. Massive Korallen sind deutlich stressresistenter als viele feingliedrige, verzweigte Korallen.
Abbildung 4.1: Stadien der Korallenbleiche
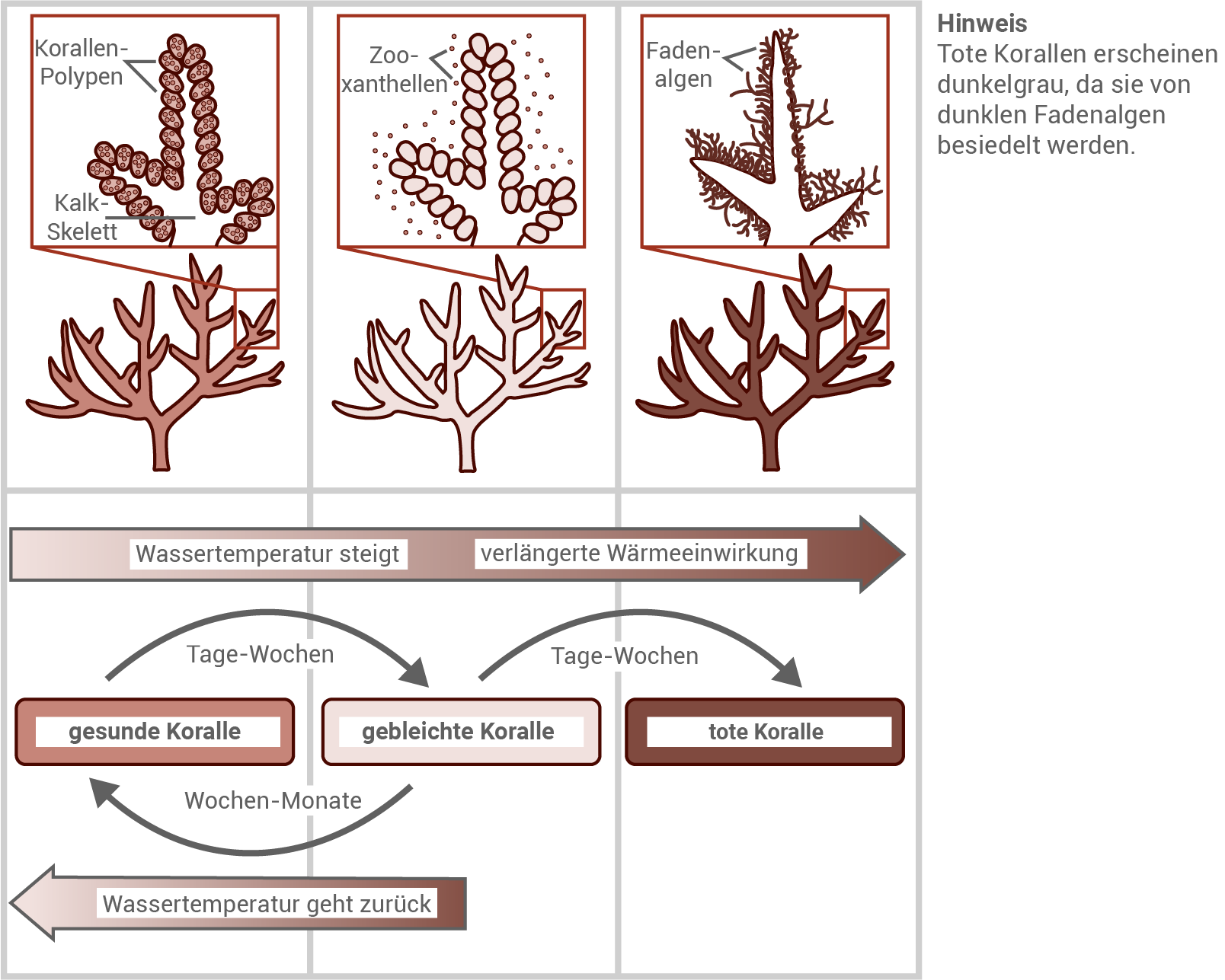
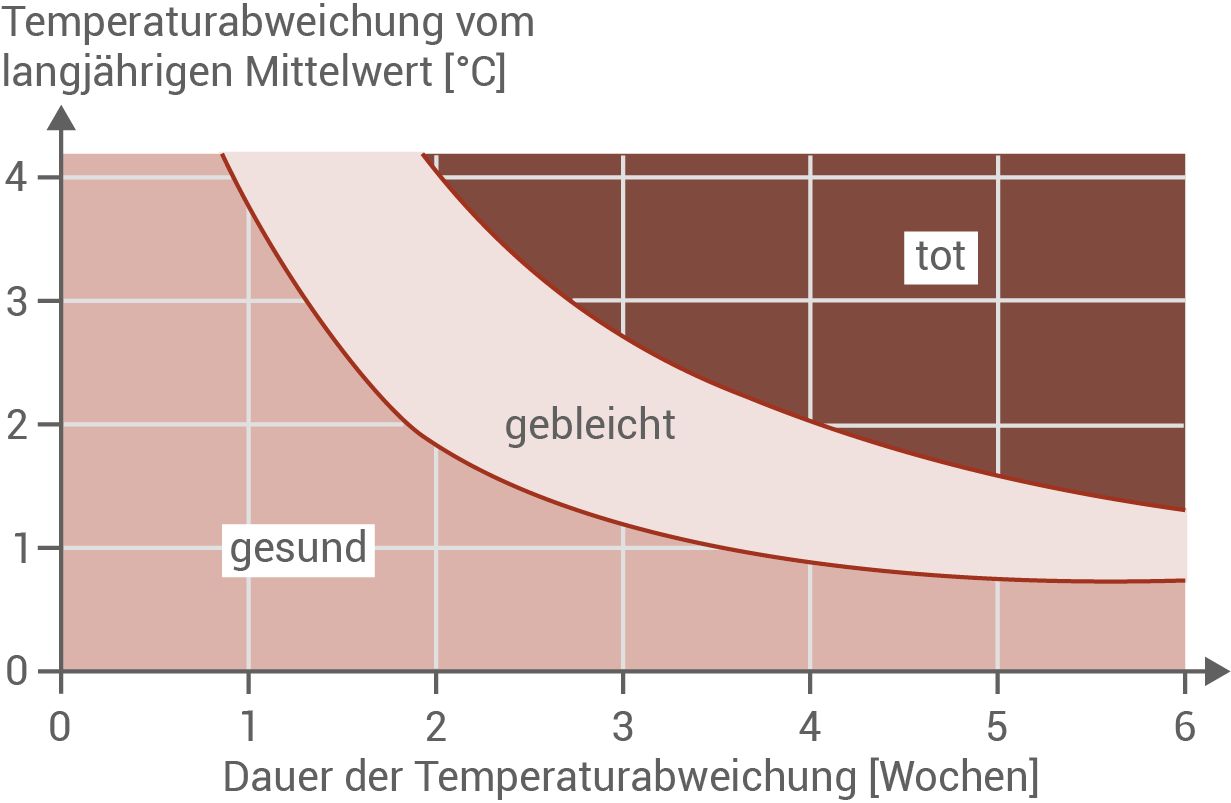
Abbildung 4.2: Auswirkung von Intensität und Dauer des Hitzestresses auf die Korallengesundheit
Material 5
Möglichkeiten der Anpassung an veränderte Temperaturen (Akklimatisierung)
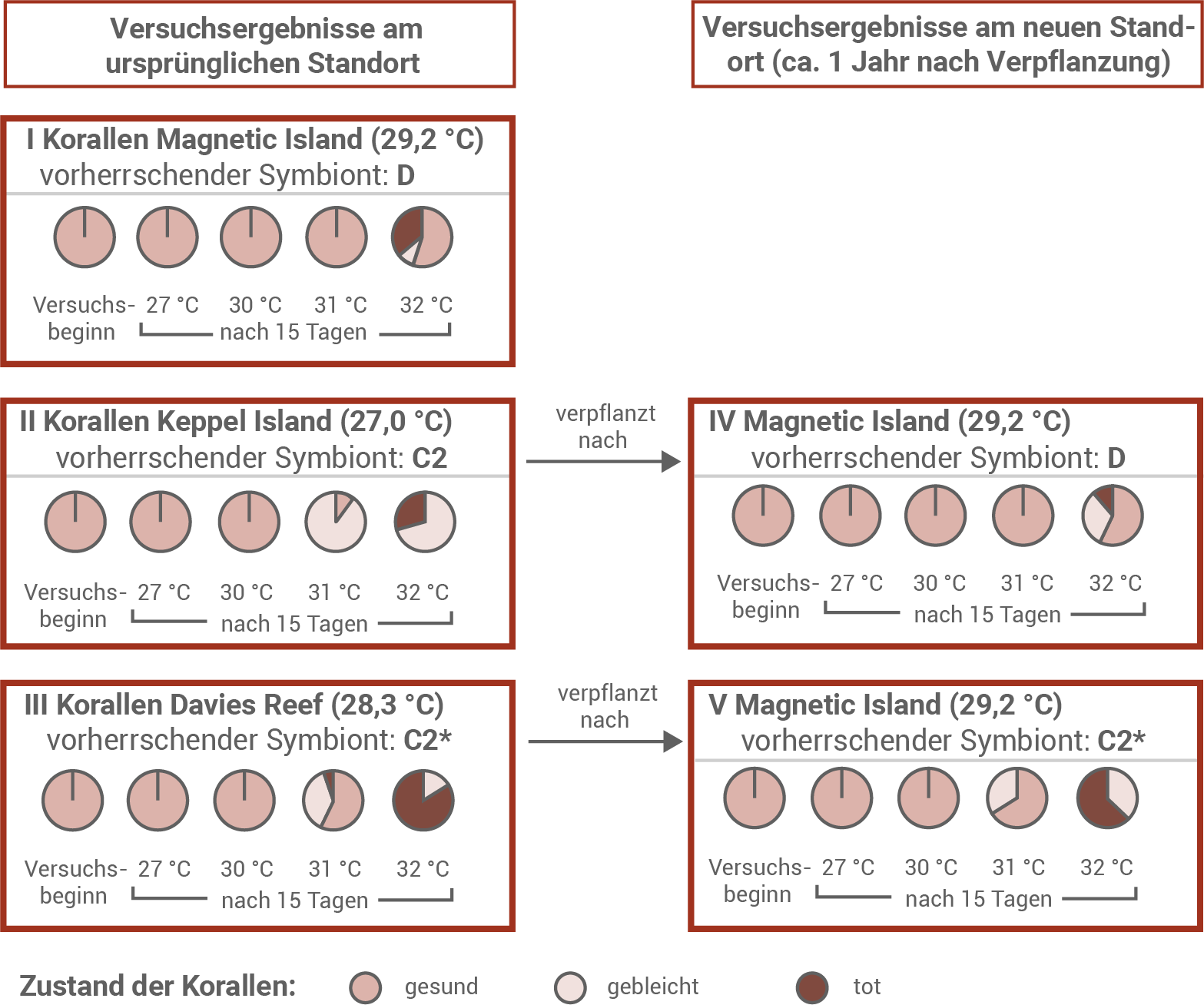
Ein australisches Forschungsteam führte im australischen Great Barrier Reef mit der Steinkoralle Acropora millepora Experimente zur Akklimatisierung durch. Steinkorallen enthalten vorwiegend Zooxanthellen der Gattung Symbiodinium. Von diesen gibt es verschiedene Untergruppen. Die untersuchten Korallen enthielten jeweils eine der drei Untergruppen D, C2 und C2* als vorherrschende Symbionten. Man sieht Korallen und Symbionten als Einheit an und spricht von Holobiontentypen. Das Forschungsteam untersuchte Korallen von drei verschiedenen Riffen, an denen unterschiedliche Wassertemperaturen herrschen. Zusätzlich verpflanzten die Forschenden Korallen aus den Riffen der kühleren Standorte Keppel Island (27,0 °C) und Davies Reef (28,3 °C) in die wärmere Umgebung von Magnetic Island (29,2 °C). Nach ca. einem Jahr wurde die vorherrschende Zooxanthellen-Untergruppe der Korallen bestimmt und außerdem die Temperaturtoleranz der verschiedenen Kolonien unter kontrollierten Laborbedingungen getestet. Dazu wurden sowohl Ursprungskolonien als auch verpflanzte Kolonien auf vier verschieden temperierte Tanks verteilt, 27 °C diente dabei als Kontrolle. Zum Ausgangszeitpunkt (Versuchsbeginn) und nach 15 Tagen wurde der Zustand der Korallen überprüft.
Ergebnisse der Verpflanzungs- und Hitzestress-Experimente mit verschiedenen Holobiontentypen der Steinkoralle Acropora millepora
Anpassung an Temperaturveränderungen auf molekularer Ebene
Stressfaktoren, wie z. B. Hitze, wirken sich auf die Bindungskräfte innerhalb der Proteinmoleküle aus, vor allem auf die Wasserstoffbrücken, wodurch sich die räumliche Struktur der Proteine verändert. Diesen Vorgang bezeichnet man als Denaturierung.
Bei der Anpassung an Stressfaktoren spielen Stressproteine eine besondere Rolle. Sie wurden zuerst im Zusammenhang mit Temperaturerhöhungen nachgewiesen, weshalb sie auch als Hitzeschockproteine (Hsp) bezeichnet werden. Sie stellen u. a. die räumliche Struktur und damit die Funktionsfähigkeit von denaturierten Proteinen wieder her und dienen so dem Zellschutz und der Anpassung an veränderte Umweltbedingungen.
Ein Stressfaktor kann eine Veränderung der Hsp-Menge bewirken, noch bevor die Auswirkungen phänotypisch sichtbar werden. Bei der Stressantwort der Zelle spielen auch Proteine eine Rolle, die als Hitzeschutzfaktoren (Hsf) bezeichnet werden. Diese liegen kontinuierlich in den Zellen vor und können im ungebundenen Zustand durch bestimmte Proteinkinasen phosphoryliert werden. Ein gut untersuchtes Stressprotein ist das Hitzeschockprotein 70 (Hsp70).
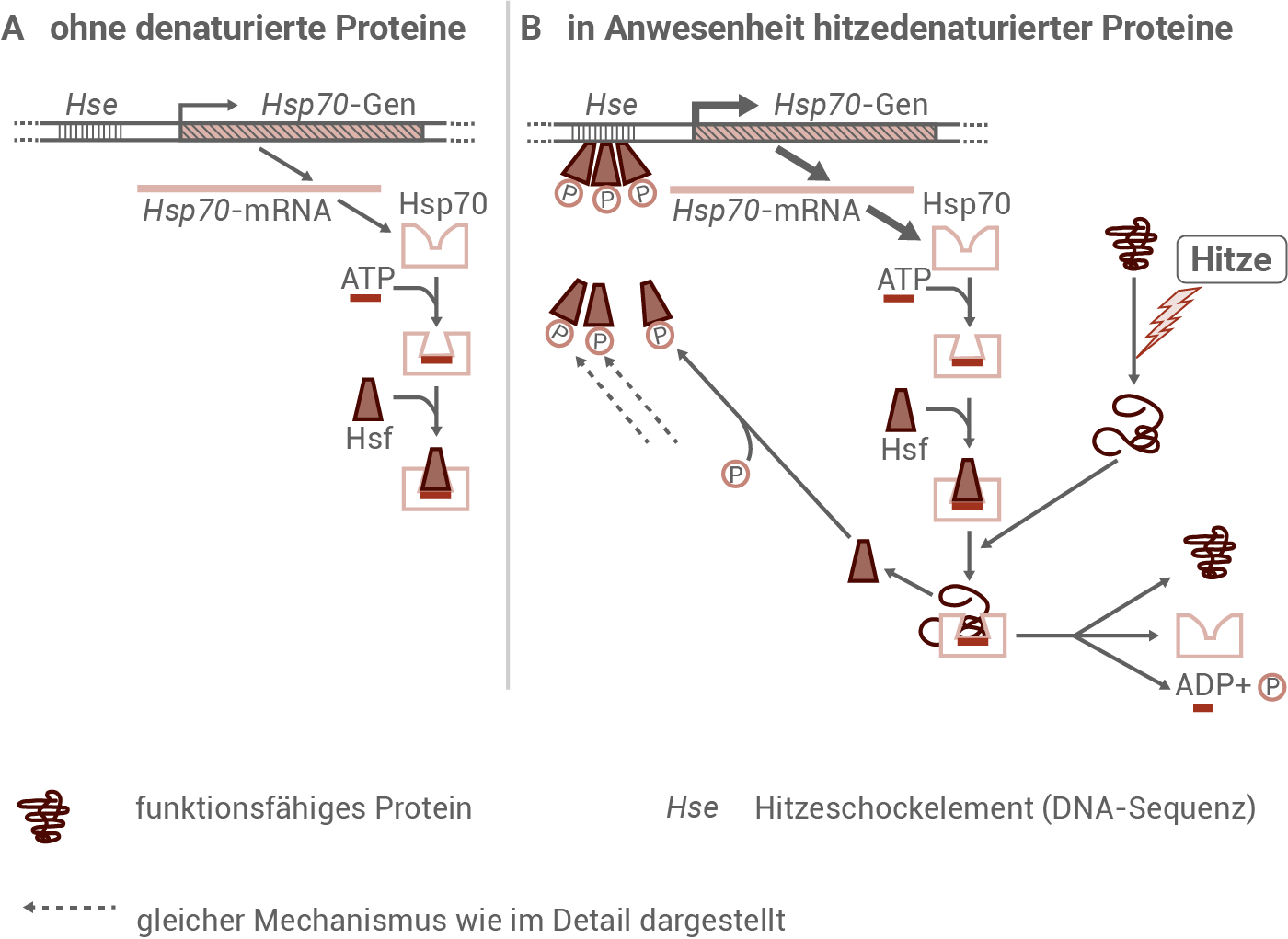
Regulation der Hsp70-Menge in eukaryotischen Zellen
Material 7
Auswirkungen von Temperaturstress auf Hsp70
Abbildung 7.1: Messung der Hsp70-Menge nach Hitzeschock
Bei der Muschelart Potamocorbula amurensis wurde die Menge an Hsp70-Protein nach einem Hitzeschock gemessen. Dazu wurden die Muscheln nach einer Eingewöhnungszeit im Labor bei 19 °C Wassertemperatur für 30 Minuten einer Temperatur von 37 °C ausgesetzt.
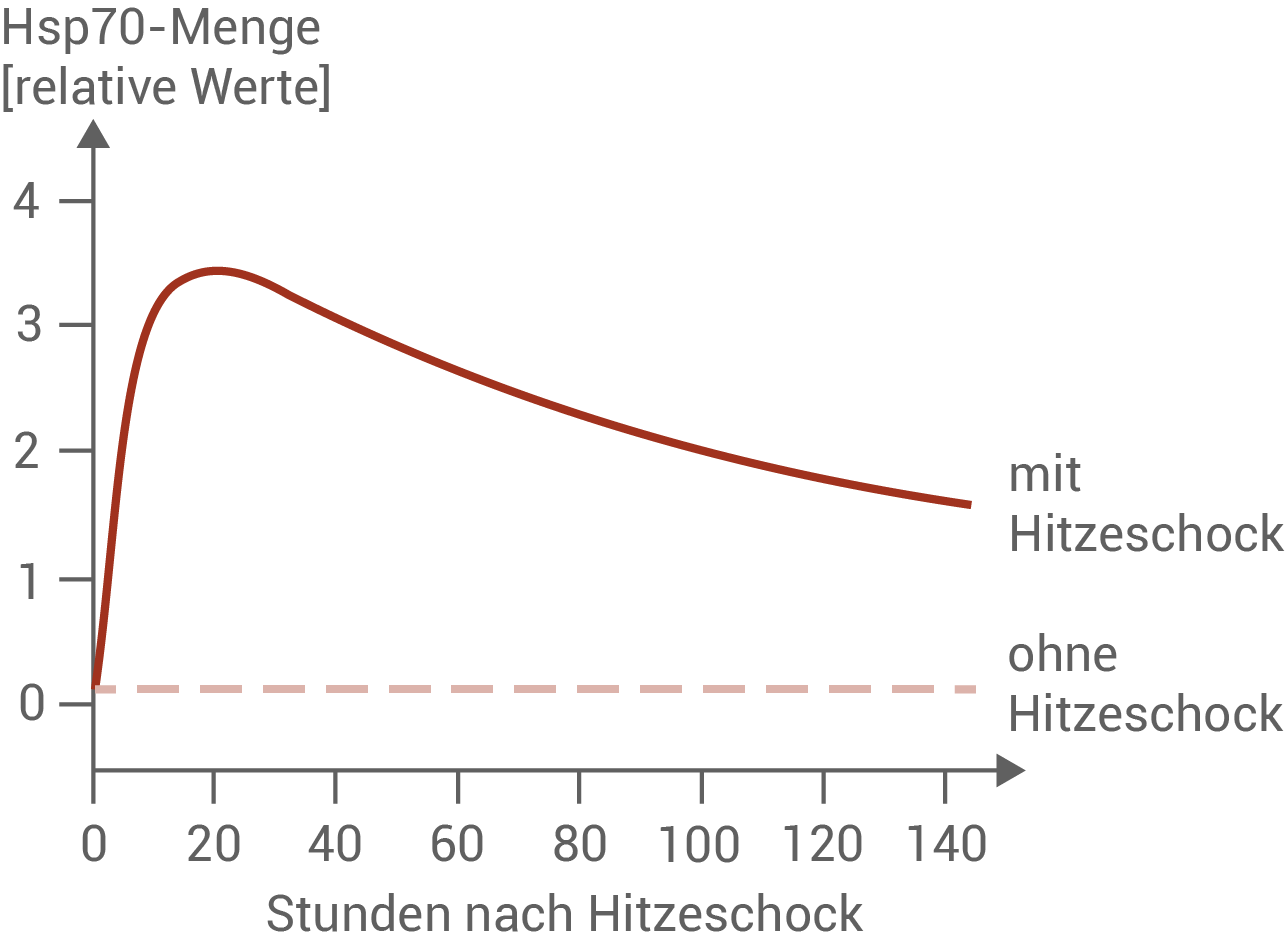
Abbildung 7.2: Wirkung verschiedener Temperaturen auf die Hsp70-Menge
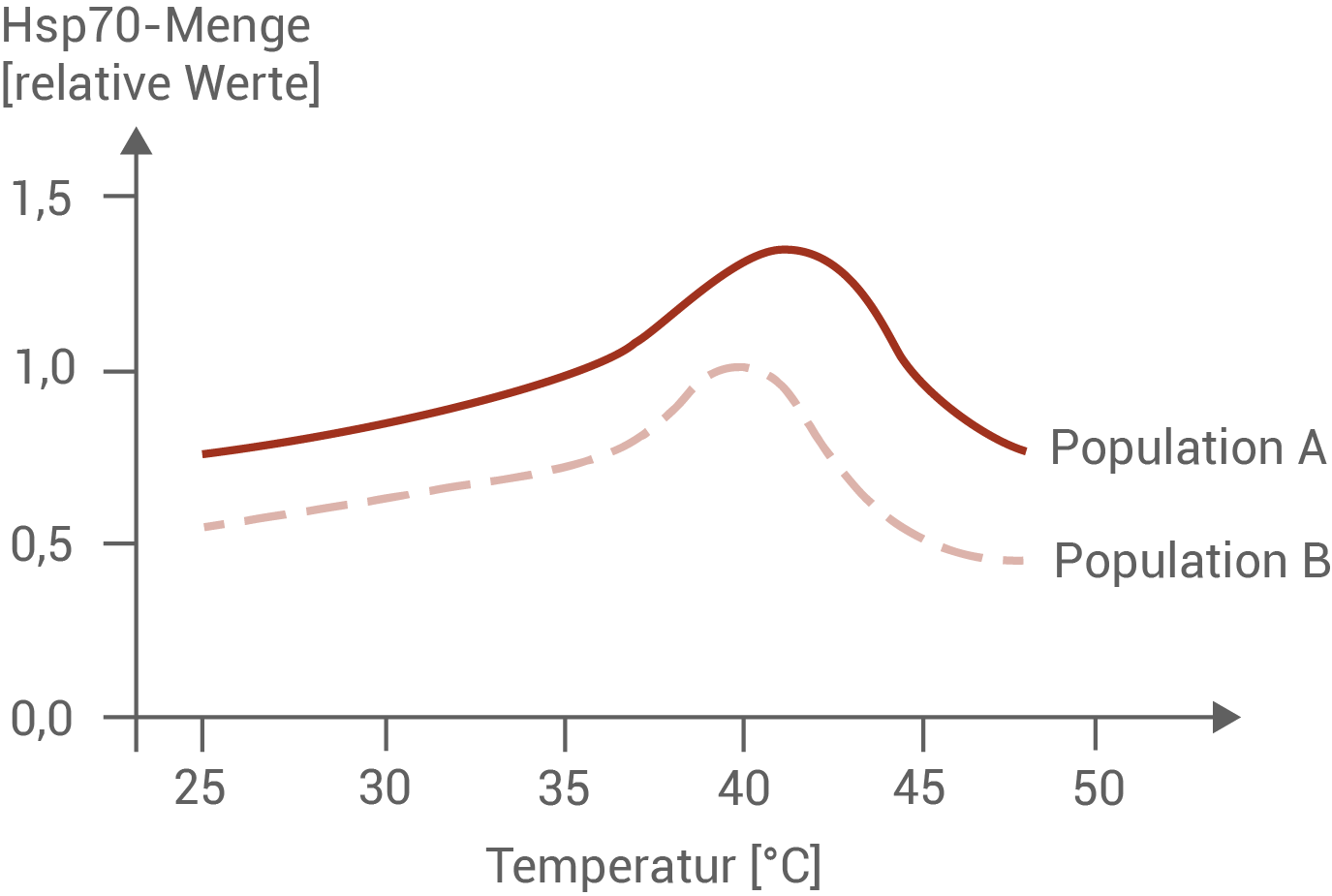
Die Menge des Hitzeschockproteins Hsp70 in Abhängigkeit von der Umgebungstemperatur wurde in verschiedenen Populationen der Heideschnecke (Xeropicta derbentina) bestimmt.
Material 8
Wirkung anderer Stressfaktoren auf die Hsp70-Menge
Hsp70 ist eines der am besten untersuchten Hitzeschockproteine, besonders im Hinblick auf eine mögliche Funktion als frühzeitiger Indikator für schädliche Umwelteinflüsse. In einer großen Anzahl von Studien wurde festgestellt, dass die Hsp70-Menge außer durch Hitze durch eine Vielzahl verschiedener Stressfaktoren erhöht wird, wie z. B. oxidativen Stress durch freie Sauerstoffradikale, erhöhte Salzkonzentration, Metall-Ionen oder Insektizide.
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Temperaturtoleranzkurve der Steinkoralle:
Merkmale einer Symbiose am Beispiel der Steinkorallen und Algen:
Eine Symbiose ist das Zusammenleben verschiedener Arten, von dem beide Partner profitieren. Im Fall von Korallen und Algen bedeutet das: Die Alge stellt der Koralle durch Fotosynthese Sauerstoff und energiereiche Stoffe wie Glucose zur Verfügung. Diese helfen der Koralle, durch Zellatmung mehr ATP zu erzeugen. Dadurch kann sie vermehrt Calciumionen (Ca2+) aus ihren Zellen ausschleusen, was die Bildung des Kalkskeletts unterstützt. Im Gegenzug bietet die Koralle der Alge einen geschützten Lebensraum in ihren Zellen (Endosymbiose) sowie Kohlenstoffdioxid, das bei ihrer Zellatmung entsteht und von der Alge für die Fotosynthese genutzt wird.Funktionen der Blattpigmente bei der Fotosynthese grüner Pflanzen:
Die verschiedenen Blattfarbstoffe in den Lichtsammelkomplexen nehmen Licht unterschiedlicher Wellenlängen auf. Die dabei gewonnene Energie wird an die Reaktionszentren der Fotosysteme I und II weitergeleitet. Dort geben angeregte Chlorophyll-a-Moleküle Elektronen an die Elektronentransportkette ab.Unterschiede des Absorptionsspektrums grüner Laubblätter von Sparmannia africana und von Algen der Gattung Symbiodinium:
Im blauen Wellenlängenbereich (um 440 nm) erreichen Landpflanzen ein Absorptionsmaximum, danach nimmt die Lichtaufnahme jedoch stark ab. Im grünen Bereich bleibt ihre Absorption durchgehend sehr gering – daher spricht man auch von der sogenannten „Grünlücke“. Algen hingegen absorbieren im blauen Bereich weiterhin viel Licht und zeigen erst im grünen Bereich einen Rückgang. Dadurch können Algen grünes Licht deutlich besser nutzen als etwa eine Zimmerlinde. Im gelb-orangen Bereich (630–650 nm) nimmt die Lichtaufnahme bei Landpflanzen wieder zu, während sie bei Algen niedrig bleibt. Außerdem ist das Absorptionsmaximum im roten Bereich bei Algen gegenüber dem der Landpflanzen zu längeren Wellenlängen hin verschoben.Besonderheiten des Absoptionsspektrums von Symbiodinium als Angepasstheit an das Meer als Lebensraum:
Im Meer wird Sonnenlicht je nach Wellenlänge unterschiedlich stark absorbiert. Aufgrund dessen dringen die verschiedenen Farben unterschiedlich tief ins Wasser ein. In den oberen, lichtreichen Wasserschichten sind zwar blaues, grünes und rotes Licht vorhanden, die Algen zur Fotosynthese nutzen können, allerdings kann intensives blaues Licht in diesen Bereichen die Algen auch schädigen. Grünes Licht hingegen gelangt deutlich tiefer ins Wasser und steht den Algen daher auch in größerer Tiefe zur Verfügung. Weil Algen grünes Licht gut aufnehmen können, erhalten sie selbst in tieferen Schichten ausreichend Lichtenergie für die Fotosynthese – und sind gleichzeitig vor dem schädlichen Einfluss des blauen Lichts geschützt.Auswertung der Untersuchungsergebnisse:
Die Versuchsergebnisse zeigen, dass ausschließlich lebende Korallen GFP (Green Fluorescent Protein) enthalten und daher zur Fluoreszenz fähig sind – im Gegensatz zu toten Korallenskeletten. Diese Fluoreszenz tritt jedoch nur bei Bestrahlung mit blauem Licht auf. Darüber hinaus deuten die Ergebnisse darauf hin, dass Algen stark vom grün fluoreszierenden Licht angezogen werden. Sie zeigen eine gerichtete Bewegung hin zur Lichtquelle des grünen Lichts (positive Fototaxis), sodass sich dort eine mehr als fünffach höhere Algendichte ansammelt als bei Korallen, die keine Fluoreszenz aufweisen. In geringerem Maße reagieren die Algen auch auf grünes Licht, das lediglich von den Korallen reflektiert wird.Funktion der Fluoreszenz für Steinkorallen und Algen:
Da die symbiotischen Algen bei der sexuellen Fortpflanzung der Korallen in der Regel nicht direkt auf die Nachkommen übertragen werden, muss jeder junge Korallenpolyp erneut von Algen besiedelt werden. Für sesshafte Jungpolypen ist eine frühe Aufnahme der Symbionten von Vorteil, da die Symbiose das Wachstum signifikant fördert. Die grünliche Fluoreszenz der Korallen wirkt dabei als Lockreiz auf freischwimmende Algen, die durch positive Fototaxis angelockt werden und anschließend eine Symbiose mit den Steinkorallen eingehen – ein Vorgang, von dem beide Partner profitieren. Zudem schützt die Absorption des energiereichen blauen Lichts durch die Koralle die Algen in oberflächennahen Wasserschichten vor schädlicher Strahlung. Nicht absorbiertes Blaulicht kann von der Koralle in grünes Fluoreszenzlicht umgewandelt werden, das von den Algen effizienter zur Fotosynthese genutzt werden kann. Diese gesteigerte Photosyntheseleistung fördert wiederum das Wachstum beider Organismen und stärkt die Symbiose.Einfluss der Wassertemperatur auf die Korallen:
- Abbildung 4.1 zeigt: Steigt die Wassertemperatur an, stoßen die Korallenpolypen innerhalb weniger Tage bis Wochen ihre symbiotischen Algen (Zooxanthellen) ab – ein Prozess, der zur sogenannten Korallenbleiche führt, da die farbgebenden Algen fehlen. Sofern die Temperaturerhöhung nur kurzfristig andauert, sind die Polypen in der Lage, ihre Symbionten erneut aufzunehmen und sich zu regenerieren. Die Rückkehr zum gesunden, farbigen Zustand benötigt jedoch deutlich mehr Zeit als das Ausbleichen – in der Regel mehrere Wochen bis Monate bei Normaltemperatur. Hält die Überwärmung hingegen über einen längeren Zeitraum an, sterben die Korallen ab. Tote Korallen können keine Zooxanthellen mehr aufnehmen; es verbleibt lediglich das weiße Kalkskelett, das häufig von dunkelgrünen Fadenalgen überwachsen wird.
- Abbildung 4.2 verdeutlicht: Sowohl die Höhe als auch die Dauer der Temperaturerhöhung über das langjährige Mittel hinaus wirken sich entscheidend auf die Korallengesundheit aus. Je höher die Abweichung und je länger sie anhält, desto rascher treten Korallenbleiche und Mortalität ein. So führt beispielsweise eine Temperaturerhöhung von 4 °C bereits nach einer Woche zur Bleiche und nach zwei Wochen zum Absterben der Korallen. Bei einer moderateren Erhöhung um 2 °C setzt die Bleiche erst nach zwei Wochen ein, das Absterben erfolgt in diesem Fall nach etwa vier Wochen.
Analyse der Ergebnisse aus Material 5
Die Korallen von Magnetic Island (Gruppe I) stammen aus dem Gebiet mit der höchsten durchschnittlichen Wassertemperatur (29,2 °C) und zeigen daher die stärkste thermische Anpassung. Sie reagieren erst bei einer Wassertemperatur von 32 °C mit Stresssymptomen. Zu diesem Zeitpunkt stoßen etwa 50 % der Korallen ihre symbiotischen Algen der Untergruppe Symbiodinium D ab. Nur ein geringer Teil dieser gebleichten Korallen überlebt, der Großteil stirbt ab.
Korallen aus kühleren Riffregionen (Gruppen II und III) zeigen bereits bei 31 °C erste Stressreaktionen. Die Keppel-Korallen (Gruppe II), die aus der kältesten Herkunftsregion stammen, sind dabei stärker betroffen als die Davies-Korallen (Gruppe III): Bei 31 °C sind sieben von acht Keppel-Korallen gebleicht, während bei den Davies-Korallen noch mehr als die Hälfte gesund bleibt. Bei 32 °C kehrt sich dieses Bild jedoch um – nun sterben deutlich mehr Davies-Korallen als Keppel-Korallen ab.
Korallen aus kühleren Riffregionen (Gruppen II und III) zeigen bereits bei 31 °C erste Stressreaktionen. Die Keppel-Korallen (Gruppe II), die aus der kältesten Herkunftsregion stammen, sind dabei stärker betroffen als die Davies-Korallen (Gruppe III): Bei 31 °C sind sieben von acht Keppel-Korallen gebleicht, während bei den Davies-Korallen noch mehr als die Hälfte gesund bleibt. Bei 32 °C kehrt sich dieses Bild jedoch um – nun sterben deutlich mehr Davies-Korallen als Keppel-Korallen ab.
Im Gegensatz dazu zeigt das Davies-Transplantat (Gruppe V) eine deutlich geringere Akklimatisierungsfähigkeit. Bei diesen Korallen lässt sich kein Wechsel der Symbionten-Untergruppe feststellen. Die erste Stressreaktion erfolgt weiterhin bereits bei 31 °C, die Auswirkungen sind aber etwas schwächer als bei den nicht verpflanzten Davies-Korallen: Bei 31 °C sterben noch keine Tiere, bei 32 °C ist der Anteil abgestorbener Korallen immerhin geringer als in der Ausgangspopulation. Die Ergebnisse deuten darauf hin, dass die Fähigkeit zur Akklimatisierung vor allem von der Flexibilität im Austausch der symbiotischen Algen-Untergruppen abhängt und somit eine wesentliche Rolle für die Temperaturtoleranz der Korallen spielt.
Beschreibung der vier Strukturebenen von Proteinen:
- Primärstruktur: Die Primärstruktur eines Proteins bezeichnet die lineare Abfolge der einzelnen Aminosäuren in der Polypeptidkette. Diese sind über Peptidbindungen kovalent miteinander verknüpft und bestimmen die weitere Struktur und Funktion des Proteins.
- Sekundärstruktur: Die Sekundärstruktur beschreibt die regelmäßige räumliche Anordnung von Abschnitten der Polypeptidkette, insbesondere in Form von α-Helices und β-Faltblättern. Diese Strukturelemente werden durch Wasserstoffbrücken zwischen den Peptidbindungen stabilisiert.
- Tertiärstruktur: Die Tertiärstruktur umfasst die vollständige dreidimensionale Faltung der gesamten Polypeptidkette, einschließlich Helix-, Faltblatt- und unstrukturierter Bereiche. Sie wird durch Wechselwirkungen zwischen den Seitenketten (Restgruppen) der Aminosäuren stabilisiert, etwa durch Van-der-Waals-Kräfte, Wasserstoffbrücken, Disulfidbrücken oder Ionenbindungen.
- Quartärstruktur: Die Quartärstruktur liegt vor, wenn ein Protein aus mehreren Polypeptidketten (Untereinheiten) besteht. Diese Untereinheiten sind durch dieselben Bindungskräfte wie bei der Tertiärstruktur miteinander verbunden und bilden gemeinsam ein funktionelles Gesamtmolekül.
Substratinduktion bei Prokaryoten:
Bei der Substratinduktion codiert das Regulatorgen für einen aktiven Repressor, der an die Operatorregion eines Operons binden kann. Durch diese Bindung wird die Transkription der nachfolgenden Strukturgene blockiert, die für Enzyme zum Abbau eines bestimmten Substrats verantwortlich sind. Ist jedoch ausreichend Substrat in der Zelle vorhanden, bindet es spezifisch an den Repressor und bewirkt dadurch eine Konformationsänderung des Proteins. Infolge dieser strukturellen Veränderung verliert der Repressor seine Fähigkeit, an den Operator zu binden. Dadurch wird die DNA an dieser Stelle zugänglich, und die RNA-Polymerase kann am Promotor andocken und die Transkription der Strukturgene einleiten. Es erfolgt die Synthese der entsprechenden Polypeptide, mit denen das Substrat abgebaut werden kann.Regulation der Hsp70-Menge:
Unter normalen Bedingungen, also bei Abwesenheit denaturierter Proteine, wird das Hsp70-Gen nur in geringem Maße transkribiert und translatiert. Das Hitzeschockfaktor-Protein (Hsf) bindet in seiner inaktiven Form an das Hsp70-Protein, das zuvor durch ATP-Bindung aktiviert wurde. Kommt es jedoch zu Hitzestress, sammeln sich vermehrt denaturierte Proteine in der Zelle an. Diese binden bevorzugt an die Hsp70-Proteine und verdrängen dadurch die Hsf-Moleküle. Infolgedessen steigt die Konzentration an freiem Hsf in der Zelle. Die freien Hsf-Proteine werden anschließend phosphoryliert, wobei sich je drei phosphorylierte Moleküle zu einem Hsf-Trimer zusammenlagern. Dieses Trimer bindet an spezifische DNA-Abschnitte – sogenannte HSEs (heat shock elements) – im Promotorbereich des Hsp70-Gens. Dort wirken die Hsf-Trimer als Transkriptionsfaktoren bzw. Aktivatoren und fördern die Transkription. Die Folge ist eine verstärkte Expression des Hsp70-Gens und somit eine erhöhte Produktion des Hsp70-Proteins, das denaturierte Proteine stabilisieren oder deren Rückfaltung unterstützen kann.Wie der Regulationsmechanismus zur verstärkten Hitzetoleranz beiträgt:
Hitzestress führt dazu, dass vermehrt zelluläre Proteine denaturieren, also ihre natürliche Raumstruktur und damit ihre Funktion verlieren. Die Anhäufung dieser denaturierten Proteine löst eine verstärkte Expression des Hsp70-Gens aus, wodurch mehr Hsp70-Proteine synthetisiert werden. Diese wirken als molekulare Chaperone, indem sie denaturierte Proteine binden und deren Rückfaltung in die funktionelle Konformation ermöglichen. Auf diese Weise kann der Hitzeschaden teilweise rückgängig gemacht werden, sodass die betroffenen Proteine ihre physiologische Funktion innerhalb der Zelle wieder ausüben können.Auswertung der Untersuchung:
- Abbildung 7.1 zeigt, dass die Hsp70-Konzentration in Muscheln nach einem Hitzeschock innerhalb von etwa 20 Stunden stark ansteigt. Auffällig ist, dass der erhöhte Proteingehalt auch lange nach dem Ende der Hitzeeinwirkung bestehen bleibt – über einen Zeitraum von mehr als 140 Stunden bleibt die Hsp70-Menge deutlich über dem Ausgangsniveau. Dies deutet auf eine nachhaltige Aktivierung des zellulären Stressprogramms hin.
- Abbildung 7.2 veranschaulicht, dass die Hsp70-Menge bei Schnecken temperaturabhängig ist: Die Proteinmenge steigt mit zunehmender Temperatur an und erreicht ihr Maximum im Bereich von etwa 40 bis 42 °C. Zudem zeigen sich populationsspezifische Unterschiede: Schnecken der Population A weisen über den gesamten Temperaturbereich hinweg höhere Hsp70-Werte auf als Individuen der Population B, was auf eine unterschiedliche thermische Anpassung oder genetische Ausstattung hindeutet.
Prüfung eines möglichen Nutzens von Hsp70 zum Nachweis der Wirkung von Stressfaktoren:
Da die Hsp70-Konzentration nicht ausschließlich durch Hitze, sondern auch durch andere Stressfaktoren erhöht werden kann, eignet sich dieses Protein lediglich als unspezifischer Indikator für das Vorliegen von Stressbelastungen (vgl. Material 8). Es erlaubt jedoch keine Aussage über die Art des auslösenden Faktors. Zudem liefert ein einzelner Messwert keinen Hinweis darauf, ob es sich um eine akute Stressreaktion handelt oder ob der Stressor bereits in der Vergangenheit wirksam war (vgl. Abbildung 7.1). Ein weiterer limitierender Faktor für die Aussagekraft der Hsp70-Messung besteht darin, dass sich die Hsp70-Mengen selbst innerhalb einer Art zwischen verschiedenen Populationen unterscheiden können (vgl. Abbildung 7.2). Daher sind Hsp70-Werte nur dann vergleichbar und belastbar, wenn sie im Kontext einer Kontrollgruppe aus derselben Population und unter identischen Umweltbedingungen erhoben werden.