Aufgabe 1 – Kohlenstoffdioxid
Die Konzentration von Kohlenstoffdioxid in der Atmosphäre hat seit Beginn der Messungen im Jahr 1958 stetig zugenommen.
1
Große Mengen des Kohlenstoffdioxids in der Atmosphäre werden von den Weltmeeren aufgenommen. Hierbei laufen drei Teilprozesse ab, die durch die Reaktionsgleichungen A, B und C ausgedrückt werden.









A:
B:
C:
1.1
Der größte Teil des vom Wasser aufgenommenen Kohlenstoffdioxids liegt in der hydratisierten Form  vor. Davon reagiert nur ein kleiner Teil zu Oxonium-Ionen weiter und wirkt sich so auf den pH-Wert des Meerwassers aus.
vor. Davon reagiert nur ein kleiner Teil zu Oxonium-Ionen weiter und wirkt sich so auf den pH-Wert des Meerwassers aus.
- Begründe mithilfe einer geeigneten Strukturformeldarstellung, dass bei der Hydratation von Kohlenstoffdioxid-Molekülen Wasserstoffbrücken ausgebildet werden können.
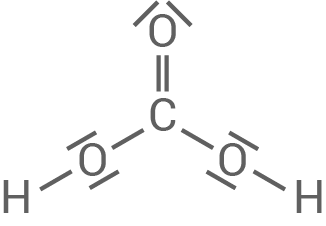
- Zeichne die Strukturformel des Kohlensäure-Moleküls in LEWIS-Schreibweise (mit bindenden und nichtbindenden Elektronenpaaren).
- Erkläre ausgehend von Reaktionsgleichung C das Säure-Base-Konzept nach BRØNSTED.
- Erläutere die Auswirkung einer zunehmenden Konzentration von Kohlenstoffdioxid in der Atmosphäre auf den pH-Wert des Meerwassers nach dem Prinzip von LE CHATELIER.
(16 BE)
1.2
In einem Schulexperiment soll ausgehend von der abgebildeten Apparatur (Abbildung 1) bestimmt werden, welcher Anteil des Kohlenstoffdioxids zu Oxonium-Ionen weiterreagiert. Kolbenprober 1 ist mit  Kohlenstoffdioxid befüllt. In der Waschflasche befinden sich
Kohlenstoffdioxid befüllt. In der Waschflasche befinden sich  schwach saures demineralisiertes Wasser
schwach saures demineralisiertes Wasser 
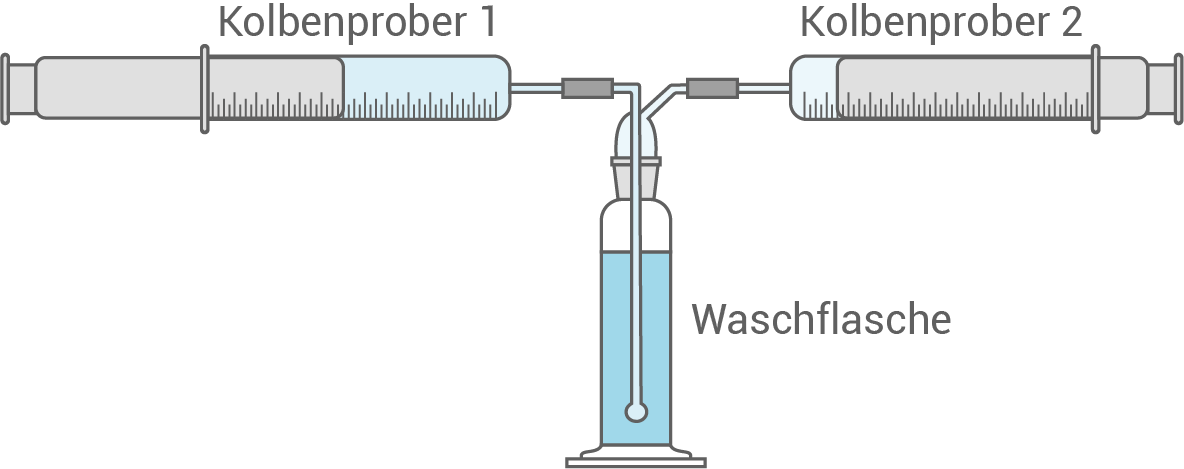 Das Kohlenstoffdioxid aus Kolbenprober 1 wird langsam durch die Waschflasche geleitet. Der
Das Kohlenstoffdioxid aus Kolbenprober 1 wird langsam durch die Waschflasche geleitet. Der  -Wert des Wassers verringert sich dabei von
-Wert des Wassers verringert sich dabei von  auf
auf  In Kolbenprober 2 wird am Ende des Versuchs ein Volumen von
In Kolbenprober 2 wird am Ende des Versuchs ein Volumen von  Kohlenstoffdioxid gemessen.
Kohlenstoffdioxid gemessen.

Abbildung 1: Schematische Darstellung des Experiments
- Berechne die Stoffmenge an Kohlenstoffdioxid, die bei diesem Experiment vom Wasser aufgenommen wurde.
Hinweis: Verwende als molares Volumen - Zeige durch Berechnung, dass sich bei dem Experiment die Konzentration der Oxonium-Ionen um
erhöht.
- Bestimme den Anteil des vom Wasser aufgenommenen Kohlenstoffdioxids, der zu der oben angegebenen
-Wert-Änderung führt.
(8 BE)
2
Zur Verminderung der Kohlenstoffdioxid-Emission wird Wasserstoff als Energieträger verwendet. Um Wasserstoff zu speichern, werden seit einigen Jahren organische Flüssigkeiten eingesetzt, z. B. Dibenzyltoluol (DBT). Hierbei wird DBT zu Perhydro-DBT hydriert. Durch Dehydrierung von Perhydro-DBT kann der gespeicherte Wasserstoff wieder freigesetzt werden (Abbildung 2).
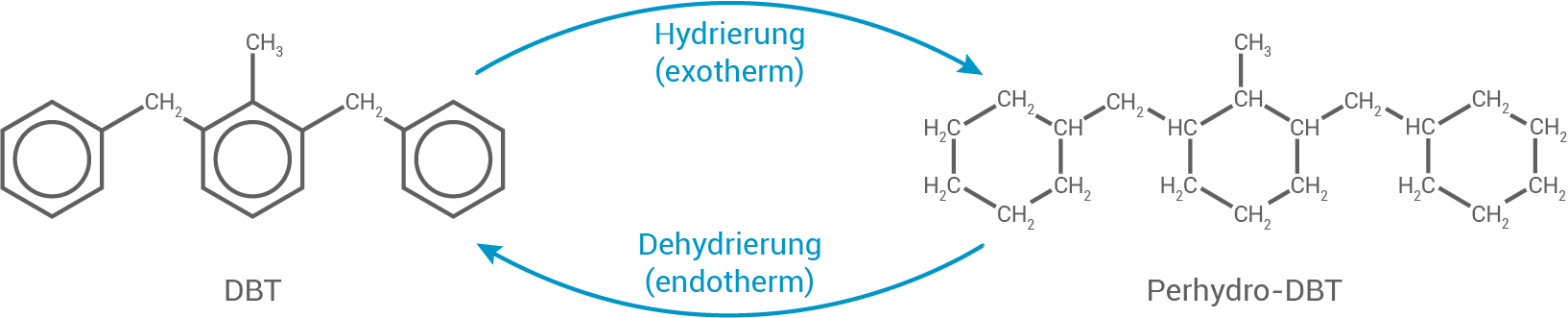

Abbildung 2: Schematische Darstellung der Prozesse für die Speicherung und Freisetzung von Wasserstoff
- Stelle die Reaktionsgleichung für die Dehydrierung von Perhydro-DBT als Gleichgewichtsreaktion auf.
- Erkläre, wie die Ausbeute von Wasserstoff durch Änderung der Temperatur und durch Änderung des Drucks erhöht werden kann.
- Berechne die Masse an Wasserstoff, die bei der Dehydrierung von
Perhydro-DBT maximal freigesetzt werden kann.
Hinweis: Verwende als Dichte von Perhydro-DBT
(16 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Begründung der Ausbildung von Wasserstoffbrückenbindungen
Dass bei der Hydratation von Kohlenstoffdioxid-Molekülen Wasserstoffbrückenbindungen ausgebildet werden können, liegt an der Polarität der beteiligten Atome. Das Sauerstoffatom hat eine hohe Elektronegativität und zieht Bindungselektronen stärker an sich, wodurch am Sauerstoffatom eine negative Teilladung  und am Wasserstoffatom eine positive Teilladung
und am Wasserstoffatom eine positive Teilladung  entsteht. Ebenfalls wichtig für die Wasserstoffbrückenbindung ist das freie Elektronenpaar des Sauerstoffatoms, mit dem das Wasserstoffatom wechselwirken kann.
entsteht. Ebenfalls wichtig für die Wasserstoffbrückenbindung ist das freie Elektronenpaar des Sauerstoffatoms, mit dem das Wasserstoffatom wechselwirken kann.
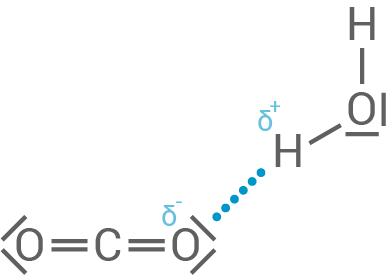 In diesem Fall ist das Wasser-Molekül der Protonendonor (Wasserstoffatom gebunden an stark elektronegatives Atom) und das Kohlenstoffdioxid-Molekül der -akzeptor (nichtbindendes Elektronenpaar des Sauerstoffatoms). Dadurch können die Sauerstoffatome des
In diesem Fall ist das Wasser-Molekül der Protonendonor (Wasserstoffatom gebunden an stark elektronegatives Atom) und das Kohlenstoffdioxid-Molekül der -akzeptor (nichtbindendes Elektronenpaar des Sauerstoffatoms). Dadurch können die Sauerstoffatome des  -Moleküls Wasserstoffbrückenbindungen mit den Wasserstoffatomen des Wassermoleküls eingehen.
Strukturformel des Kohlensäure-Moleküls
-Moleküls Wasserstoffbrückenbindungen mit den Wasserstoffatomen des Wassermoleküls eingehen.
Strukturformel des Kohlensäure-Moleküls
 Erklärung des Säure-Base-Konzepts nach BRØNSTED
Nach dem Säure-Base-Konzept von BRØNSTED ist eine Säure ein Protonendonator und eine Base ein Protonenakzeptor.
Erklärung des Säure-Base-Konzepts nach BRØNSTED
Nach dem Säure-Base-Konzept von BRØNSTED ist eine Säure ein Protonendonator und eine Base ein Protonenakzeptor.
In Reaktionsgleichung C fungiert das Kohlensäure-Molekül als Säure, da es ein Proton
als Säure, da es ein Proton  an das Wasser-Molekül
an das Wasser-Molekül  abgibt. Dieses fungiert hier wiederum als Base. Durch diesen Protonenübergang von Kohlensäure zu Wasser (Säure-Base-Reaktion) entstehen Hydrogencarbonat-Ionen
abgibt. Dieses fungiert hier wiederum als Base. Durch diesen Protonenübergang von Kohlensäure zu Wasser (Säure-Base-Reaktion) entstehen Hydrogencarbonat-Ionen  und Oxonium-Ionen
und Oxonium-Ionen  Erläuterung der Auswirkungen einer zunehmenden Konzentration
Nach dem Prinzip von LE CHATELIER wird ein System, das sich im Gleichgewicht befindet, einem äußeren Zwang (wie z. B. einer Konzentrationsänderung) so entgegenwirken, dass das Gleichgewicht wiederhergestellt wird. Eine erhöhte Konzentration von
Erläuterung der Auswirkungen einer zunehmenden Konzentration
Nach dem Prinzip von LE CHATELIER wird ein System, das sich im Gleichgewicht befindet, einem äußeren Zwang (wie z. B. einer Konzentrationsänderung) so entgegenwirken, dass das Gleichgewicht wiederhergestellt wird. Eine erhöhte Konzentration von  in der Atmosphäre führt zu einer erhöhten Aufnahme von
in der Atmosphäre führt zu einer erhöhten Aufnahme von  in das Meerwasser (Reaktion A). Das fördert wiederum die Bildung von Kohlensäure (Reaktion B) und deren Dissoziation zu
in das Meerwasser (Reaktion A). Das fördert wiederum die Bildung von Kohlensäure (Reaktion B) und deren Dissoziation zu  ⁻ und
⁻ und  (Reaktion C). Die erhöhte Konzentration von
(Reaktion C). Die erhöhte Konzentration von  -Ionen führt zu einer Absenkung des pH-Wertes des Meerwassers, da das Meerwasser saurer wird.
-Ionen führt zu einer Absenkung des pH-Wertes des Meerwassers, da das Meerwasser saurer wird.


In Reaktionsgleichung C fungiert das Kohlensäure-Molekül
1.2
Berechnung der aufgenommenen  -Stoffmenge
Für die Berechnung wird zunächst das aufgenommene
-Stoffmenge
Für die Berechnung wird zunächst das aufgenommene  -Volumen bestimmt:
-Volumen bestimmt:
 Weiterhin gilt:
Weiterhin gilt:
![\(\begin{array}[t]{rll}
n &=& \dfrac{V}{V_m} & \\[5pt]
&=& \dfrac{55\,\text{mL}}{24,5\,\text{L} \cdot \text{mol}^{-1}} & \\[5pt]
&=& \dfrac{55 \cdot 10^{-3}\,\text{L}}{24,5\,\text{L} \cdot \text{mol}^{-1}} & \\[5pt]
&\approx& 2,24 \cdot 10^{-3}\,\text{mol}
\end{array}\)](https://www.schullv.de/resources/formulas/f2ad49c9bace7b1bc8fe30f9589eadc2378d4a6772df2425c55540fe7f8332c8_light.svg) Das Wasser nimmt bei diesem Experiment eine Stoffmenge von etwa
Das Wasser nimmt bei diesem Experiment eine Stoffmenge von etwa  an Kohlenstoffdioxid auf.
Berechnung der Konzentrationsänderung der Oxonium-Ionen
Für die Berechnung der Konzentration gilt:
an Kohlenstoffdioxid auf.
Berechnung der Konzentrationsänderung der Oxonium-Ionen
Für die Berechnung der Konzentration gilt:
 Es folgt für die Konzentrationsänderung:
Die Berechnung der Konzentrationsveränderung zeigt, dass sich bei dem Experiment die Konzentration der Oxonium-Ionen um
Es folgt für die Konzentrationsänderung:
Die Berechnung der Konzentrationsveränderung zeigt, dass sich bei dem Experiment die Konzentration der Oxonium-Ionen um  erhöht.
Bestimmung des Anteils des aufgenommenen
erhöht.
Bestimmung des Anteils des aufgenommenen  Das Volumen des Wassers in der Waschflasche beträgt
Das Volumen des Wassers in der Waschflasche beträgt  Um zu berechnen, wie viel
Um zu berechnen, wie viel  zur Änderung des
zur Änderung des  -Werts führt, wird zuerst die Gesamtzunahme an
-Werts führt, wird zuerst die Gesamtzunahme an  -lonen berechnet:
Da für die Bildung jedes Oxonium-Ions ein Kohlenstoffdioxid-Molekül weiter reagieren muss, gilt:
-lonen berechnet:
Da für die Bildung jedes Oxonium-Ions ein Kohlenstoffdioxid-Molekül weiter reagieren muss, gilt:
 Für den Anteil an aufgenommenem Kohlenstoffdioxid, das weiterreagiert, folgt:
Für den Anteil an aufgenommenem Kohlenstoffdioxid, das weiterreagiert, folgt:
![\(\begin{array}[t]{rll}
\text { Anteil }&=& \dfrac{n_2(CO_2)}{n_1(CO_2)} & \\[5pt]
&=& \dfrac{1,53 \cdot 10^{-5} \,\text{mol}}{2,24 \cdot 10^{-3}\,\text{mol}} & \\[5pt]
&\approx& 6,83 \cdot 10^{-3}
\end{array}\)](https://www.schullv.de/resources/formulas/9be80ad213abe7d0859f218447e35ad656f83513eb09f8e3081d934ae20f6a66_light.svg) Der Anteil entspricht etwa
Der Anteil entspricht etwa  des aufgenommenen
des aufgenommenen 
2
Reaktionsgleichung für die Dehydrierung von Perhydro-DBT


 Erhöhung der Wasserstoff-Ausbeute durch Temperatur- und Druckänderung
Nach dem Prinzip von LE CHATELIER wird ein System, das sich im Gleichgewicht befindet, einem äußeren Zwang so entgegenwirken, dass das Gleichgewicht wiederhergestellt wird.
Bei der Dehydrierung von Perhydro-DBT wird Wasserstoff freigesetzt. Da es sich um eine endotherme Reaktion handelt, wird sie durch eine Temperaturerhöhung begünstigt. Zudem führt die Reaktion zur Bildung eines Gases, was mit einer Volumenzunahme einhergeht – entsprechend wird sie auch durch eine Drucksenkung gefördert.
Berechnung der maximal freisetzbaren Masse an Wasserstoff
Mit der gegebenen Dichte und dem Volumen lässt sich zunächst die Masse von Perhydro-DBT berechnen:
Erhöhung der Wasserstoff-Ausbeute durch Temperatur- und Druckänderung
Nach dem Prinzip von LE CHATELIER wird ein System, das sich im Gleichgewicht befindet, einem äußeren Zwang so entgegenwirken, dass das Gleichgewicht wiederhergestellt wird.
Bei der Dehydrierung von Perhydro-DBT wird Wasserstoff freigesetzt. Da es sich um eine endotherme Reaktion handelt, wird sie durch eine Temperaturerhöhung begünstigt. Zudem führt die Reaktion zur Bildung eines Gases, was mit einer Volumenzunahme einhergeht – entsprechend wird sie auch durch eine Drucksenkung gefördert.
Berechnung der maximal freisetzbaren Masse an Wasserstoff
Mit der gegebenen Dichte und dem Volumen lässt sich zunächst die Masse von Perhydro-DBT berechnen:
![\(\begin{array}[t]{rll}
m &=& \rho \cdot V & \\[5pt]
&=& 0,91\,\text{kg} \cdot \text{L}^{-1} \cdot 1000\,\text{L} & \\[5pt]
&=& 910\,\text{kg}
\end{array}\)](https://www.schullv.de/resources/formulas/9592897a3d6bb0586b1afb68eb479a53145401141368472bd80d78fce2df1351_light.svg) Nun kann mithilfe der molaren Masse die Stoffmenge berechnet werden:
Nun kann mithilfe der molaren Masse die Stoffmenge berechnet werden:
![\(\begin{array}[t]{rll}
n &=& \dfrac{m}{M} & \\[5pt]
&=& \dfrac{910\,\text{kg}}{290 \,\text{g} \cdot \text{mol}^{-1}} & \\[5pt]
&=& \dfrac{910\ 000 \,\text{g}}{290 \,\text{g} \cdot \text{mol}^{-1}} & \\[5pt]
&\approx& 3137,9\,\text{mol}
\end{array}\)](https://www.schullv.de/resources/formulas/812dc9c3884108b814868d466246eed3bdc317eb4c70c11c1d6a80abe2070e1c_light.svg) Weiterhin gilt:
Weiterhin gilt:
![\(\begin{array}[t]{rll}
n (H_2) &=& 9 \cdot n(\text{Perhydro−DBT}) & \\[5pt]
&=& 9 \cdot 3137,9\,\text{mol} & \\[5pt]
&\approx& 28241\,\text{mol}
\end{array}\)](https://www.schullv.de/resources/formulas/3e652c8090991ba207ae130e81de38fd4abba0cf584c7b9dc307c344014272e9_light.svg) Für die Masse ergibt sich:
Für die Masse ergibt sich:
![\(\begin{array}[t]{rll}
m (H_2) &=& n \cdot M & \\[5pt]
&=& 28241\,\text{mol} \cdot 2,0\,\text{g} \cdot \text{mol}^{-1} & \\[5pt]
&=& 56482 \,\text{g} = 56,482\,\text{kg}
\end{array}\)](https://www.schullv.de/resources/formulas/c6e43b253d791fe68dd33273f019260b7b70160478fa859d530c8103d5cda40b_light.svg)