A3 – Polyethylenterephthalat
Polyethylentherephthalat (PET) ist ein vielfältig einsetzbares Material, aus dem unter anderem Kunststoffflaschen hergestellt werden.
Formuliere die in Abbildung 2 schematisch dargestellten Reaktionen des PET-Abbaus als Strukturformelgleichungen. Beschreibe die Eigenschaften enzymatischer Katalyse. (M1, M2)
Beschreibe die Durchführung der Versuchsreihe, die zu den in Abbildung 3 dargestellten Ergebnissen führt. Leite aus Abbildung 3 grafisch das Enzym ab, das sich wegen seiner höheren Substrataffinität zum Abbau von PET besser eignet. (M2, M3)
Zeichne den in Abbildung 4 markierten Bereich des Verknüpfungspeptids als Strukturformelausschnitt. Vergleiche die Verknüpfung der Aminosäure-Bausteine mit dem in Abbildung 1 markierten Ausschnitt hinsichtlich des räumlichen Baus. (M1, M4)
Stelle die dem Experiment (Tab.) zugrundeliegende Hypothese auf. Erkläre die Bedeutung von Ansatz 1 im angegebenen Versuchsaufbau. Deute das Versuchsergebnis mit Hilfe der Stoßtheorie. (M4)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Material 1: PET- ein häufig verwendeter Kunststoff
Getränkeflaschen bestehen oft aus dem Kunststoff Polyethylenterephthalat (PET, Abb.1), der aus zwei verschiedenen Monomeren, Terephthalsäure und Ethandiol, synthetisiert wird.
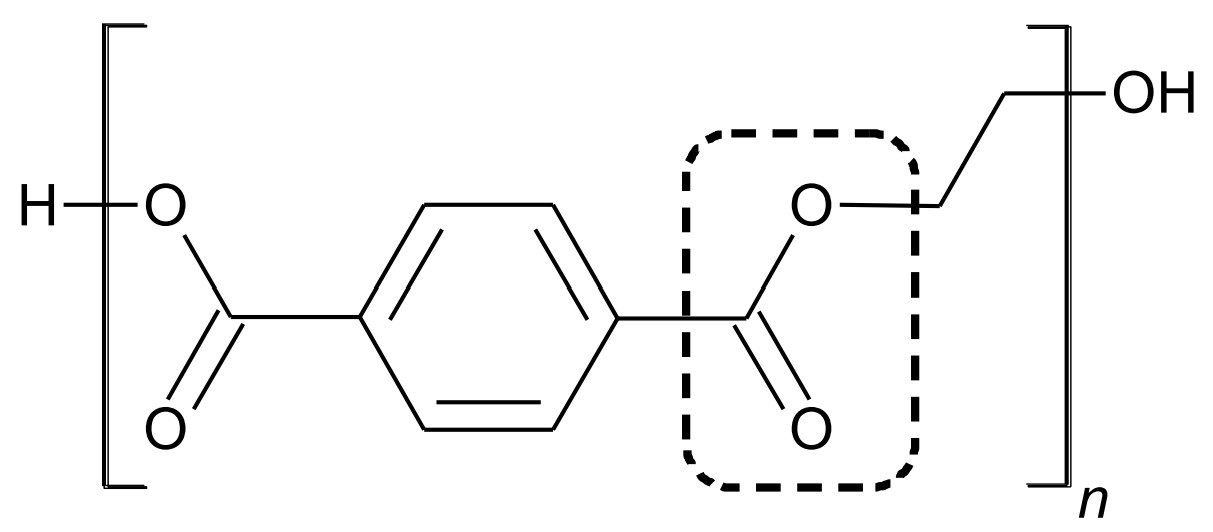
Abb. 1: Strukturformelausschnitt von PET
Trotz vieler Vorteile dieses Materials ist folgender Nachteil offenkundig: die langsame Abbaubarkeit und die damit einhergehende Anreicherung von Plastikmüll in der Umwelt. Derzeit wird intensiv nach Möglichkeiten gesucht, um den Abbau von PET zu beschleunigen.
Material 2: Abbau von PET durch Bakterien
2016 entdeckte man ein Bakterium (Ideonella sakaiensis), das PET mithilfe zweier Enzyme in seine Monomere abbauen kann und diese für den eigenen Stoffwechsel nutzt.
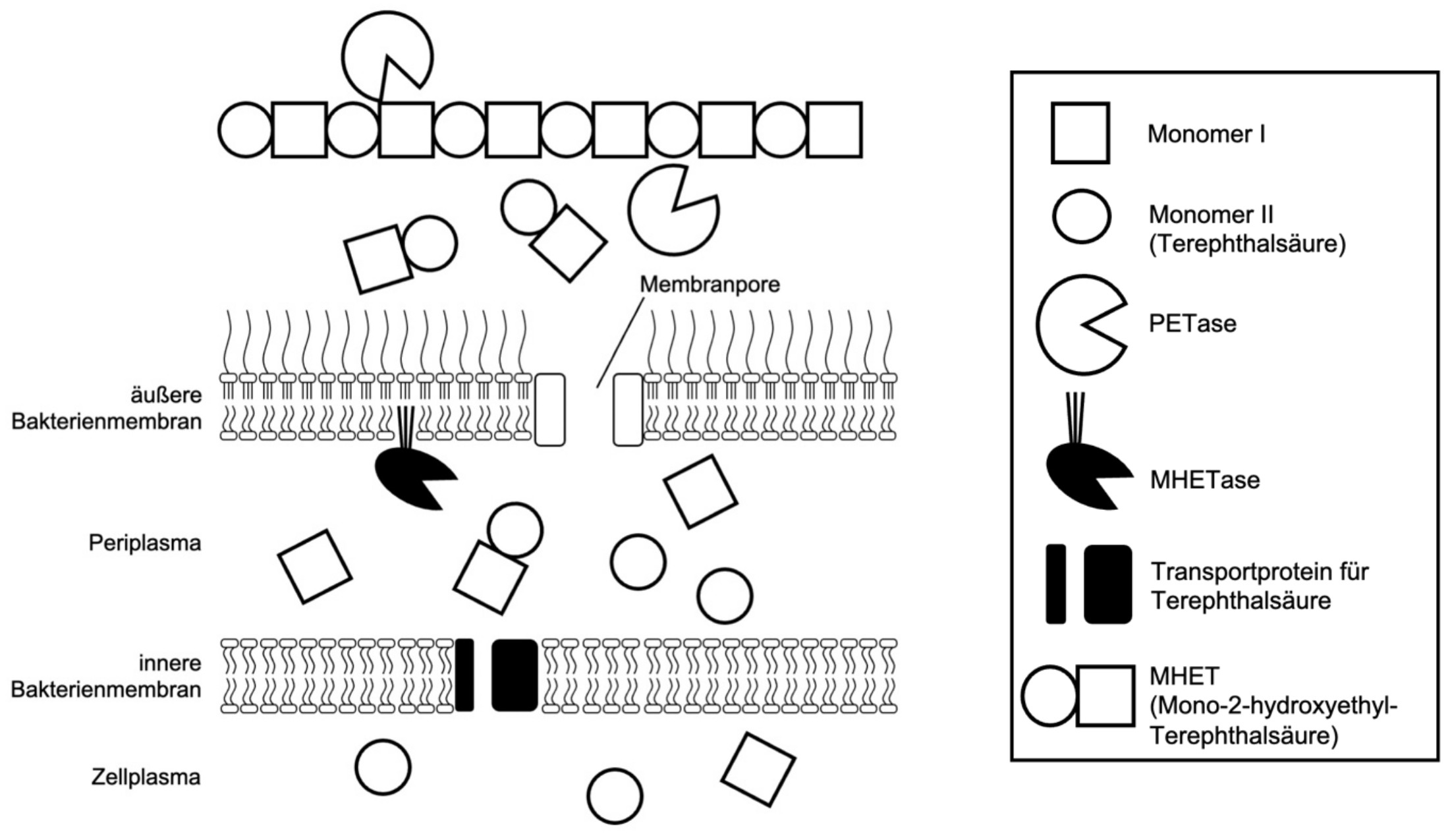
Abb. 2: schematische Darstellung des bakteriellen Abbaus von PET (ohne Berücksichtigung von Wasser-Molekülen)1
Material 3: Aktivität der MHETase
Um einen schnelleren Abbau von PET zu erreichen, versucht man auf verschiedenen Wegen, die Aktivität der beiden Enzyme zu erhöhen.
In einer Versuchsreihe wurde die Aktivität der MHETase aus Ideonella sakaiensis mit der einer durch künstliche Mutation entstandenen MHETase verglichen.
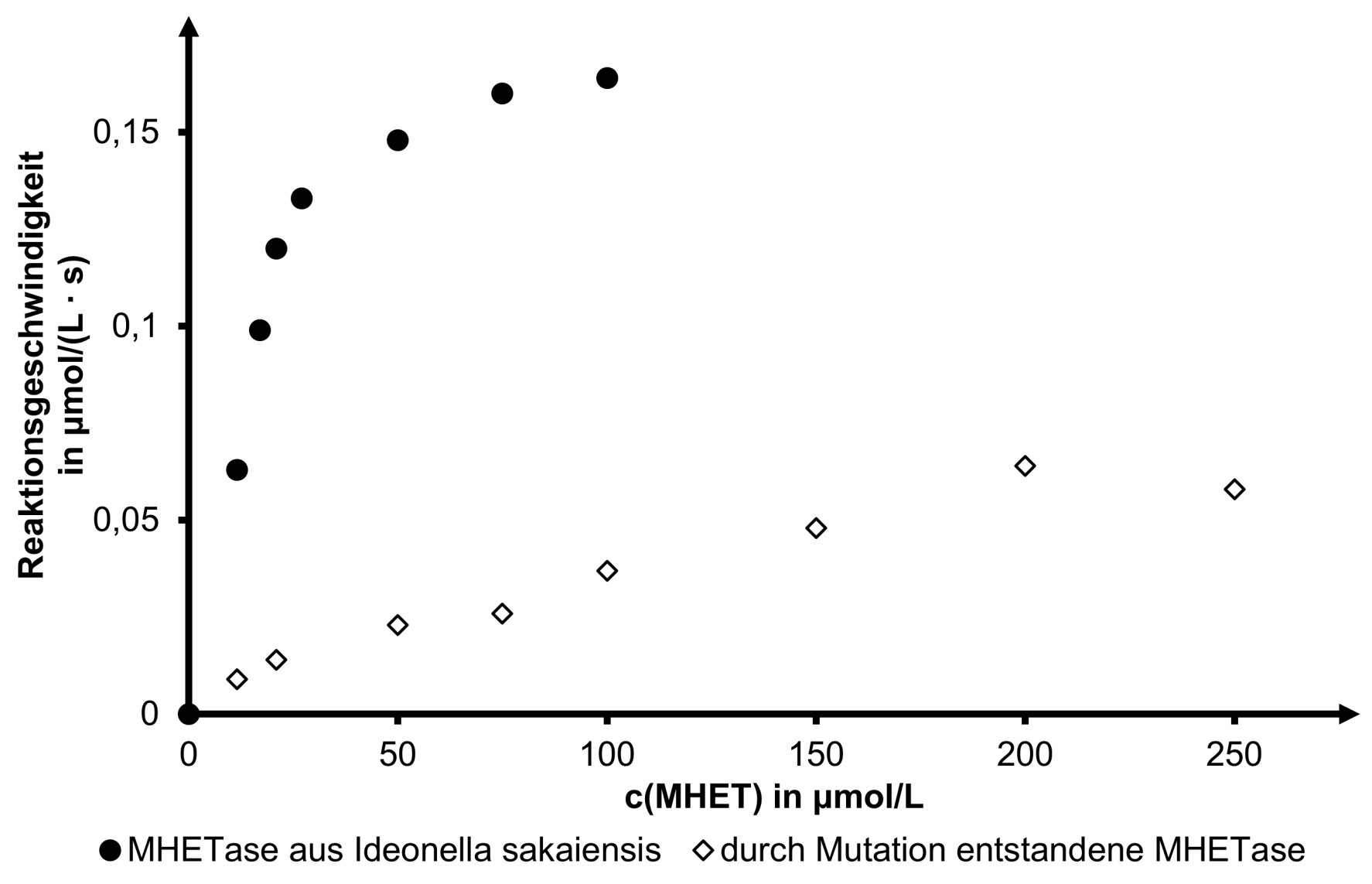
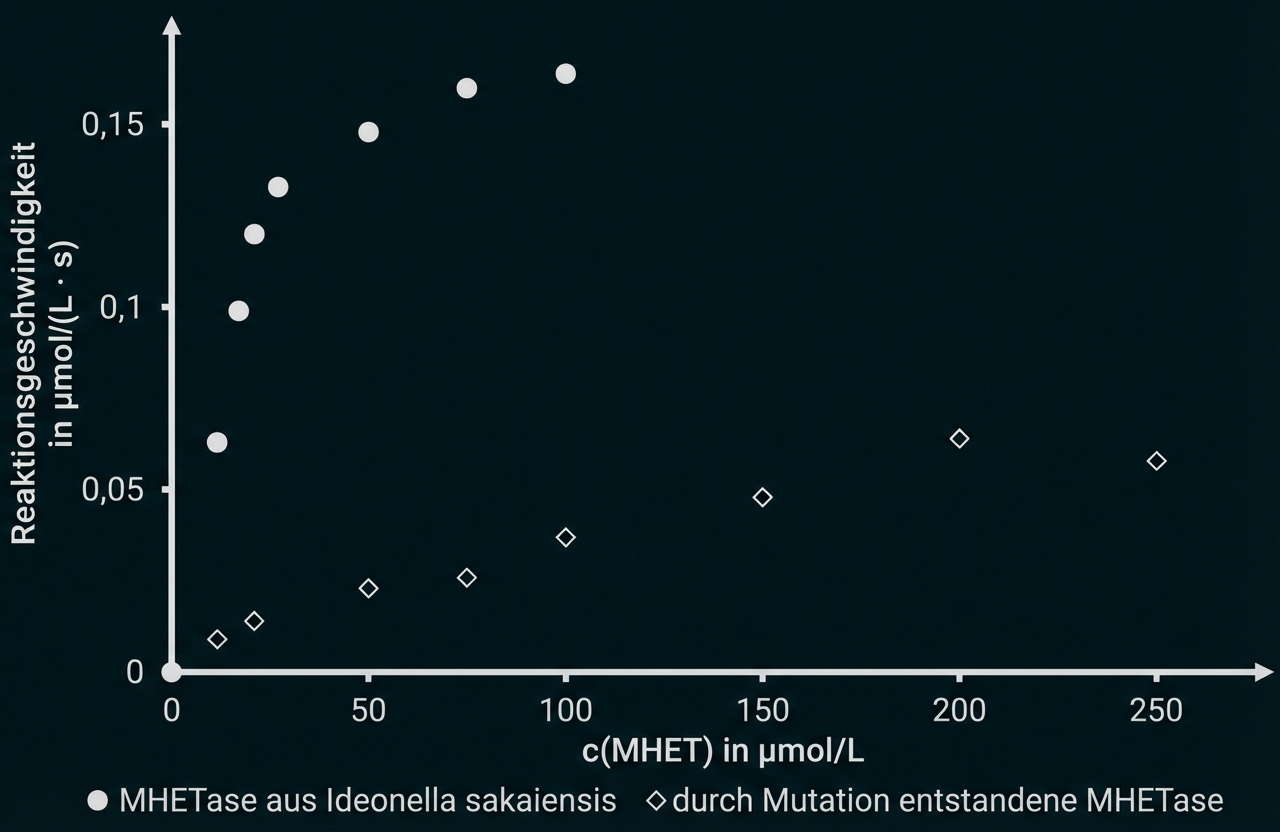
Abb. 3: Reaktionsgeschwindigkeit des MHET-Abbaus durch zwei MHETasen in Abhängigkeit von der MHET-Konzentration1
Material 4: Enzymdimere aus PETase und MHETase
Für eine andere Versuchsreihe wurden PETase und MHETase mithilfe eines Peptid-Moleküls aus den Aminosäure-Bausteinen Glycin und Serin (Abb. 4) verknüpft:
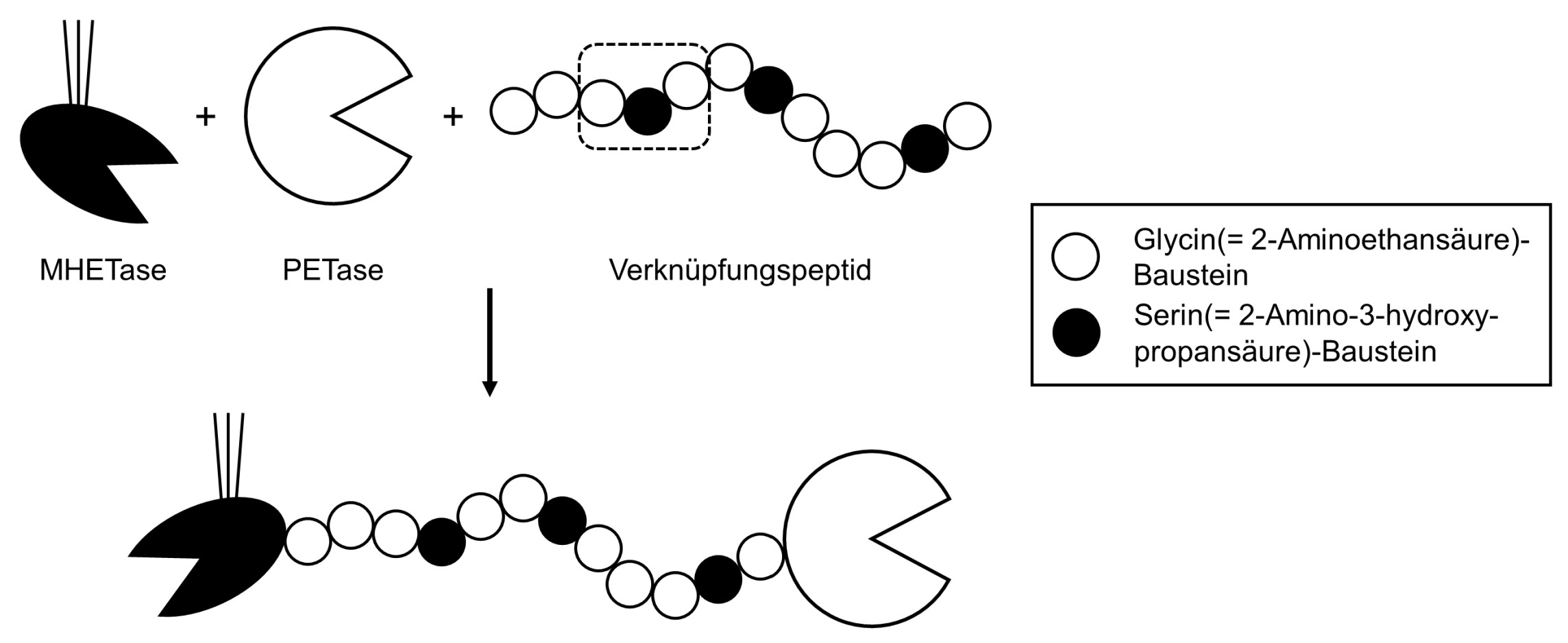
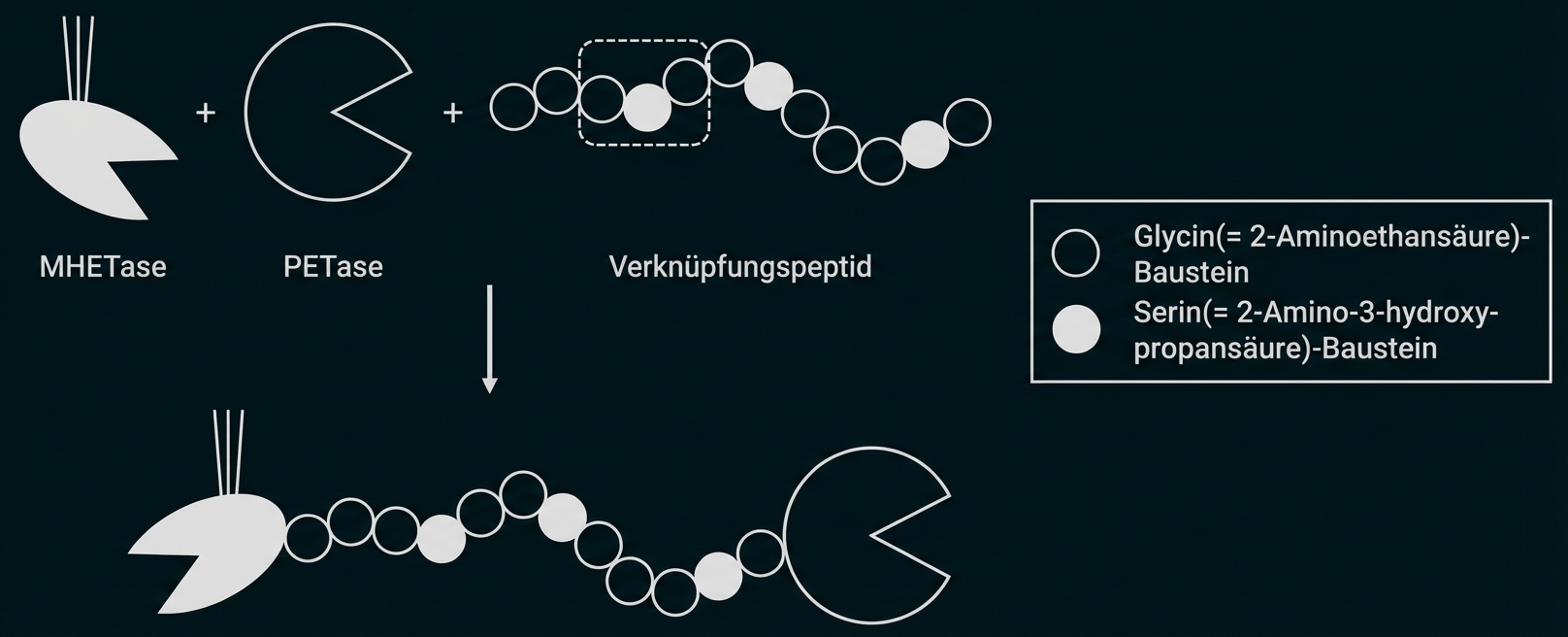
Abb. 4: Syntheseschema für das untersuchte Enzym-Dimer aus PETase und MHETase mit Verknüpfungspeptid1
Um die Aktivität dieses Enzym-Dimers mit der Aktivität nicht verbundener Enzyme zu vergleichen, wurde in einem Experiment die in der Tabelle angegebene Versuchsreihe durchgeführt. Es wurde jeweils nach einer bestimmten Zeit die Konzentration an entstandener Terephthalsäure gemessen. Die Ergebnisse sind in Abbildung 5 dargestellt.
Tab.: Versuchsreihe zur Untersuchung der Aktivität des PETase-MHETase-Dimers im Vergleich zur Aktivität nicht verbundener Enzyme2
|
Ansatz |
1 |
2 |
3 |
|
PET |
+ |
+ |
+ |
|
PETase |
+ |
||
|
MHETase |
+ |
||
|
PETase-MHETase-Dimer |
+ |
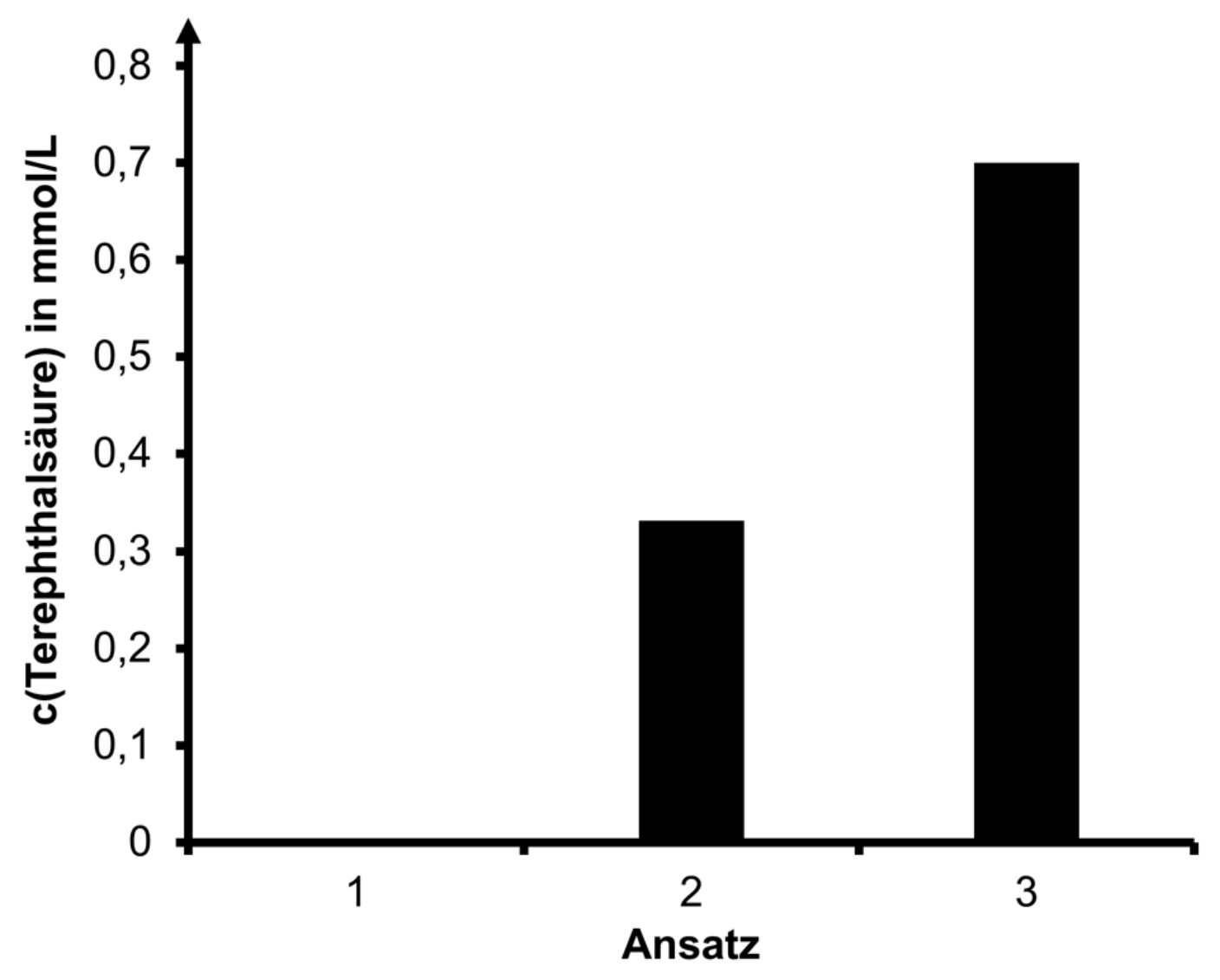
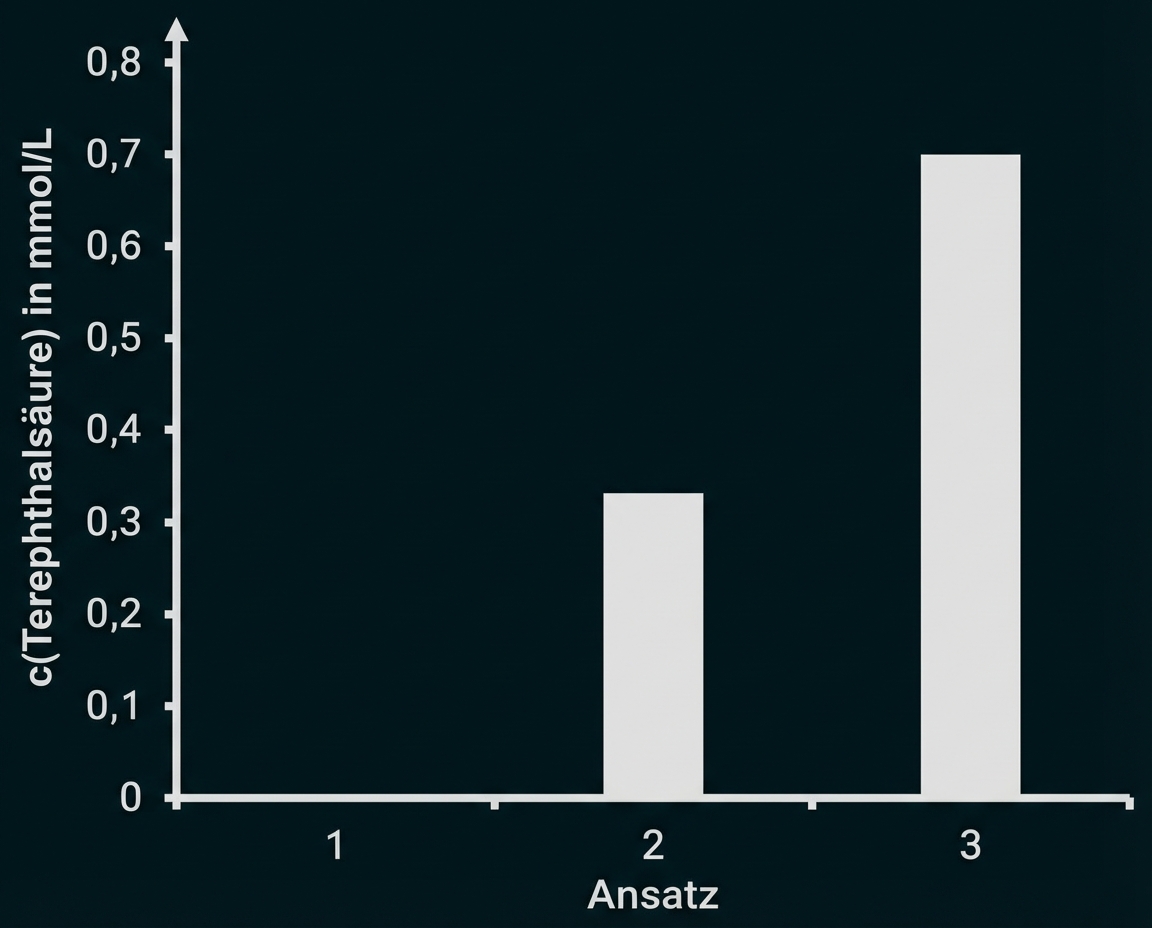
Abb. 5: Ergebnisse der in der Tabelle beschriebenen Versuchsreihe2
Quellen:
1 Knott, B. C., Erickson, E., Allen, M. D., Gado, J. E., Graham, R., Kearns, F. L., Pardo, I., Topuzlu, E., Anderson, J. J., Austin, H. P., Dominick, G., Johnson, C. W., Rorrer, N. A., Szostkiewicz, C. J., Copié, V., Payne, C. M., Woodcock, H. L., Donohoe, B. S., Beckham, G. T., & McGeehan, J. (2020). Characterization and engineering of a two-enzyme system for plastics depolymerization. Proceedings of the National Academy of Sciences of the United States of America, 117(41), 25476–25485. https://doi.org/10.1073/pnas.2006753117
2 Austin, H. P., Allen, M. D., Donohoe, B. S., Rorrer, N. A., Kearns, F. L., Silveira, R. L., Pollard, B. C., Dominick, G., Duman, R., Omari, K. E., Mykhaylyk, V., Wagner, A., Michener, W. E., Amore, A., Skaf, M. S., Crowley, M. F., Thorne, A. W., Johnson, C. W., Woodcock, H. L., . . . Beckham, G. T. (2018). Characterization and engineering of a plastic-degrading aromatic polyesterase. Proceedings of the National Academy of Sciences of the United States of America, 115(19). https://doi.org/10.1073/pnas.1718804115
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?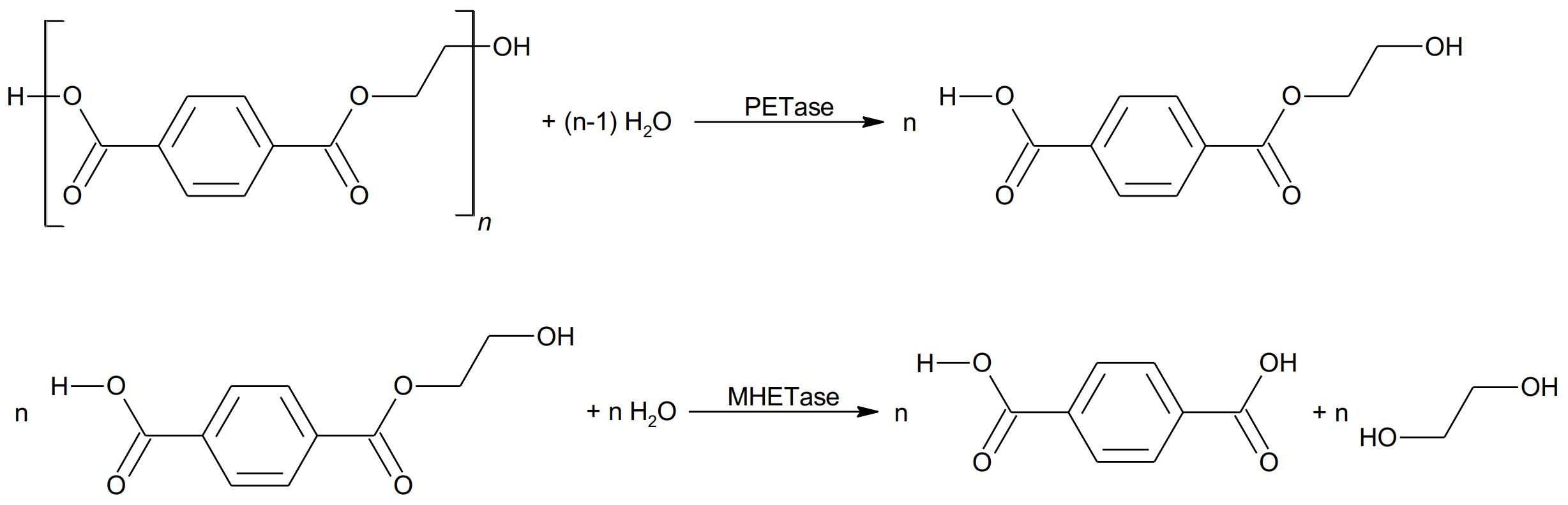
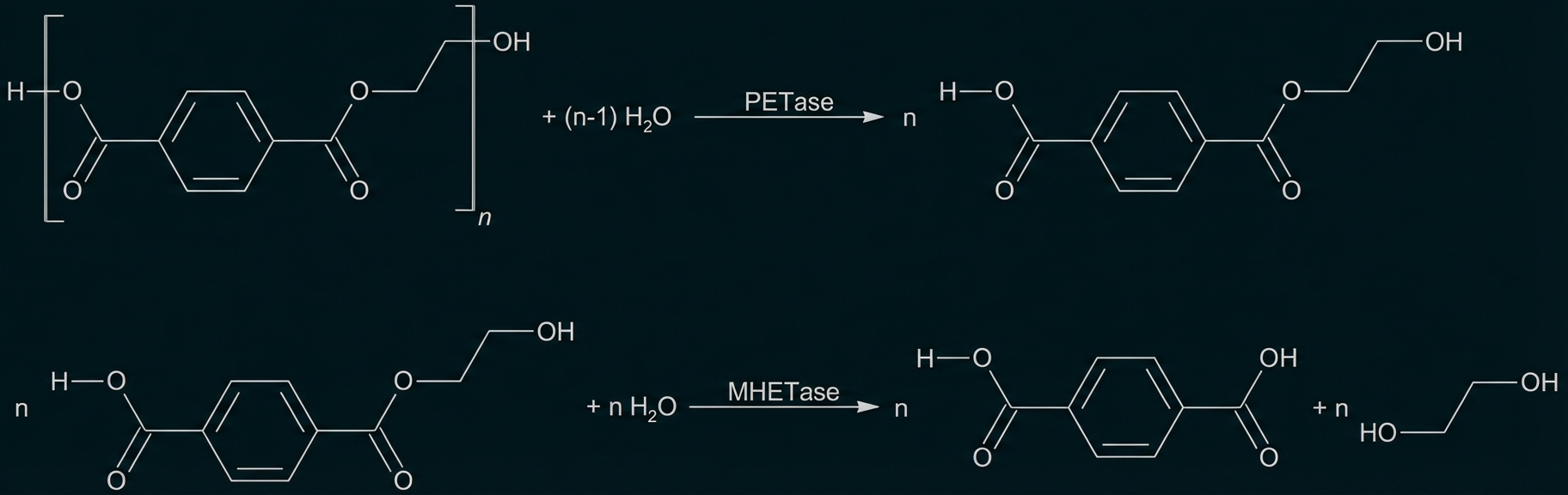
Enzyme beschleunigen den Reaktionsablauf durch Herabsetzen der Aktivierungsenergie und liegen nach der Katalyse unverändert vor.
Enzyme sind substrat- und wirkungsspezifisch.
Es wird je eine Versuchsreihe für MHETase und die durch Mutation entstandene MHETase durchgeführt. Dabei werden jeweils mehrere Ansätze mit steigenden MHET-Konzentrationen bei identischen Bedingungen und gleichen Enzymkonzentrationen hergestellt. Nach jeweils derselben Zeit wird z. B. eine Messung der Terephthalsäure-Konzentration durchgeführt.
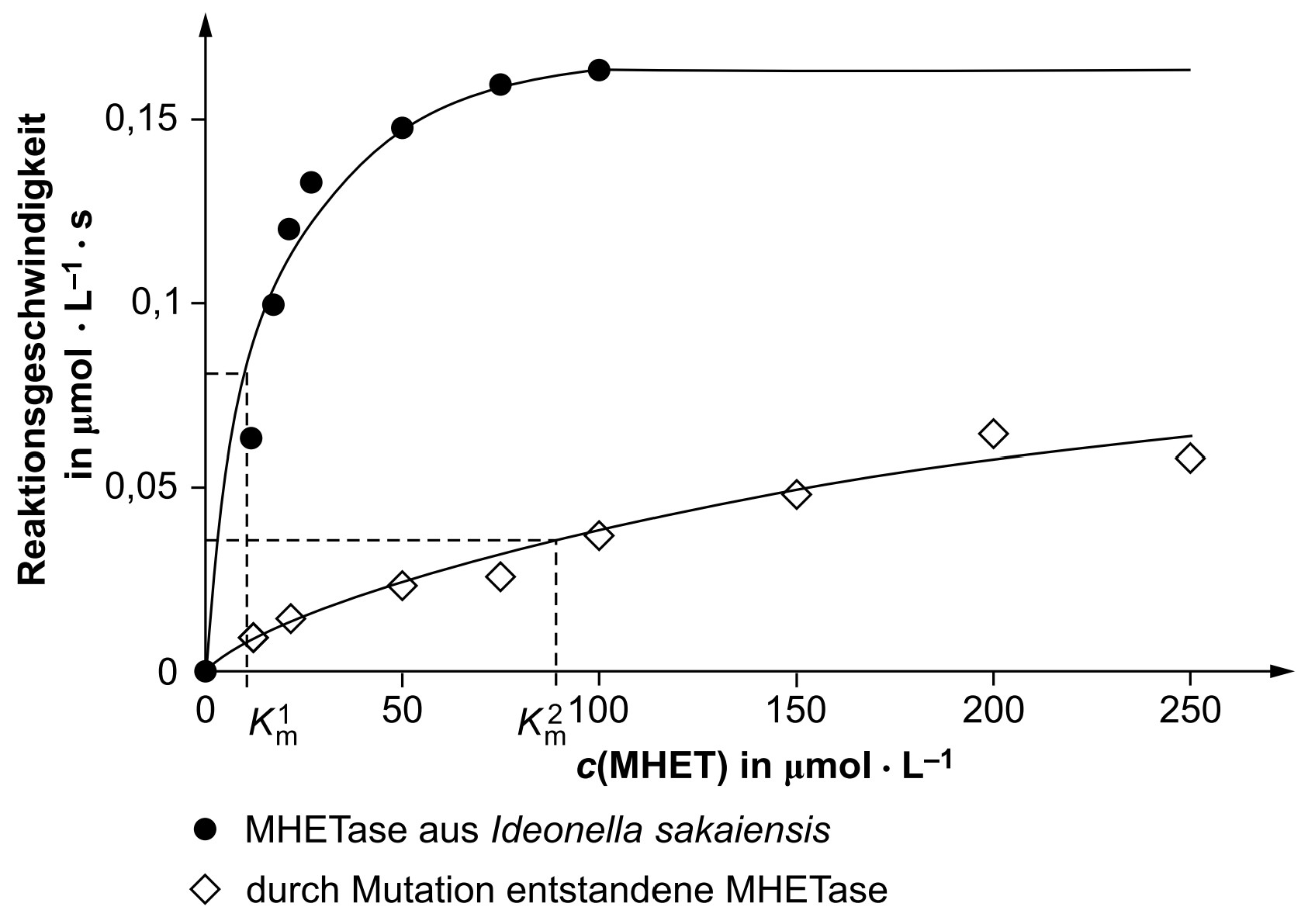
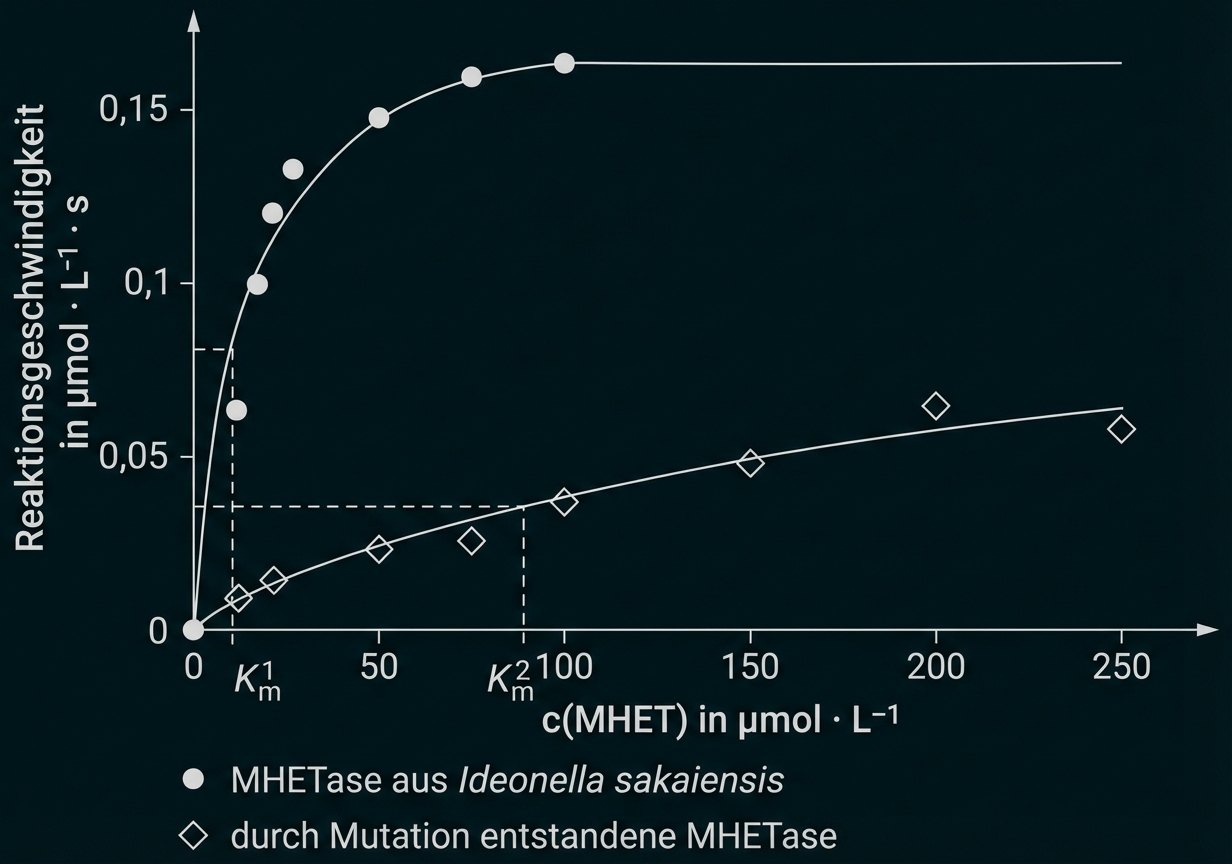
Durch Mutation entstandene MHETase ist weniger gut geeignet, da viel höherer -Wert
d. h. die Affinität zum Substrat ist viel geringer.
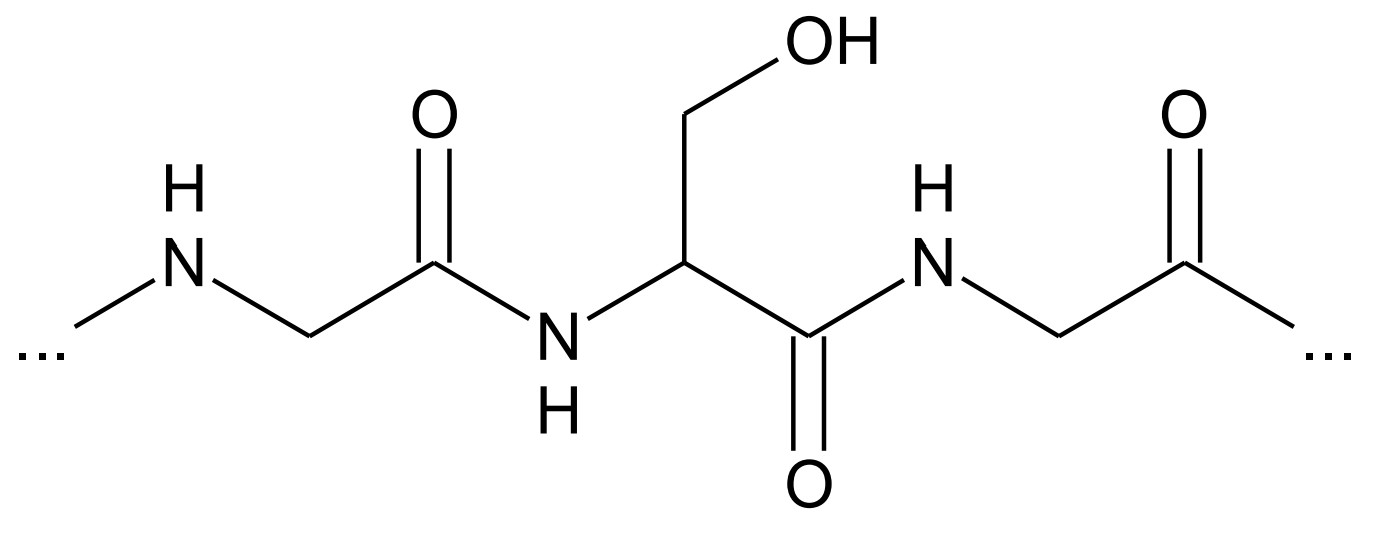
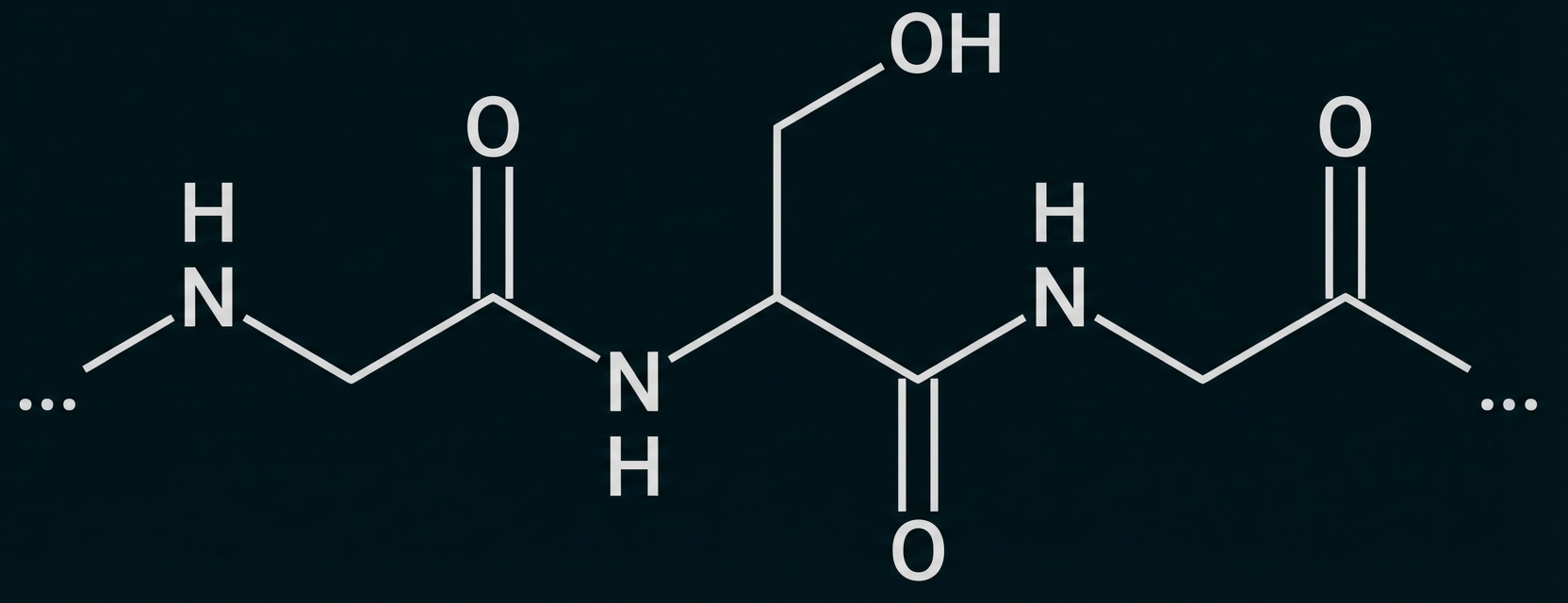
Die Aminosäure-Bausteine sind durch Peptidbindungen verknüpft. Im PET-Molekül handelt es sich hingegen um Esterbindungen.
Aufgrund der Mesomerie hat die C-N Bindung einen starken Doppelbindungscharakter. Die beteiligten Atome sind planar angeordnet, es besteht keine freie Drehbarkeit.
Die C-O-Bindung der Esterbindung hat hingegen Einfachbindungscharakter mit freier Drehbarkeit. Die Esterbindung ist dadurch nicht planar.
Hypothese: z. B.: Die durch die Verknüpfung räumlich benachbarten Enzyme spalten PET schneller zu den Endprodukten als frei vorliegende.
Ansatz 1 ist ein Kontrollansatz, um die spontane Hydrolyse von PET auszuschließen.
Enzym und Substrat können nur nach einem wirksamen Stoß einen Enzym-Substrat-Komplex bilden. Nur in diesem Fall kann das Substrat zu den Produkten umgesetzt werden. Ist die MHETase an die PETase gekoppelt, trifft das Produkt der ersten Reaktion mit höherer Wahrscheinlichkeit direkt auf die MHETase. Es erfolgt eine schnellere Umsetzung zu den Endprodukten (Ansatz 3).