A4 – Einflüsse von Kohlenwasserstoffen auf die Atmosphäre
Gewisse Kohlenwasserstoffe und von ihnen abgeleitete Verbindungen können Auswirkungen auf die Zusammensetzung der Atmosphäre haben.
Erkläre jeweils die Ergebnisse der Bromwasserprobe mit Isopren und Methan. Formuliere für die positive Nachweisreaktion den Reaktionsmechanismus unter Verwendung von Strukturformeln und Benennung der Reaktionsschritte. (M 1)
Berechne mithilfe der Reaktionsgleichungen jeweils die Standardreaktionsenthalpie der Verbrennungsreaktionen von Methan und Propan. Erkläre den Zusammenhang zwischen den berechneten Standardreaktionsenthalpien und den in Tab. 2 angegebenen Brennwerten. (M 2)
Stelle die Modellvorstellung in Abbildung 4 als Reaktionsgleichungen in Valenzstrichformelschreibweise dar. Vergleiche die beiden Darstellungsweisen hinsichtlich ihrer Aussagekraft bezüglich des räumlichen Baus der Teilchen. (M 3)
Interpretiere für den Zeitraum von 1980 bis 2020 das Diagramm zur Entwicklung der globalen Emission von Trichlorfluormethan unter Zuhilfenahme von M 3.
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Material 1: Kohlenwasserstoffe – von der Erde in die Atmosphäre
In der Atmosphäre reagiert eine Vielzahl von Stoffen mit Ozon. Zwei Kohlenwasserstoffe, die unter anderem durch natürliche Quellen freigesetzt werden, sind Isopren und Methan. In der Natur wird Isopren (2-Methylbuta-1,3-dien) von grünen Pflanzen abgegeben.
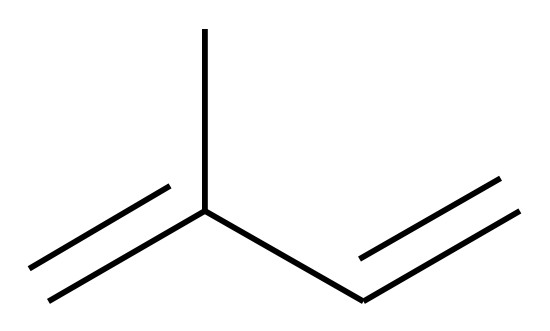
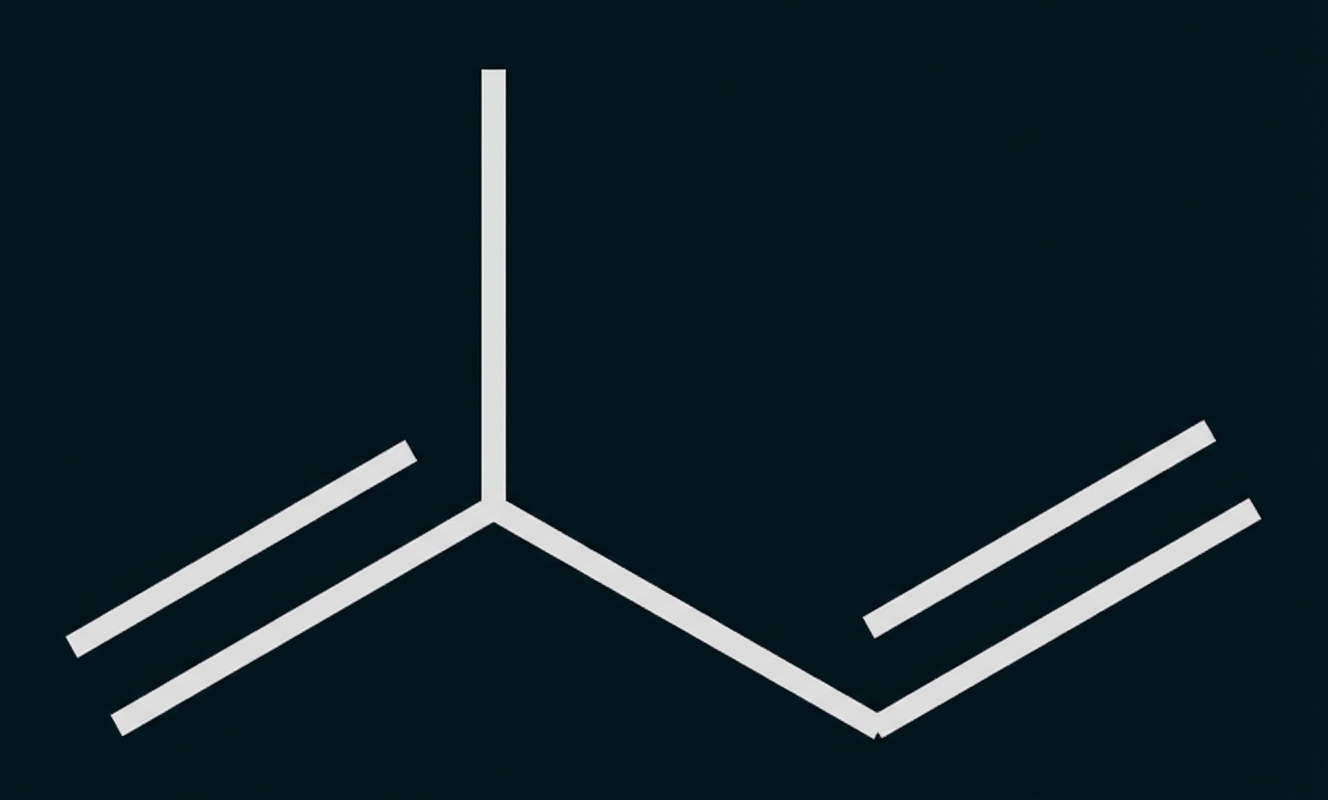
Abb. 1: Strukturformel von Isopren
Methan wird z. B. von Bakterien in den Mägen von Wiederkäuern produziert und von den Tieren in die Atmosphäre abgegeben.
Abb. 2: Freisetzung von Isopren und Methan in die Atmosphäre
Die beiden Gase können mithilfe der Bromwasserprobe untersucht werden.
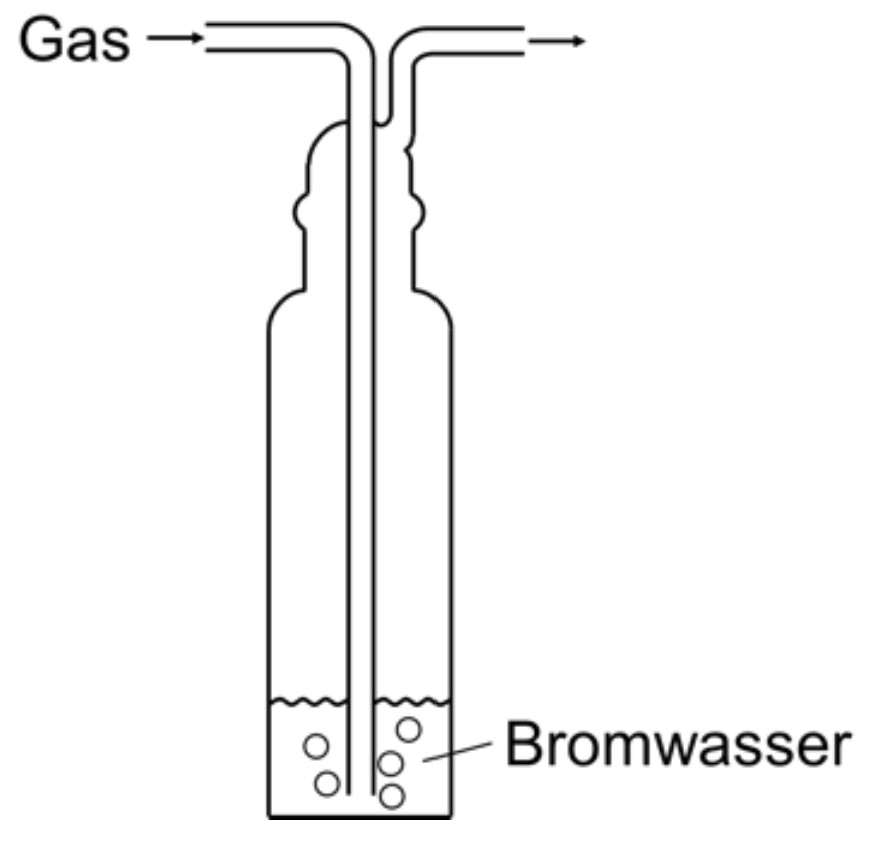
Abb. 3: Bromwasserprobe mit Gasen
Material 2: Heizen und Bewegen mit Kohlenwasserstoffen
Die Verbrennung von Kohlenwasserstoffen hat einen wesentlichen Einfluss auf die Atmosphäre. Erdgas, dessen Hauptbestandteil Methan ist (im Nordsee-Erdgas 89 %), wird u. a. zum Heizen von Wohnungen oder zum Antrieb von Pkw genutzt.
Anstelle von Erdgas wird vermehrt auch Flüssiggas für diese Anwendungen eingesetzt. Flüssiggas ist ein Gemisch aus unter hohem Druck verflüssigtem Propan (95 %), Butan (4 %) und weiterer Kohlenwasserstoffe (1 %).
Tab. 1: Standardbildungsenthalpien ausgewählter Verbindungen1
|
Verbindung |
molare Standardbildungsenthalpie |
|
Methan |
|
|
Wasser |
|
|
Propan |
|
|
Kohlenstoffdioxid |
|
Tab. 2: Brennwerte gasförmiger Brennstoffe bei einer Temperatur von 25 °C1
|
Brennstoff |
Brennwert in MJ/kg |
|
Methan |
|
|
Propan |
|
Material 3: Trichlorfluormethan – ein CFKW
Neben Methan sind Chlorfluorkohlenwasserstoffe (CFKW) für den Abbau der Ozonschicht verantwortlich. Ein Vertreter dieser Gruppe ist Trichlorfluormethan, das früher als Kältemittel in Kühlschränken sowie als Treibgas für Spraydosen verwendet wurde. Freigesetztes Trichlorfluormethan verbleibt Jahrzehnte in der Atmosphäre und kann dort seine chemische Wirkung auf die Ozonschicht entfalten. Dieser Effekt wurde bereits in den 1980er Jahren erkannt. In Abbildung 4 ist eine Modelldarstellung dieser Reaktion gezeigt. Für einige der beteiligten Moleküle ist die Valenzstrichformel angegeben.
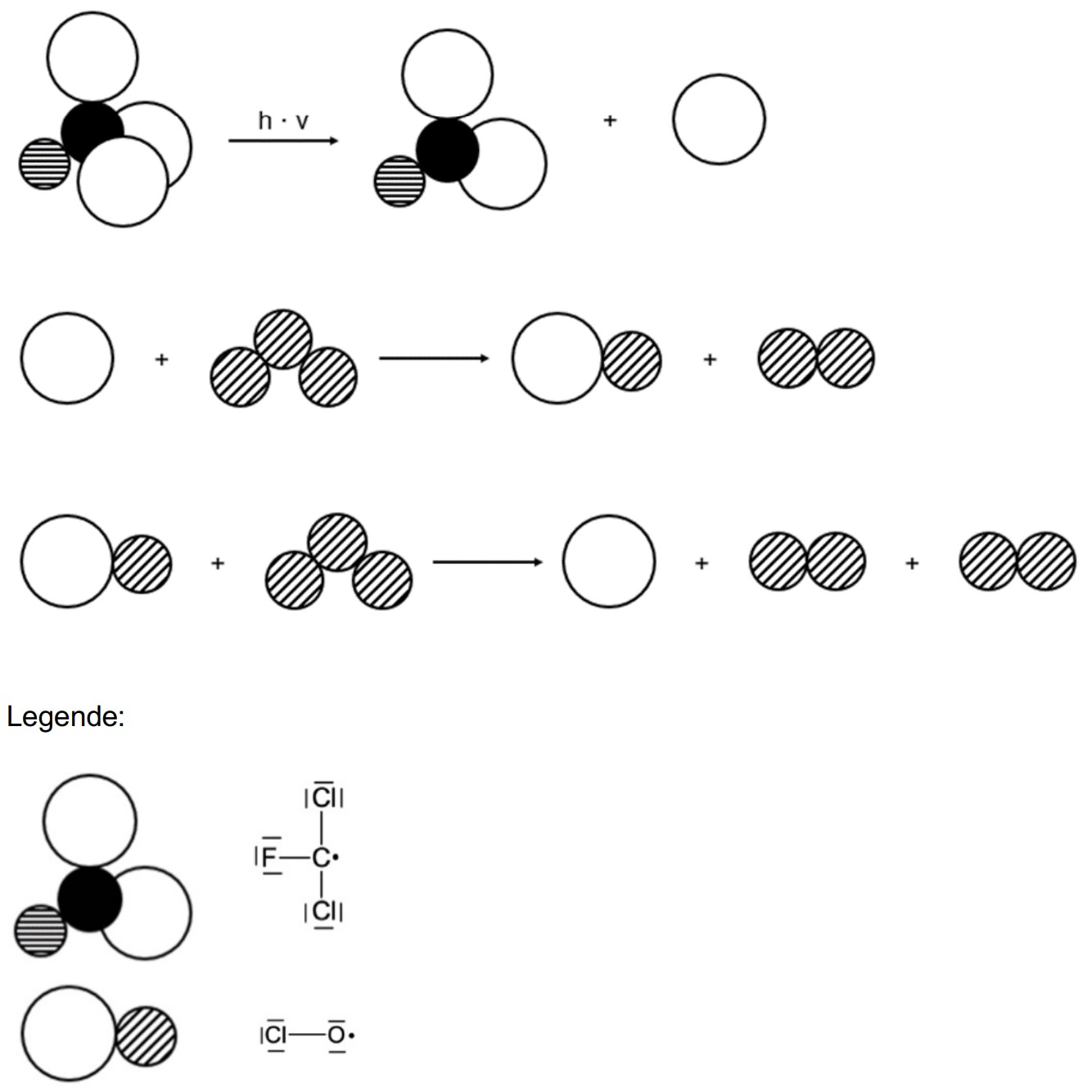
Abb. 4: Mechanismus zum Abbau von Ozon-Molekülen durch Trichlorfluormethan-Moleküle in einer Modellvorstellung2
Die Ozonschicht schwächt die für Organismen schädliche UV-Strahlung aus dem Weltall um ein Vielfaches ab. 1987 wurden im sogenannten Protokoll von Montreal internationale Vereinbarungen zum Schutz der Ozonschicht getroffen. Dabei verpflichteten sich die unterzeichnenden Staaten u. a. den Einsatz von Trichlorfluormethan zu verbieten. Bis 2009 wurde das Protokoll von 197 Staaten unterzeichnet. Seit dem Jahr 1991 wurde in der Bundesrepublik Deutschland die Verwendung von Trichlorfluormethan rechtlich stark eingeschränkt und der Stoff nach Möglichkeit ersetzt. Seit 2009 ist die Herstellung und Verwendung des Stoffes in allen 197 Unterzeichnerstaaten verboten.
In Abbildung 5 sind die weltweit jährlich gemessene Freisetzung von Trichlorfluormethan sowie eine Prognose der Emissionen bei Einhaltung des Montreal-Protokolls dargestellt.
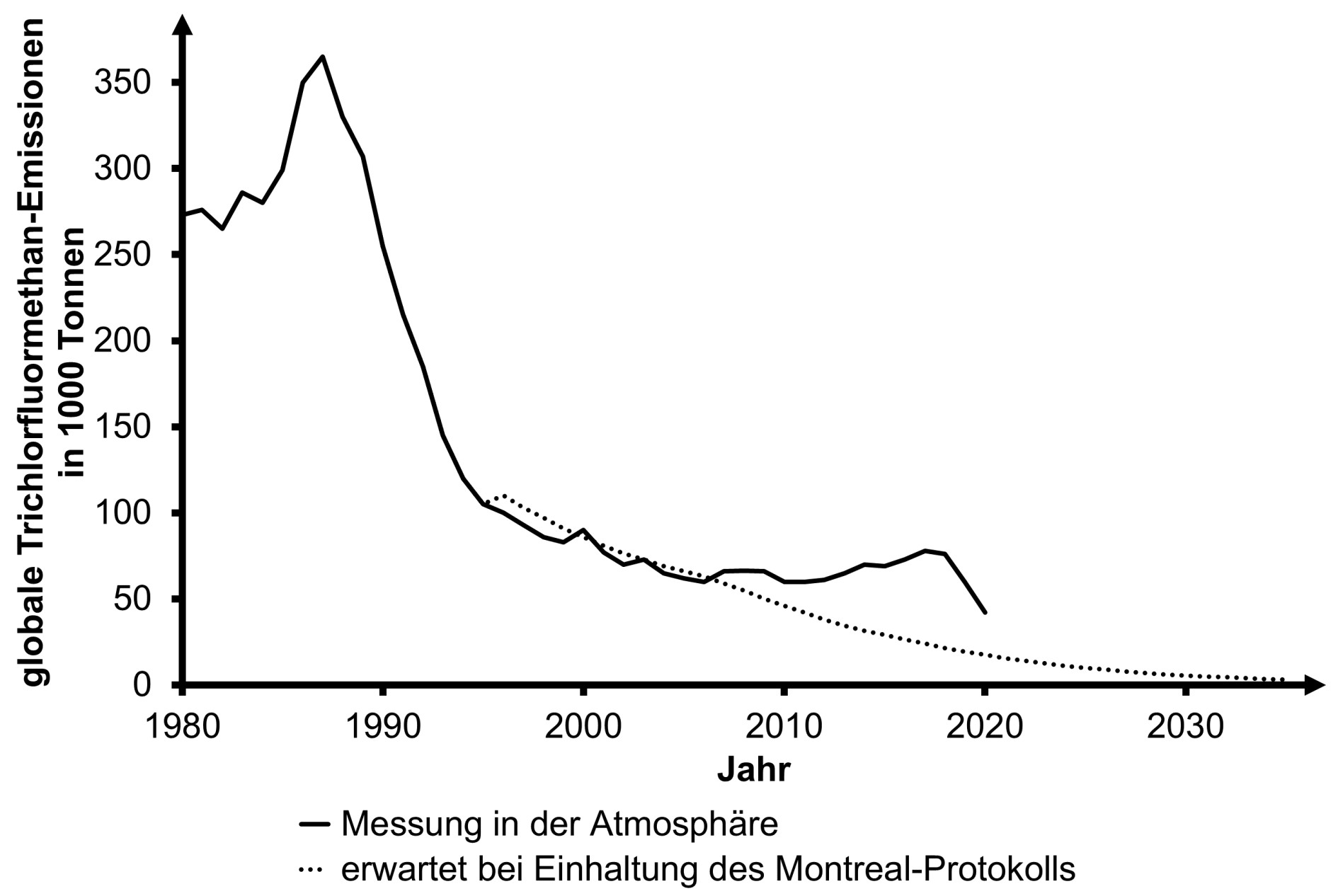
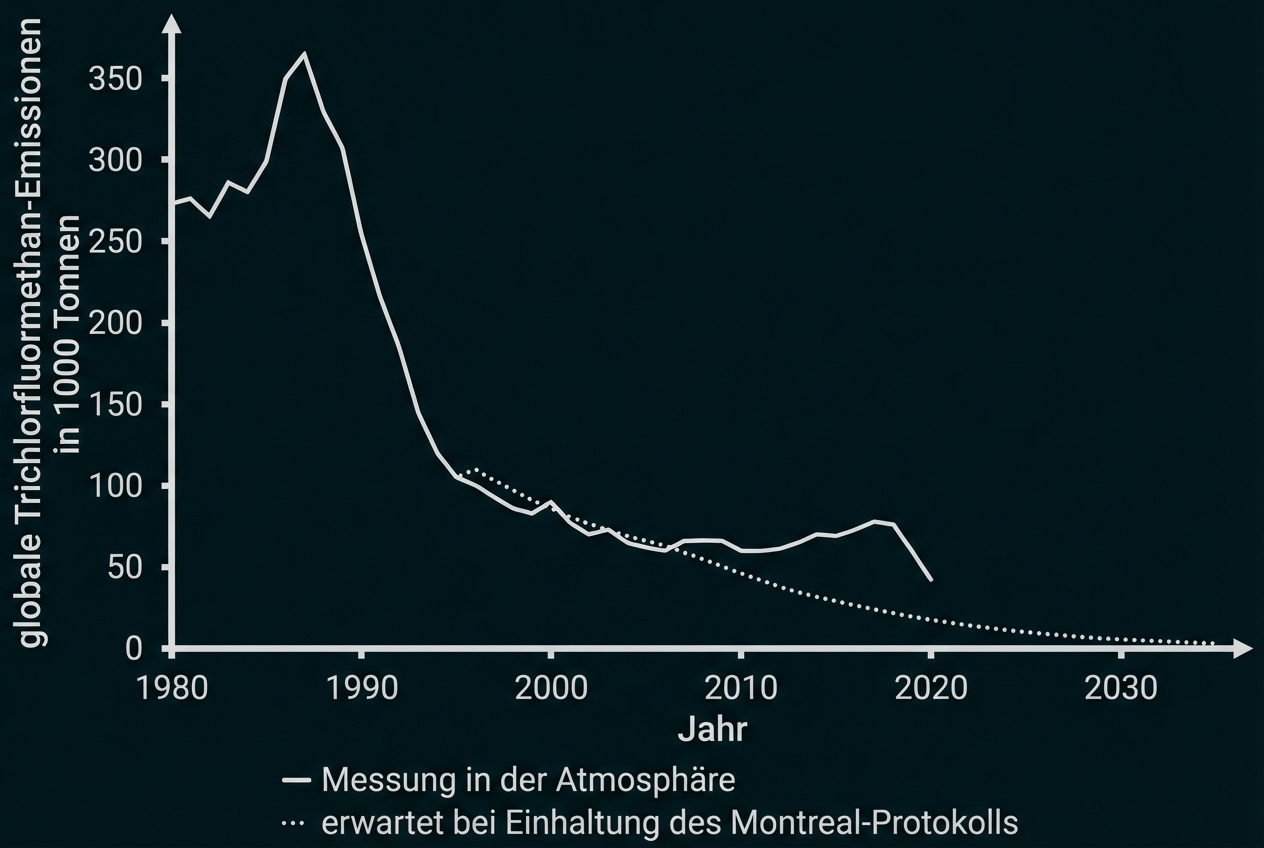
Abb. 6: Zeitliche Entwicklung der globalen Emission von Trichlorfluormethan (gemessen in der Atmosphäre)
Quellen:
1 Wikipedia-Autoren. (2003). Heizwert. de.wikipedia.org. https://de.wikipedia.org/wiki/Heizwert
2 verändert nach: https://www.chemgeo.uni-jena.de/chegemedia/praktikum/ozonabbau.pdf
3 Gerbing, C. (2021b, February 11). Global CFC emissions now declining again as expected under the Montreal Protocol - Atmospheric Composition & Chemistry. Atmospheric Composition & Chemistry. https://research.csiro.au/acc/global-cfc-emissions-now-declining-again/
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Beobachtung: Entfärbung des Bromwassers bei Einleiten von Isopren, keine Veränderung bei Methan; im Isopren-Molekül sind C=C-Doppelbindungen vorhanden, an die Brom-Moleküle addiert werden. Die Reaktion sorgt für eine Abnahme der Bromkonzentration und führt damit zur Entfärbung.
Mechanismus am Beispiel einer C=C-Doppelbindung:
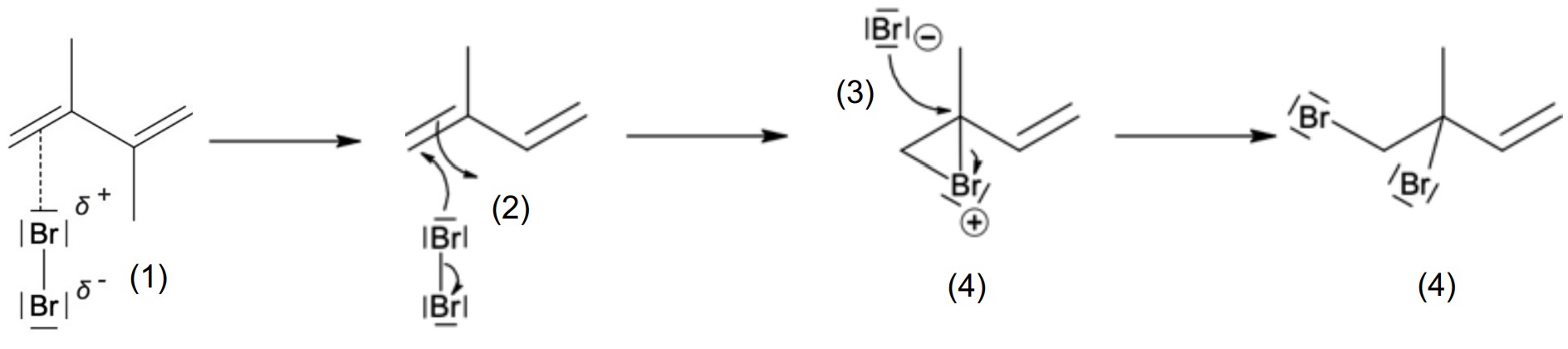
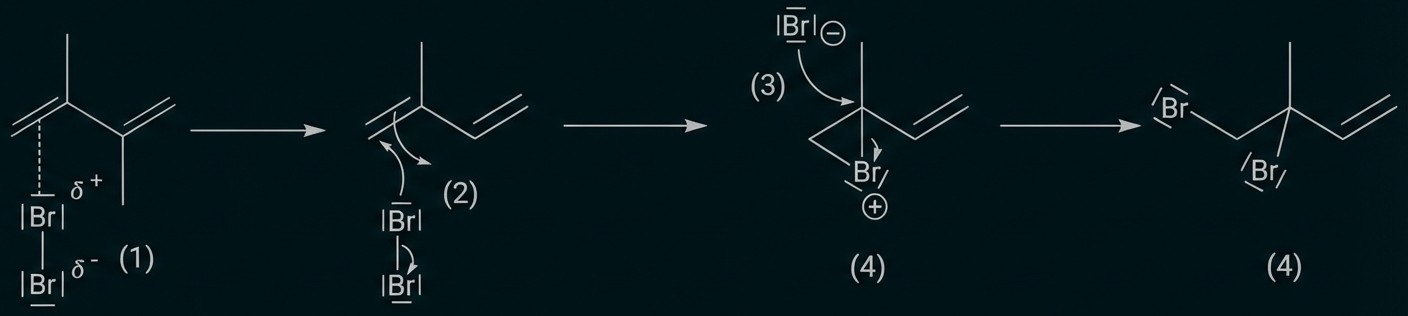
Reaktionsgleichung für Methan:
Reaktionsgleichung für Propan:
Anwendung des Satzes von Hess
Berechnung der Werte:
Die molare Masse von Methan ist kleiner als die von Propan. Demnach ist bei gleicher Masse die Stoffmenge von Methan größer als die von Propan, womit der Brennwert pro Masse bei Methan größer ist.
Reaktionsgleichungen:
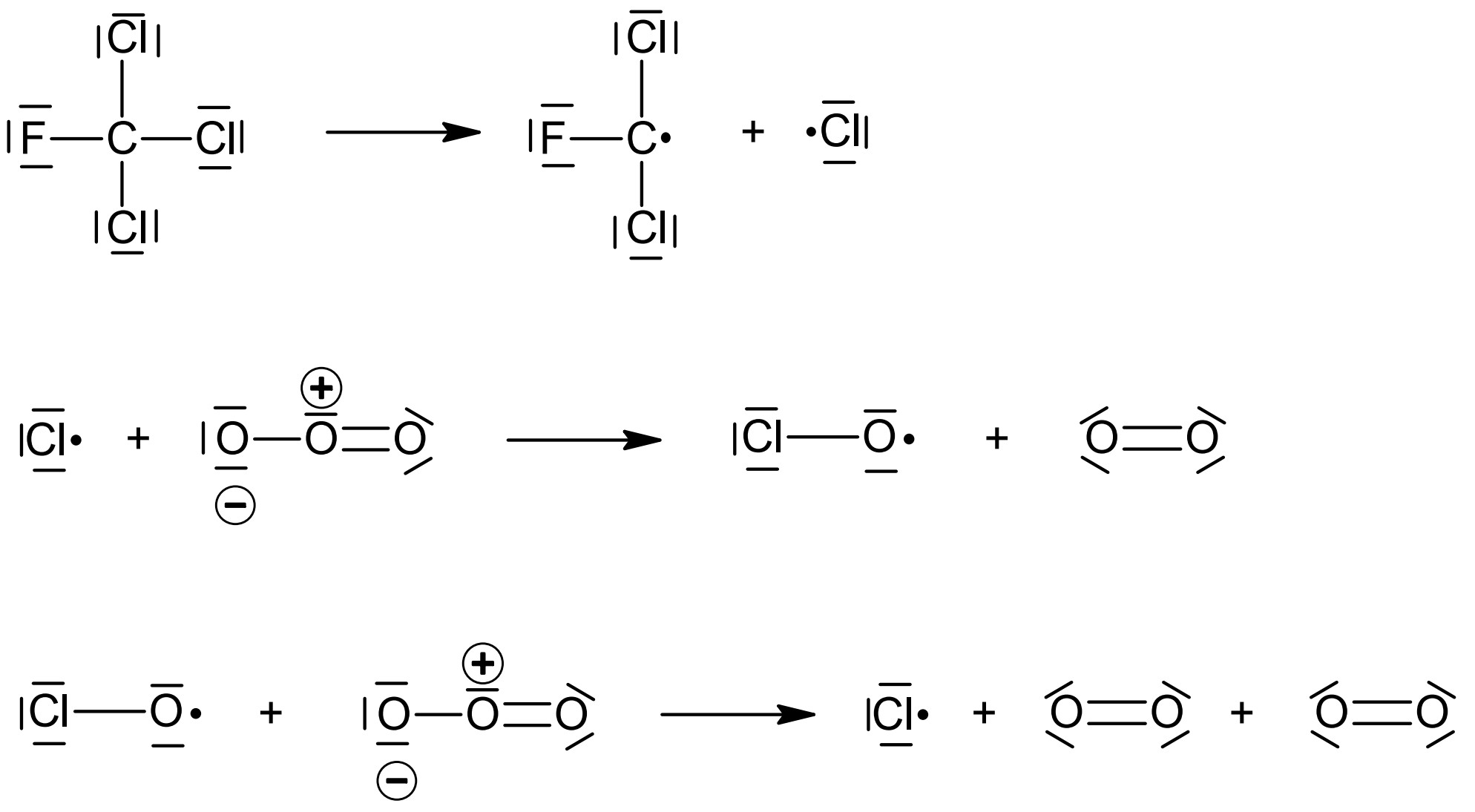
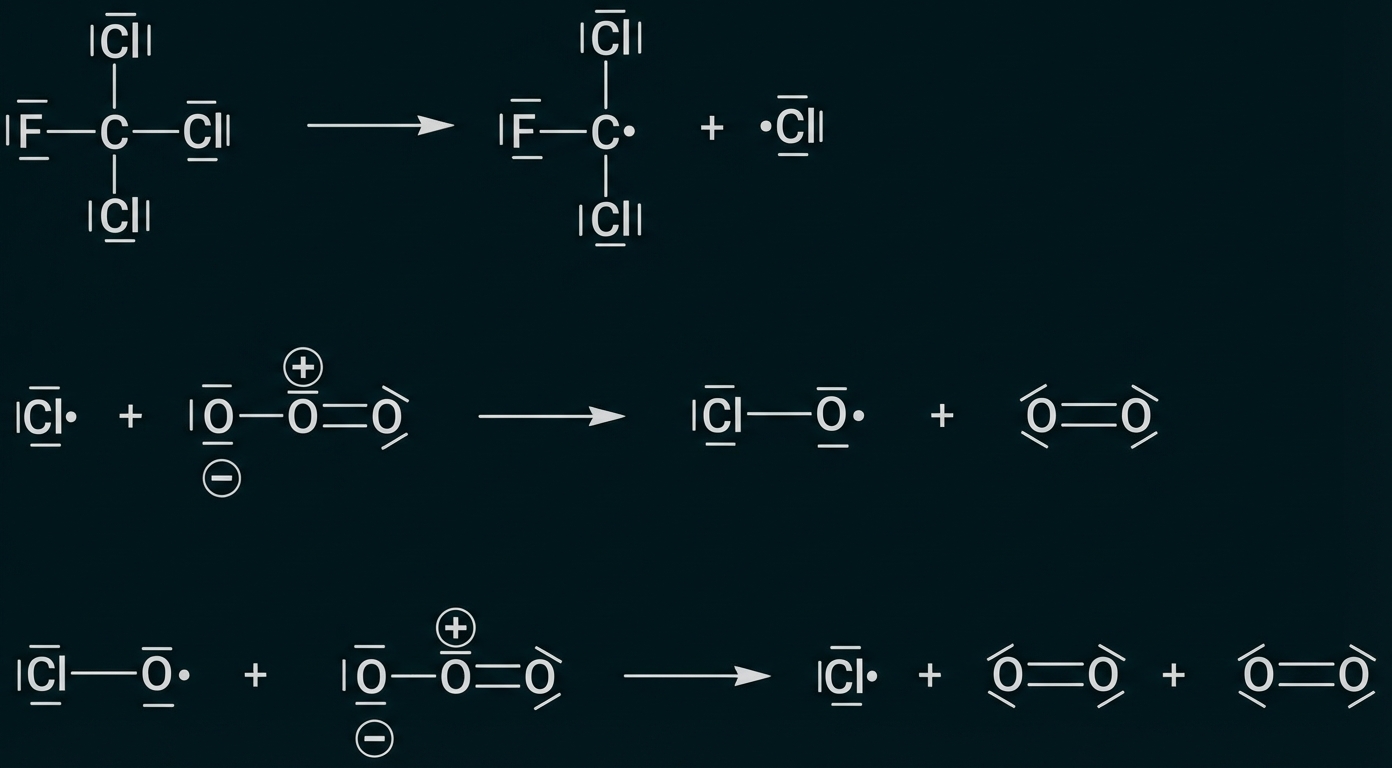
Modellvorstellung: Atomradien sowie Bindungswinkel ableitbar
Valenzstrichformel: keine Aussage über räumlichen Bau
Ca. von 1980 bis 1988: Anstieg der Emissionen von Trichlorfluormethan, da es weltweit ohne Verbot genutzt wurde.
Von 1987 bis 2007 kontinuierliches Absinken der Emissionen, da immer mehr Länder dem Montreal-Protokoll nachkamen und Herstellung und Nutzung des Stoffes verboten, z. B. Bundesrepublik Deutschland seit 1991.
Von 2007 bis 2018 stiegen die Emissionen trotz nahezu flächendeckendem Verbot seit 2009 wieder an. Hypothese z. B.: Illegale Produktion und Nutzung von Trichlorfluormethan.
Von 2018 bis 2020 sanken die Emissionen wieder. Hypothese z. B.: nachhaltigeres Durchsetzen des Verbots.