Vorschlag B: Fischbestand in Oder und Ostsee
Einfluss des Menschen auf den Fischbestand in Oder und Ostsee
Die Oder ist ein mehr als 850 km langer mitteleuropäischer Fluss, der in Tschechien entspringt und schließlich in die Ostsee mündet. Im August 2022 verendete dort plötzlich die Hälfte des Fischbestandes. Die Ursachen für diese Katastrophe konnten inzwischen aufgeklärt werden. In der Ostsee führen übermäßige Fischerei und weitere Einflüsse zum starken Rückgang des Dorschbestandes. Mittels genetischer Methoden kann man Lebensmittel darauf untersuchen, ob sie aus Dorsch oder anderen Speisefischen hergestellt wurden.Ökologische Aspekte des Fischsterbens
Beschreibe den Kohlenstoffkreislauf in einer Biozönose.
Erkläre die in Abbildung 1.1 dargestellten Schwankungen des Sauerstoffgehaltes in der Oder im Tagesverlauf. (Material 1)
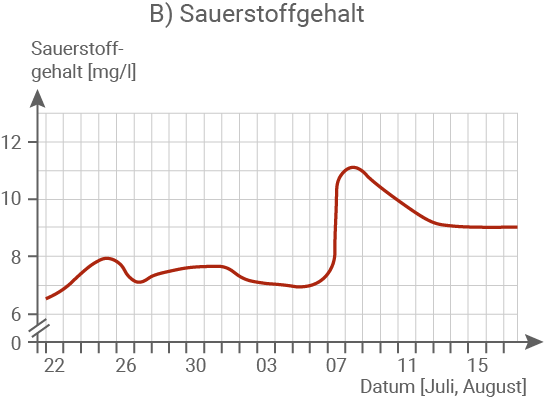
Zeige mithilfe der Abbildung 1.2 B, dass das Fischsterben nicht durch einen Mangel an Sauerstoff im Flusswasser verursacht worden sein kann. (Material 1)
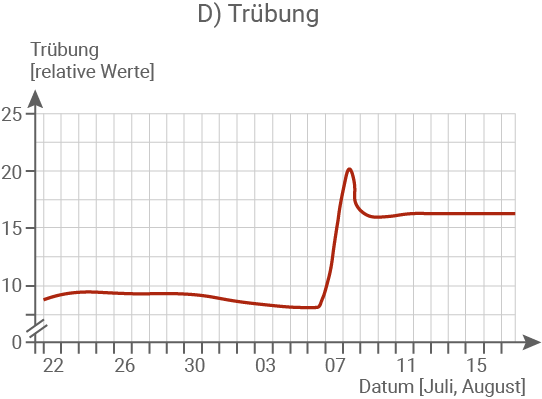
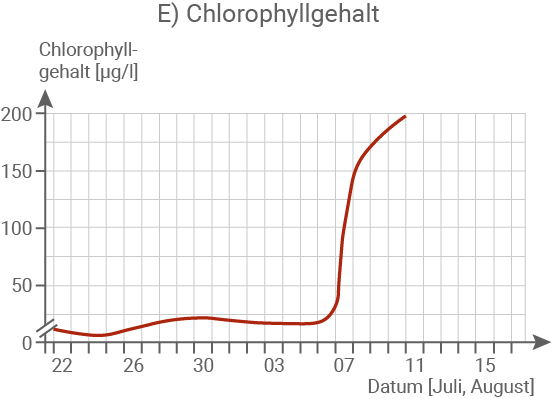
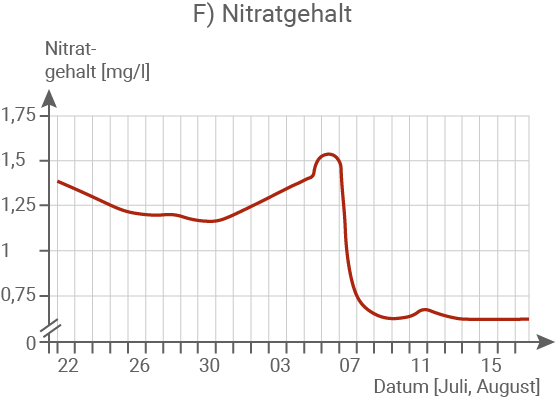
Fasse die Messergebnisse in Abbildung 1.2 ab dem 6. August zusammen. (Material 1)
Erkläre die Messergebnisse in Abbildung 1.2 ab dem 6. August im Zusammenhang und begründe das Massensterben der Fische. (Material 1, 2 und 3)
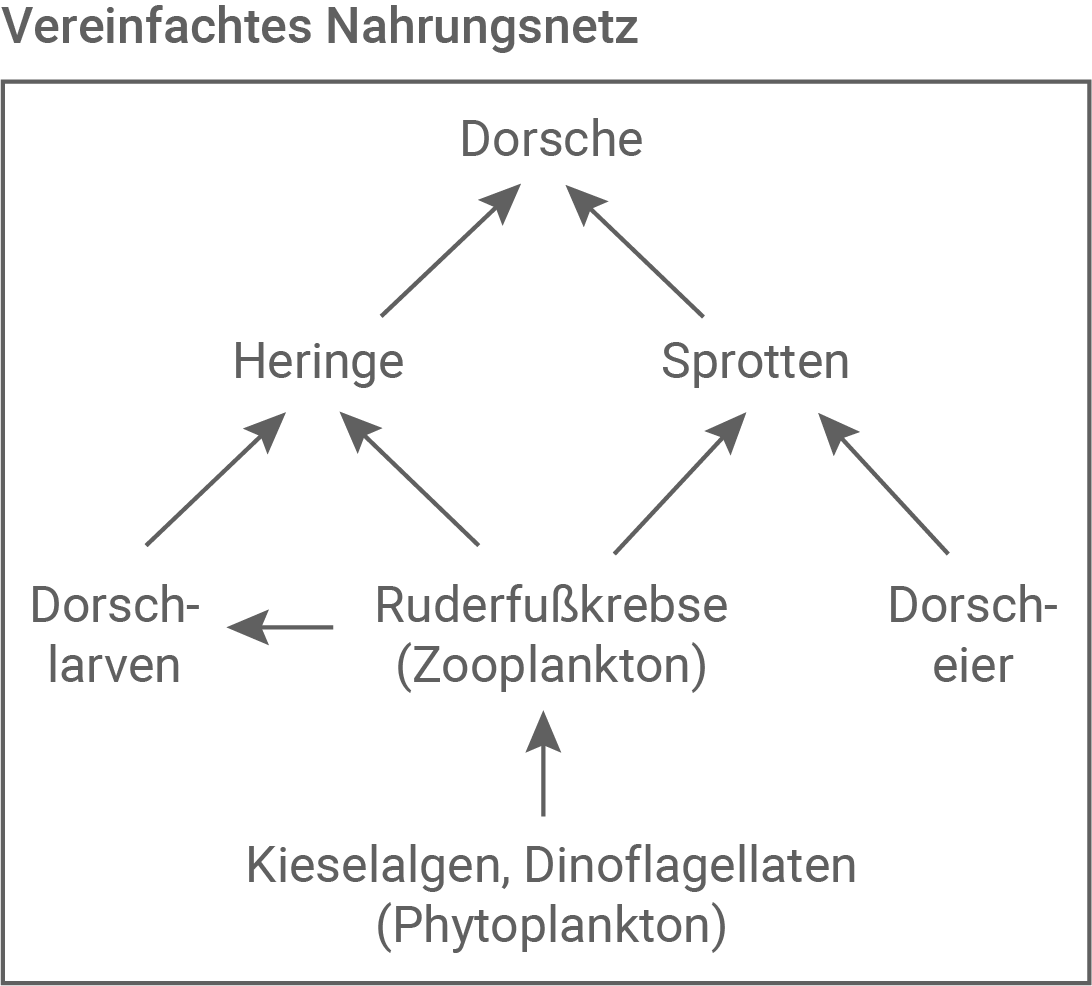
Begründe mithilfe des Nahrungsnetzes den übermäßig starken Rückgang des Dorschbestandes. (Material 4)
Beschreibe und erläutere den im eingerahmten Teil der Abbildung 5.1 dargestellten Energiefluss in der Ostsee.
Erkläre, auf welche Weise die Blaualgenblüte dazu beiträgt, dass sich der Dorschbestand in der Ostsee nicht erholt. (Material 5)
Genetik
Beschreibe und erläutere die RPA-Methode und vergleiche die Methode dabei schrittweise mit der Polymerasekettenreaktion (PCR). (Material 6)
Erkläre die Ergebnisse in den Spuren 2 bis 5 der Gelelektrophorese. Werte die Ergebnisse in den Spuren 6 bis 9 aus. (Material 6 und 7)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Material 1
Umweltkatastrophe in der Oder 2022
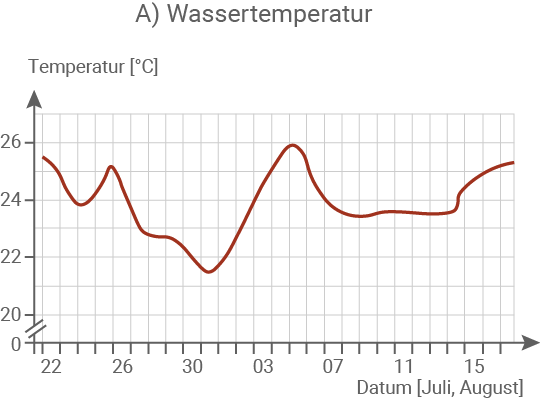
Die Oder entspringt in Tschechien, fließt größtenteils durch Polen und bildet einen Teil der deutschpolnischen Grenze. Schließlich mündet sie in die Ostsee. Am 11. August 2022 begann ein massives Fischsterben im Bereich des Mittellaufs der Oder, bei dem auch andere aquatische Lebewesen verendeten. An der Mündung der Oder und in der Ostsee wurde kein Fischsterben beobachtet. Es wurde beobachtet, dass die Fische vor ihrem Tod zwischen der Wasseroberfläche, wo sie nach Luft schnappten, und dem Flussgrund, wo sie ruhten, hin und her pendelten. Ein solches Verhalten ist typisch bei einem Sauerstoffmangel, wie er in Sommermonaten bei großer Hitze manchmal zu beobachten ist. Im Bereich des Mittellaufs der Oder, bei Frankfurt (Oder), werden regelmäßig Wasserproben entnommen und auf verschiedene Parameter untersucht. Mithilfe dieser Untersuchungsergebnisse versuchte man die Ursache der Katastrophe zu ermitteln. Auffällig war ein sehr niedriger Wasserstand der Oder im Sommer 2022. Abbildung 1.1: Sauerstoffgehalt im Mittellauf der Oder im Tagesverlauf (im Juli)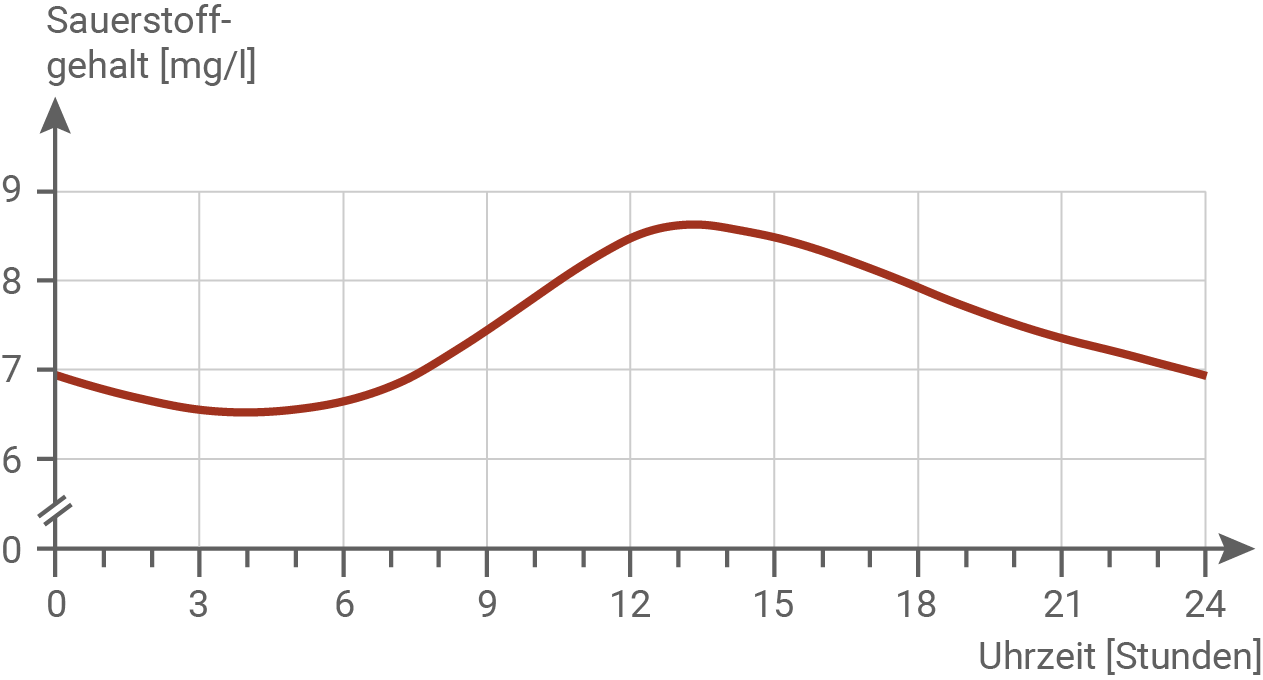

Die elektrische Leitfähigkeit ist ein Maß für die Salzkonzentration des Wassers. Eine hohe elektrische Leitfähigkeit entspricht einer hohen Salzkonzentration.
Die fehlenden Werte in C) und E) liegen außerhalb des Messbereichs.
Material 2
Die Alge Prymnesium parvum
P. parvum ist eine einzellige Mikroalge, welche ca. 10 µm lang ist. Sie kann sich mithilfe von Geißeln bewegen.
P. parvum benötigt zur Vermehrung einen erhöhten Salzgehalt. Deshalb lebt sie meist im Brackwasser, d. h. im Übergangsbereich vom Fließgewässer ins Meer, in dem sich Süß- und Salzwasser vermischen. Sie kann aber auch in Binnengewässern vorkommen, die einen relativ hohen Salzgehalt aufweisen.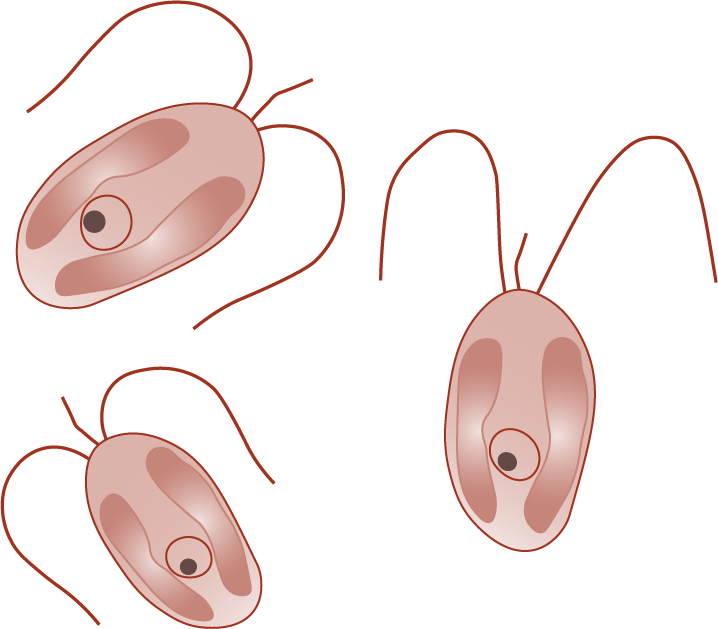
Material 3
Kohlebergbau in Polen
Der Kohlebergbau am Oberlauf der Oder hat eine lange Tradition, die bis heute anhält. Um die unterirdischen Kohleminen betreiben zu können, müssen diese permanent entwässert werden, wobei große Mengen an stark salzhaltigen Abwässern anfallen. Diese werden zu einem großen Teil in den Oberlauf der Oder eingeleitet. Auch wenn verschiedene technische Methoden zur Aufbereitung und Entsalzung der Minenabwässer existieren, sind diese bisher nur an einzelnen Versuchsanlagen eingesetzt worden, denn dies erfordert einen hohen Energieaufwand und erzeugt dementsprechend hohe Kosten.Material 4
Nahrungsbeziehungen von Dorschen in der Ostsee
Material 5
Dorsche und Blaualgenblüte in der Ostsee
Da die Anzahl der Dorsche in der Ostsee sehr stark abgenommen hatte, wurde der Fischfang deutlich beschränkt. Trotzdem erholte sich der Dorschbestand nicht. Bei der Suche nach den Ursachen hierfür stellte man fest, dass sich das Phytoplankton der Ostsee in den letzten drei Jahrzehnten stark verändert hat. Zunehmend wird es im Sommer von massenhaft auftretenden fadenförmigen Blaualgen dominiert. Das Phänomen ist als Blaualgenblüte bekannt. Als Ursachen gelten eine zu hohe Zufuhr von Phosphaten, die vor allem aus Düngemitteln stammen, sowie steigende Wassertemperaturen. Dies sind Faktoren, die speziell das Wachstum der Blaualgen gegenüber anderem Phytoplankton begünstigen und letzteres weitgehend verdrängen. Im Gegensatz zu anderen Arten des Phytoplanktons werden Blaualgen nicht von den Krebstieren des Zooplanktons, wie dem Ruderfußkrebs, gefressen. In den folgenden Abbildungen ist der Energiefluss im Ökosystem Ostsee schematisch dargestellt. Abbildung 5.1: Energiefluss im Ökosystem Ostsee ohne Blaualgenblüte (Schema)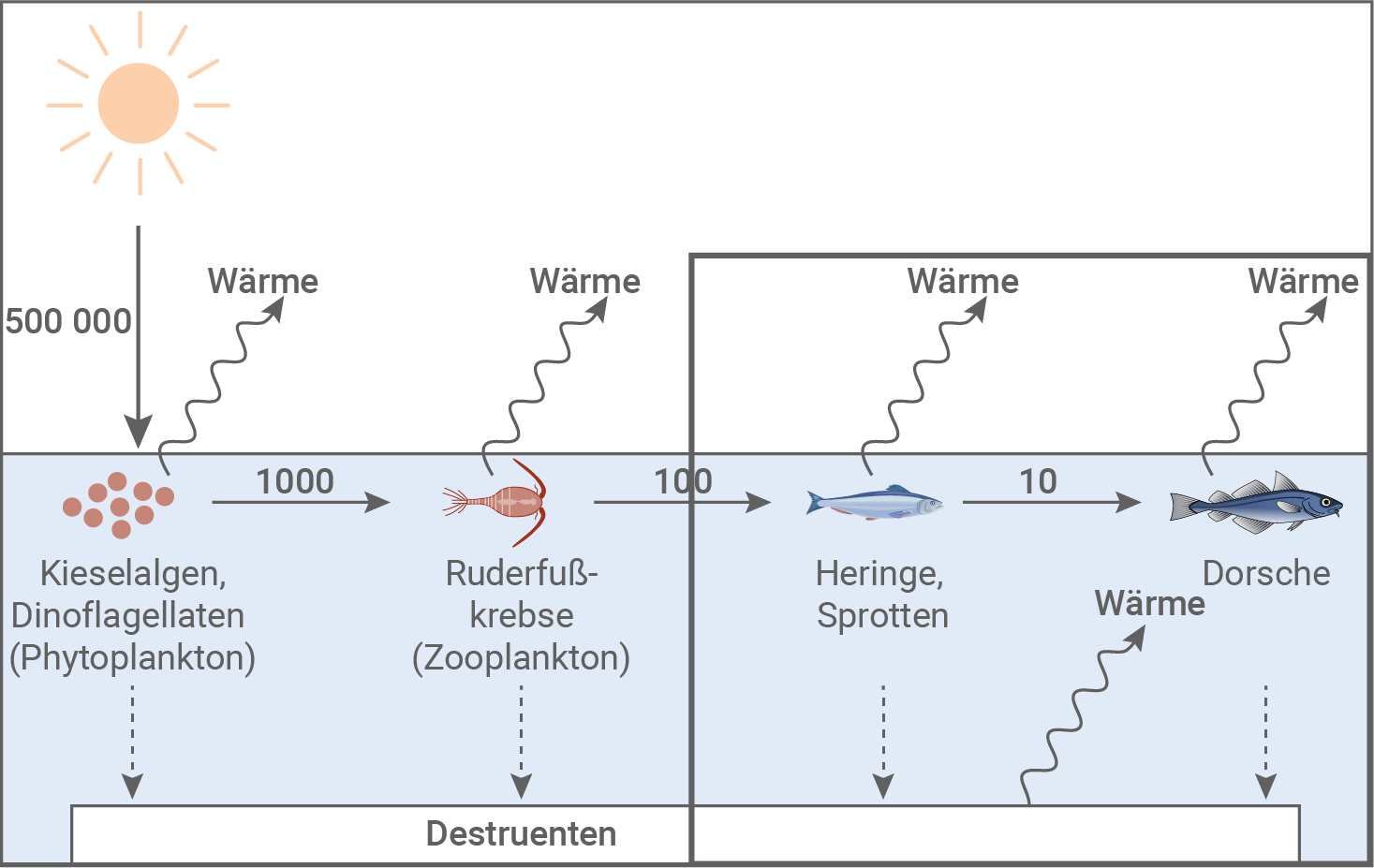
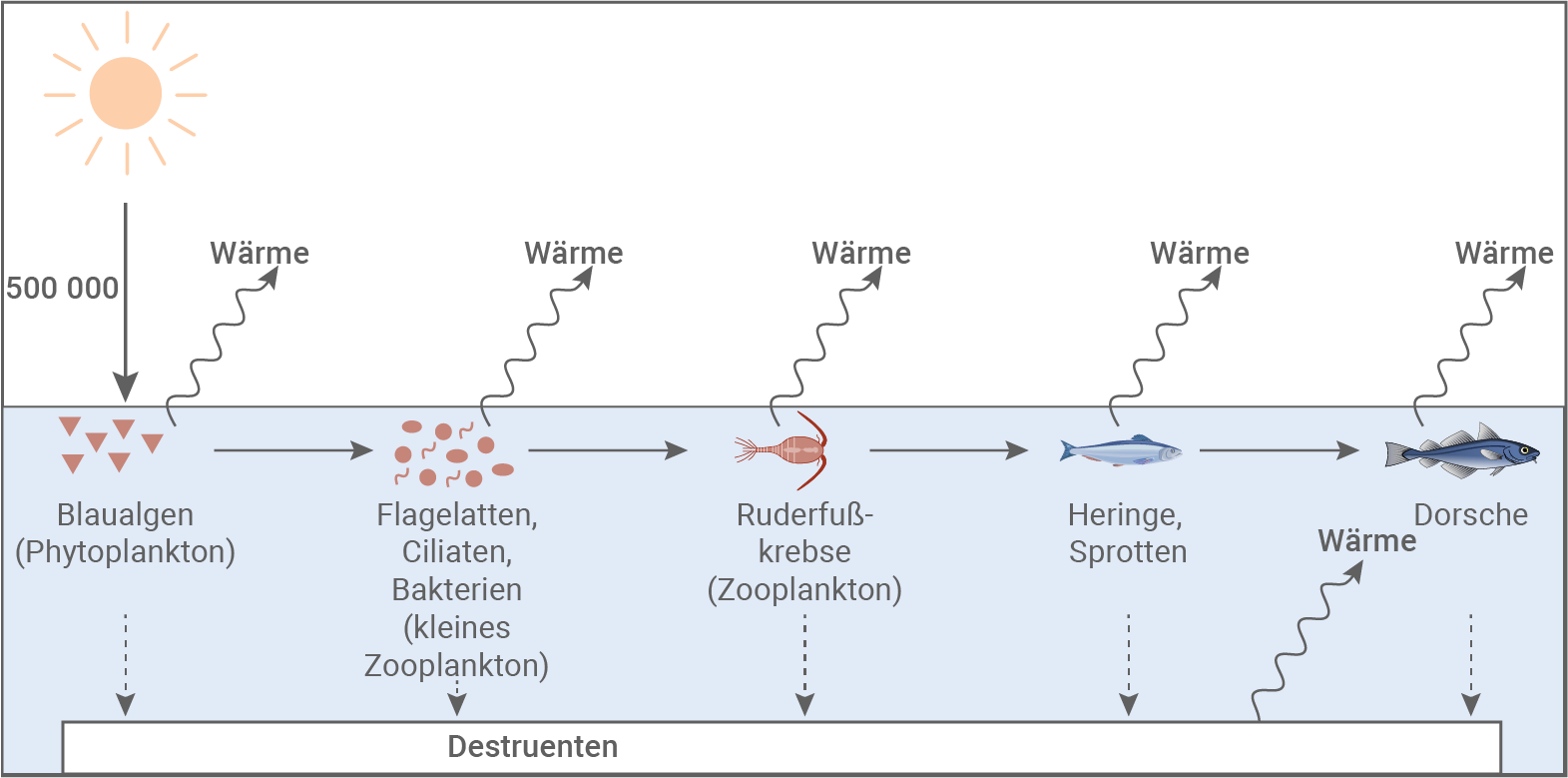
Die Zahlen stellen relative Energieeinheiten dar.
Material 6
Echt oder gefälscht? Genetische Untersuchung von Fischstäbchen
Der Dorsch ist, trotz des Rückgangs des Bestandes, weiterhin ein beliebter Speisefisch und wird weltweit als verarbeitetes Produkt, wie z. B. als Fischstäbchen, vermarktet. Hier kommt es immer wieder zu Fälschungen, d. h., es werden Fischsorten verwendet, die nicht den auf der Verpackung angegebenen Fischsorten entsprechen. Um die Fälschungen nachweisen zu können, wird die DNA de Fischstäbchen untersucht. Dazu kann eine PCR durchgeführt werden, es gibt jedoch auch neuere Verfahren, wie z. B. die Rekombinase-Polymerase-Amplifikation (RPA). Die ideale Temperatur dabei beträgt konstant 39 °C, doch auch bei niedrigeren Temperaturen kann die RPA ablaufen. Ablauf der Rekombinase Polymerase Amplifikation (RPA)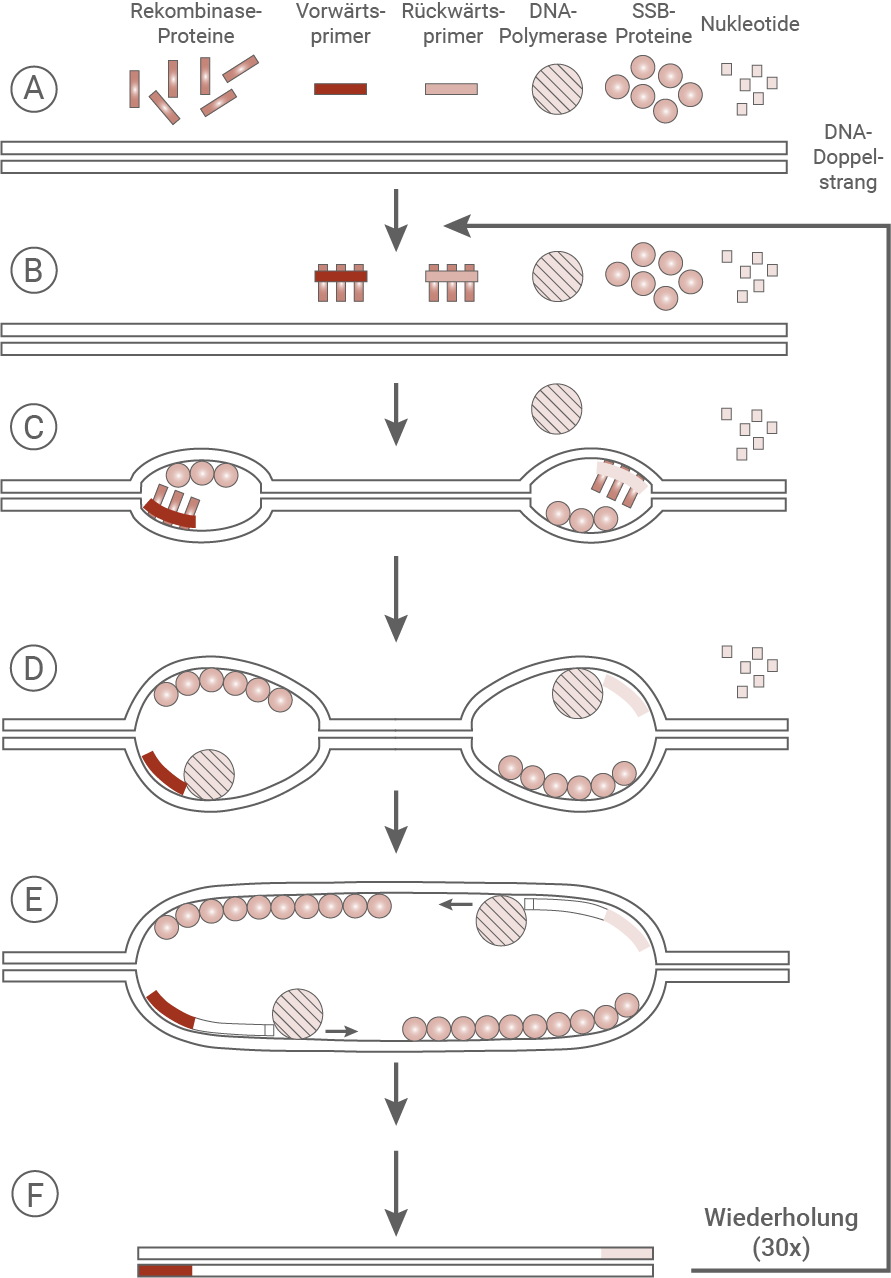
SSB-Proteine (= single-strand-binding-Proteine) stabilisieren DNA-Einzelstränge. Der bei F dargestellte DNA-Abschnitt ist erst ab dem 3. Zyklus vorhanden.
Material 7
Nachweis von DNA in Fischstäbchen
Bei marktüblichen Fischstäbchensorten sowie bei Proben von Dorsch und Lachs wurde jeweils eine RPA durchgeführt. Im Anschluss an die RPA wurden die gebildeten DNA-Abschnitte mittels Gelelektrophorese und anschließender Färbung der DNA sichtbar gemacht. Gelelektrophorese der Fischstäbchen-DNA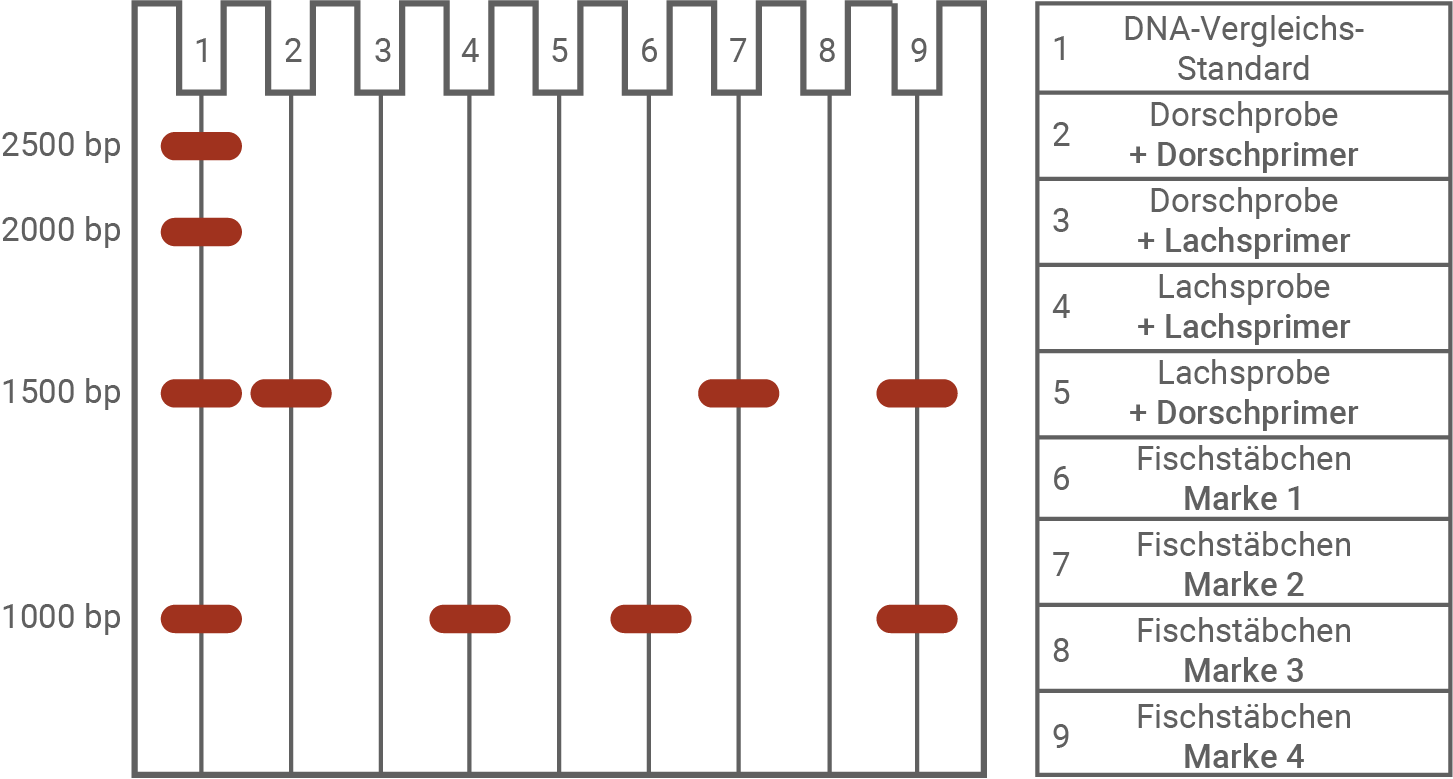
Die Einheit bp gibt die Anzahl der Basenpaare an und ist ein Maß für die Länge des DNA-Abschnitts.
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Die Produzenten nehmen Kohlenstoffdioxid (CO2) auf und bilden daraus durch Fotosynthese Glucose und andere organische Verbindungen. Ein Teil dieser organischen Substanzen wird von Konsumenten der verschiedenen Trophieebenen als Nahrung genutzt und durch Zellatmung zu CO2 abgebaut. Ausscheidungen der Konsumenten und unverdauliche sowie abgestorbene Teile von Produzenten und Konsumenten werden von Destruenten abgebaut, wobei aus den organischen Verbindungen CO2 freigesetzt wird. Das von Konsumenten und Destruenten abgegebene CO2 kann wieder von den Produzenten genutzt werden.
Mit Einsetzen der Helligkeit am frühen Morgen steigt der Sauerstoffgehalt im Wasser an, da Wasserpflanzen und Algen durch Fotosynthese zunehmend Sauerstoff produzieren. Ab dem Nachmittag beginnt der O2-Gehalt wieder zu sinken, da die Lichtintensität abnimmt, wodurch die Fotosyntheseleistung zurückgeht. Gleichzeitig verbrauchen die im Gewässer lebenden Organismen weiterhin Sauerstoff für die Zellatmung, was den Sauerstoffgehalt zusätzlich reduziert.
Am 07.08. ist ein deutlicher Anstieg des Sauerstoffgehalts im Fluss zu verzeichnen. Auch in der Phase, in der das Fischsterben einsetzt (ab dem 11.08.), bleibt der Sauerstoffgehalt auf einem hohen Niveau. Ein Sauerstoffmangel als Ursache kann daher ausgeschlossen werden, da die erhöhte Sauerstoffkonzentration für die Fische grundsätzlich günstig gewesen wäre.
Ab dem 06.08. sinkt die Wassertemperatur leicht und bleibt anschließend weitgehend konstant. Erst am 14.08. ist erneut ein leichter Anstieg zu verzeichnen.
Der Sauerstoffgehalt im Wasser steigt am 07.08. sprunghaft an, gefolgt von einem leichten Rückgang in den darauffolgenden Tagen. Ab dem 14.08. stabilisiert sich der Wert auf einem konstanten Niveau, das deutlich über dem ursprünglichen Ausgangswert liegt.
Die elektrische Leitfähigkeit erhöht sich ab dem 07.08. stark und überschreitet den Messbereich. Erst ab dem 15.08. liegen die Werte wieder innerhalb des erfassbaren Bereichs.
Die Trübung des Wassers verdoppelt sich innerhalb von zwei Tagen und bleibt anschließend – wenn auch leicht abgeschwächt – auf einem hohen Niveau bestehen.
Der Chlorophyllgehalt zeigt einen extremen Anstieg: Innerhalb von vier Tagen überschreitet er den Messbereich.
Der Nitratgehalt sinkt innerhalb von zwei Tagen auf unter die Hälfte des ursprünglichen Wertes.
Erklärung der Messergebnisse im Zusammenhang:
Die stark erhöhte Leitfähigkeit des Flusswassers lässt sich auf die Einleitung salzhaltiger Abwässer aus dem Braunkohleabbau sowie den gleichzeitig niedrigen Wasserstand zurückführen. In Kombination mit ansteigenden Wassertemperaturen von bis zu 25 °C führte die hohe Salzkonzentration zu einer massenhaften Vermehrung von Algen. Dies wird durch die deutliche Zunahme der Trübung sowie den drastischen Anstieg des Chlorophyllgehalts belegt. Im Rahmen dieses Algenwachstums wurde vermehrt Nitrat aufgenommen, was den beobachteten starken Rückgang des Nitratgehalts erklärt. Gleichzeitig setzten die Algen durch intensive Fotosynthese große Mengen Sauerstoff frei, was den sprunghaften Anstieg des O2-Gehalts am 07.08. nachvollziehbar macht.Begründung des Fischsterbens:
Im Zuge der Algenblüte kam es zur Bildung von Prymnesinen – toxischen Stoffwechselprodukten bestimmter Algenarten. Diese Toxine wirken insbesondere in salzhaltigem Milieu stark fischtoxisch: Sie schädigen die Kiemen der Fische und zerstören deren rote Blutzellen. Infolgedessen können die Fische den im Wasser gelösten Sauerstoff weder effizient über die Kiemen aufnehmen noch im Körper transportieren. Dies führt letztlich zum Erstickungstod, obwohl der Sauerstoffgehalt im Wasser weiterhin hoch ist.Durch den Rückgang der Dorschpopulation sinkt der Fraßdruck auf deren Beutetiere – insbesondere Heringe und Sprotten. Infolgedessen nehmen die Bestände dieser Fischarten deutlich zu. Die größere Zahl an Sprotten führt zu einem vermehrten Fraß von Dorscheiern, während die Heringe verstärkt Dorschlarven fressen.
Darüber hinaus führt die erhöhte Populationsdichte von Heringen und Sprotten zu einem Rückgang der Ruderfußkrebse (Zooplankton), da diese als Nahrungsgrundlage dienen. Da Ruderfußkrebse wiederum eine wichtige Nahrungsquelle für junge Dorsche darstellen, verschlechtert sich die Nahrungsgrundlage der Dorschlarven zusätzlich.
Diese drei negativen Effekte – Eifraß durch Sprotten, Larvenfraß durch Heringe und Nahrungsmangel durch Zooplanktonrückgang – wirken sich in Kombination stark populationsmindernd auf den Dorschbestand aus und erklären den drastischen Rückgang.
Heringe und Sprotten nehmen Nahrung mit einem relativen Energiegehalt von 100 Einheiten auf. Ein Teil dieser Energie wird für Stoffwechselprozesse genutzt und dabei als Wärme abgegeben. Ein weiterer Anteil wird in Form von Ausscheidungen und unverdaulichen Resten an Destruenten weitergeleitet, die ihrerseits durch ihren Stoffwechsel ebenfalls Wärme freisetzen. Nur etwa 10 % der Energie einer Trophiestufe wird an die nächsthöhere Stufe weitergegeben. Daher stehen Dorschen, die Heringe und Sprotten fressen, lediglich 10 Energieeinheiten zur Verfügung. Auch sie geben durch Stoffwechsel Wärme ab und überführen einen Teil der Energie in Biomasse, die Destruenten zur Verfügung steht.
Im Falle einer Blaualgenblüte wird das übliche Phytoplankton zunehmend durch Blaualgen verdrängt. Diese können jedoch nicht von den Ruderfußkrebsen gefressen werden, die normalerweise die Primärkonsumenten darstellen. Stattdessen übernehmen nun kleinere Zooplanktonarten diese Rolle. Dadurch verschiebt sich die gesamte Nahrungskette: Die Ruderfußkrebse und alle nachfolgenden Räuber – einschließlich der Dorsche – nehmen eine höhere Trophiestufe ein. Die Dorsche befinden sich nun auf der 5. Trophiestufe statt auf der 4.
Da bei jedem Übergang nur rund 10 % der Energie übertragen wird, sinkt die verfügbare Energiemenge für die Dorsche erheblich: Statt 10 Energieeinheiten erhalten sie nur noch 1. Dies bedeutet, dass in Zeiten von Blaualgenblüten deutlich weniger Energie für den Erhalt der Dorschpopulation zur Verfügung steht, was ihre Überlebensfähigkeit stark einschränkt.
Bei der RPA werden Vorwärts- und Rückwärtsprimer, Rekombinase-Proteine, Einzelstrang-bindende Proteine (SSB), DNA-Nukleotide sowie eine DNA-Polymerase zur doppelsträngigen DNA-Vorlage gegeben.
Im Gegensatz dazu umfasst die PCR lediglich die Zugabe von Vorwärts- und Rückwärtsprimern, Nukleotiden und einer DNA-Polymerase. Rekombinase- oder SSB-Proteine kommen hierbei nicht zum Einsatz.
Bei der RPA bilden die Primer gemeinsam mit den Rekombinase-Proteinen Komplexe, die eine gezielte Bindung an die Zielsequenz ermöglichen. Diese Komplexbildung findet bei der PCR nicht statt.
Die Primer-Rekombinase-Komplexe lagern sich bei der RPA an die komplementären Sequenzen des doppelsträngigen DNA-Moleküls an und lösen dabei lokal Wasserstoffbrückenbindungen auf. SSB-Proteine stabilisieren die entstehenden Einzelstrangbereiche.
Im Gegensatz dazu wird bei der PCR die gesamte DNA durch Erhitzen denaturiert, wodurch die Stränge vollständig getrennt werden. Erst beim Abkühlen binden die Primer an die nun einzelsträngigen DNA-Sequenzen – ohne Hilfe von Rekombinase- oder SSB-Proteinen.
Nach der Anlagerung der Primer werden die Rekombinase-Proteine bei der RPA wieder entfernt. Die DNA-Polymerase bindet anschließend an die Primer, wobei zusätzliche SSB-Proteine die entstehenden Einzelstränge stabilisieren.
Bei der PCR wird hingegen eine thermostabile DNA-Polymerase verwendet, da die Reaktion bei Temperaturen über 90 °C abläuft – bei der RPA ist dies aufgrund der konstant niedrigen Temperatur (ca. 39 °C) nicht erforderlich.
Die DNA-Polymerase der RPA verlängert die Primer, indem sie neue komplementäre Stränge synthetisiert und dabei die ursprüngliche Doppelhelix schrittweise weiter auftrennt. Dabei unterstützen SSB-Proteine die Stabilisierung der Einzelstränge.
Im Gegensatz dazu spaltet die DNA-Polymerase der PCR die DNA-Stränge nicht aktiv auf, sondern nutzt die bereits durch Hitze getrennten Einzelstränge zur Synthese. Abgesehen davon verläuft die Synthese ähnlich.
Ein zyklischer Temperaturwechsel ist bei der RPA nicht notwendig, da die eingesetzten Enzyme bei konstanten Temperaturen aktiv bleiben.
Nach Abschluss der Synthese lösen sich DNA-Polymerase und SSB-Proteine bei der RPA wieder ab. Die Schritte B bis F werden mehrfach (ca. 30-mal) wiederholt.
Auch bei der PCR entstehen durch zyklische Wiederholungen der Schritte nach dem dritten Zyklus erstmals vollständig verdoppelte Zielsequenzen. Die Reaktionsabläufe werden ebenfalls rund 30-mal durchlaufen.
Erklärung der Ergebnisse in den Spuren 2 bis 5 (Gelelektrophorese):
Spur 2: Die Dorsch-spezifischen Primer binden aufgrund komplementärer Basenpaarung an die DNA der Dorschprobe. Im Rahmen der RPA entsteht ein DNA-Fragment mit einer Länge von 1500 Basenpaaren – entsprechend dem Abstand zwischen den beiden Primern.Spur 3: Es erfolgt keine Amplifikation, da die Lachs-spezifischen Primer keine komplementäre Sequenz in der Dorsch-DNA finden.
Spur 4: Die Lachsprimer binden spezifisch an die Lachs-DNA. Es entsteht ein 1000 bp langes DNA-Fragment, das dem Abstand der Primer auf der Lachs-DNA entspricht.
Spur 5: Es wird kein DNA-Produkt gebildet, da die Dorschprimer nicht an die Lachs-DNA binden können – es fehlt die komplementäre Zielsequenz.
Auswertung der Ergebnisse in den Spuren 6 bis 9 (Fischstäbchenproben):
Marke 1 (Spur 6): Es wird ein DNA-Fragment mit 1000 bp detektiert, jedoch kein Fragment mit 1500 bp. → Die Probe enthält Lachs, aber keinen Dorsch.Marke 2 (Spur 7): Es ist nur ein 1500 bp langes Fragment nachweisbar. → Die Probe enthält Dorsch, aber keinen Lachs.
Marke 3 (Spur 8): Es sind keine amplifizierten DNA-Fragmente sichtbar. → Die Probe enthält weder Dorsch noch Lachs.
Marke 4 (Spur 9): Sowohl ein 1000 bp als auch ein 1500 bp Fragment sind nachweisbar. → Die Probe enthält sowohl Lachs als auch Dorsch.