Aufgabe 1 – Energieträger für Fahrzeuge
lm Zuge der Entwicklung klimafreundlicherer Antriebe werden aktuell verschiedene Energieträger mit besserer Kohlenstoffdioxid-Bilanz als erdölbasierte Treibstoffe erforscht. lnsbesondere Methanol tritt in den Mittelpunkt vieler solcher Forschungsvorhaben.
Formuliere die Reaktionsgleichung für die Methanol-Synthese auf dem konventionellen Weg (M 1).
Gib das Prinzip von Le Chatelier an.
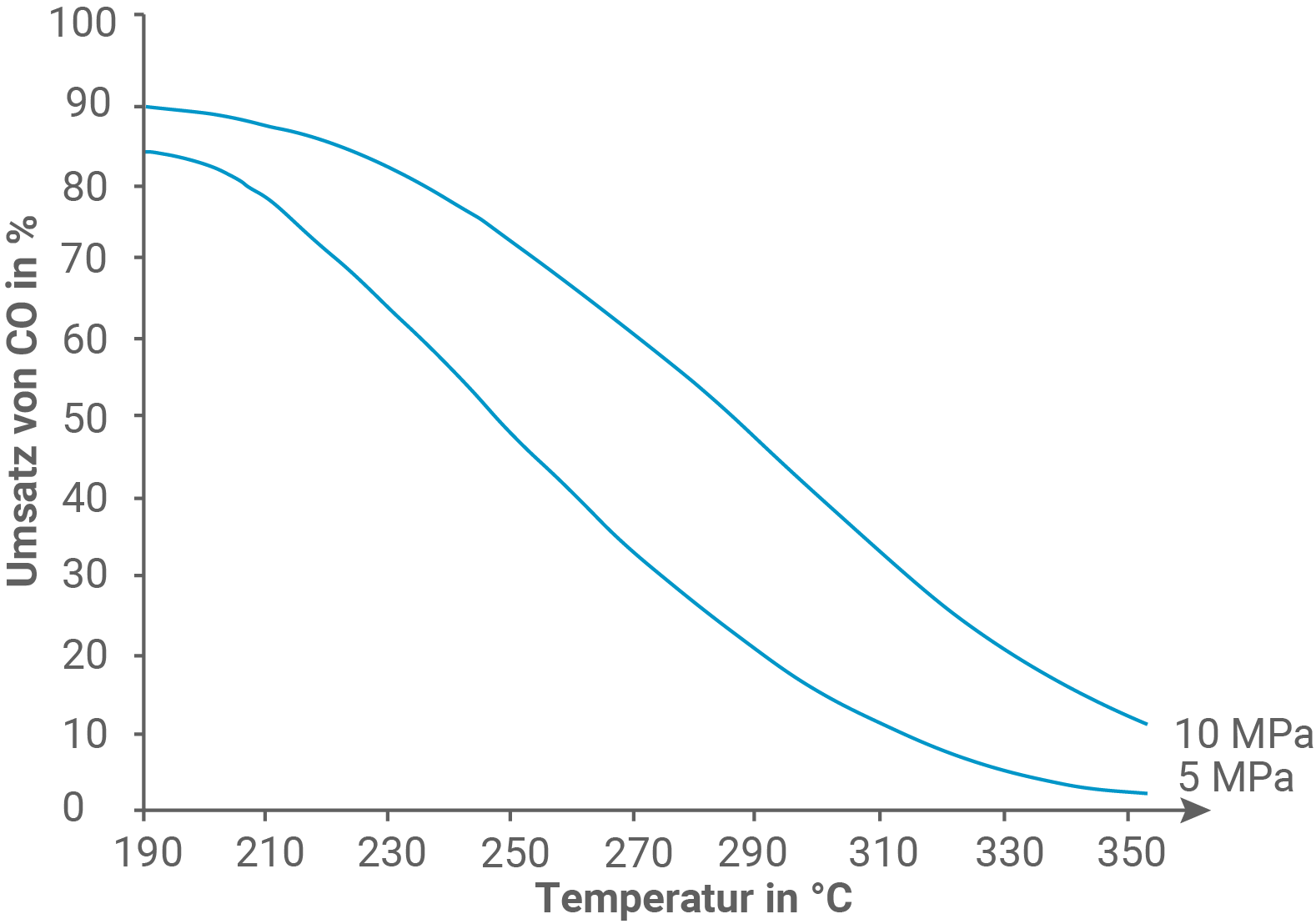
Begründe auch unter Berücksichtigung von Abbildung 1 die Steuerungsmöglichkeit bei der konventionellen Methode durch geeignete Wahl des Drucks (M 2).
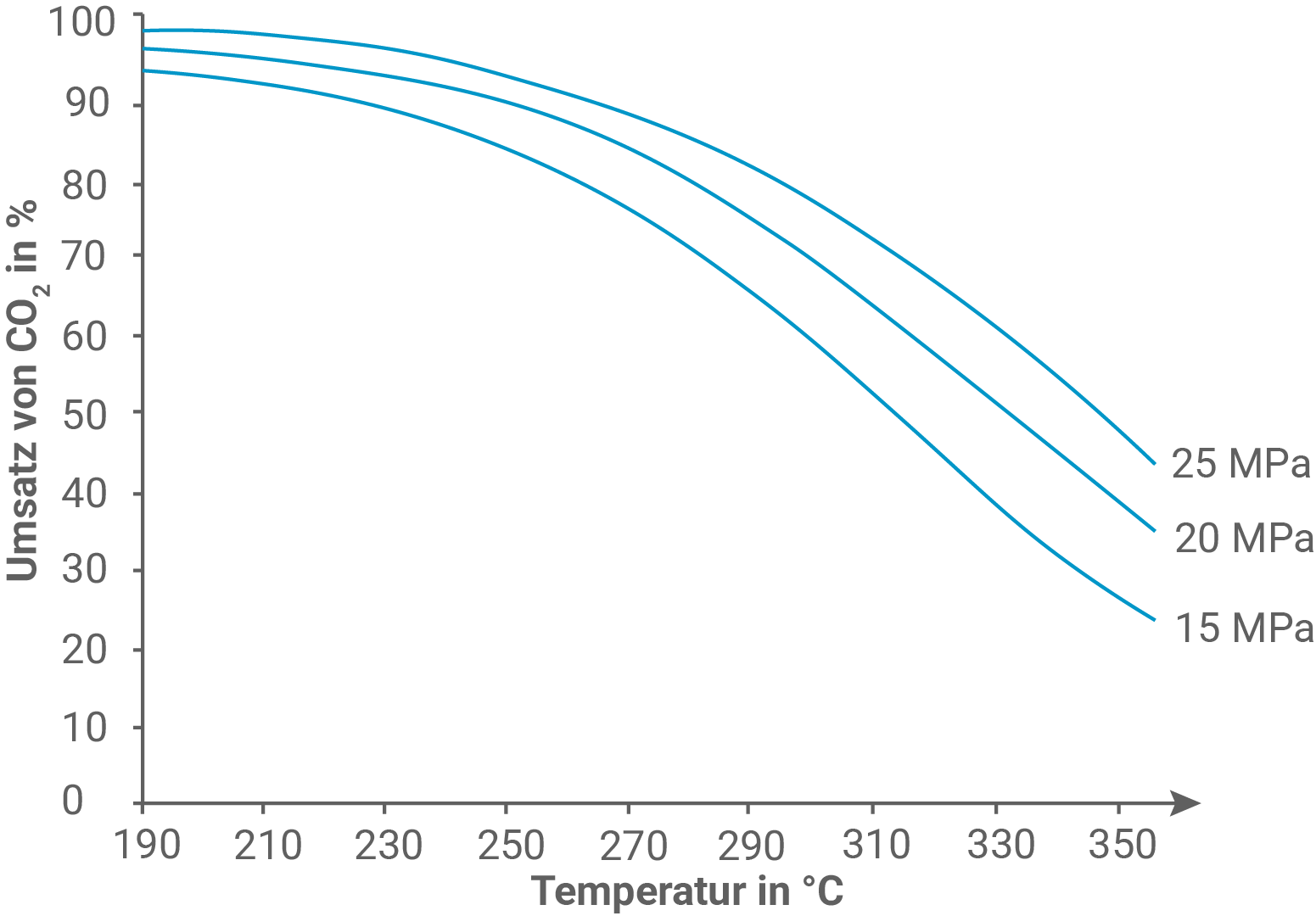
Leite aus Abbildung 2 eine Aussage über die Änderung der Enthalpie beim BASF-Prozess ab (M 2).
Überprüfe deine Aussage durch eine Berechnung (M 3).
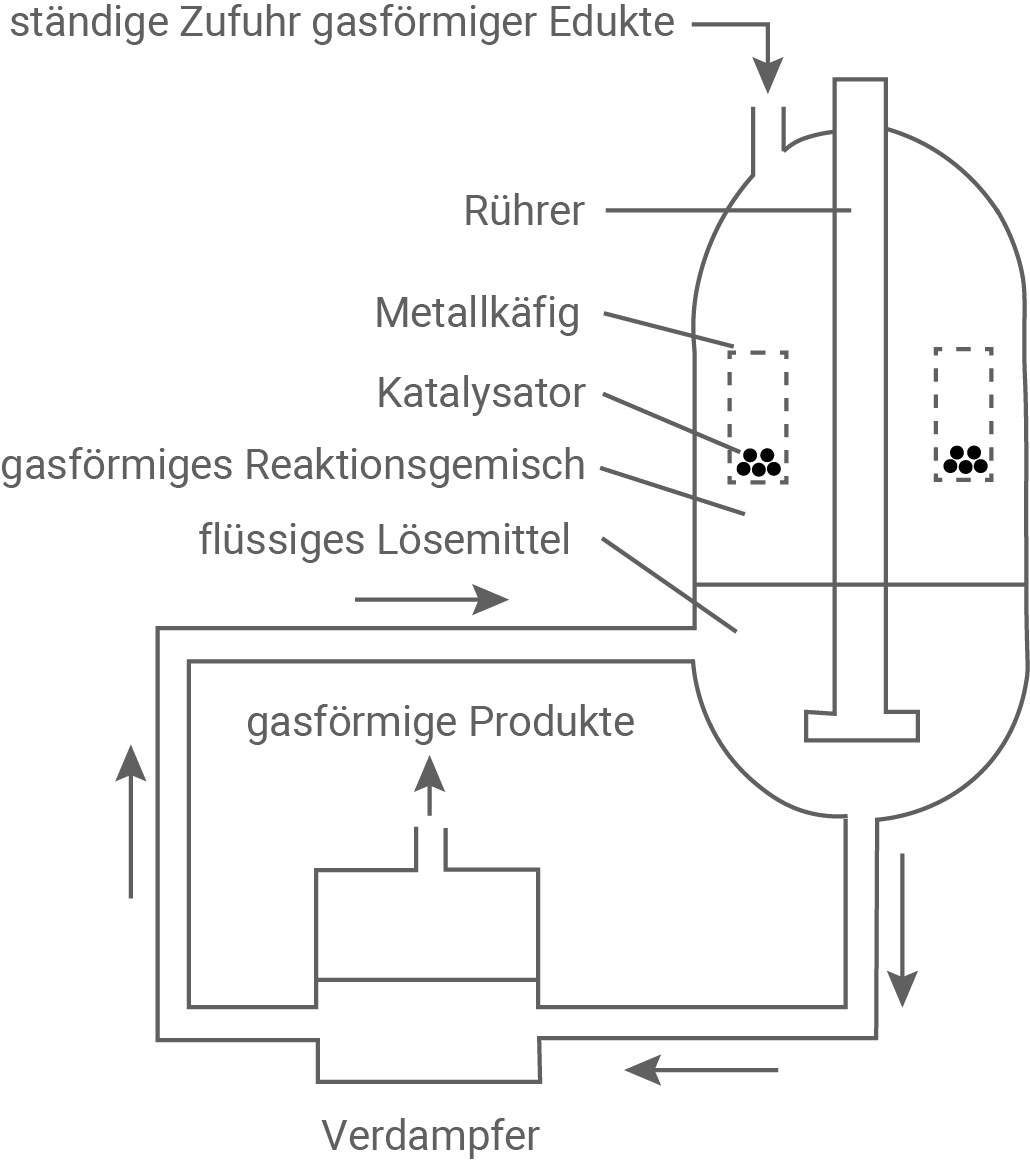
Erkläre die Prozesse, die zur konstanten Nachbildung und Abtrennung von Methanol im Reaktor führen (M 4, Abb. 3).
Diskutiere anhand von zwei Eigenschaften, ob die angegebenen Lösungsmittel zur Entfernung des Methanols aus dem Kreislauf geeignet sind (M 4, Tab. 2).
Berechne jeweils für die vollständige Verbrennung von Methanol und Octan die freigesetzte Masse an Kohlenstoffdioxid pro Kilogramm Treibstoff (M 5).
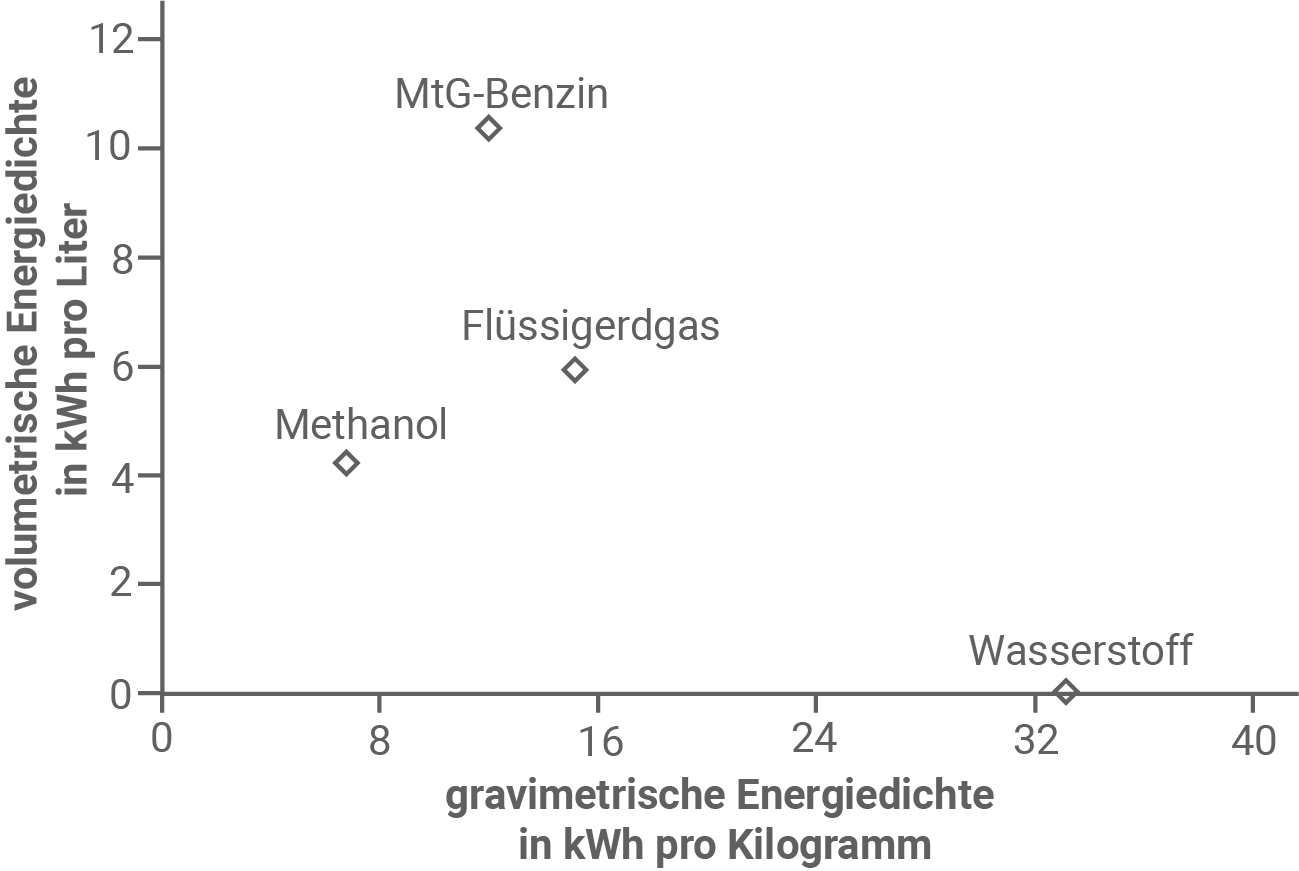
Beurteile unter Einbeziehung der in Abbildung 4 gegebenen Energiedichten sowie Deiner Berechnungen aus Aufgabe 4, ob Methanol oder das daraus hergestellte MtG-Benzin als Treibstoff besser geeignet ist (M 5).
Hinweis: Solltest du in Teilaufgabe 4 keine Ergebnisse erhalten haben, gehe von den folgenden Ersatzwerten aus: 2 kg Kohlenstoffdioxid-Freisetzung bei der Methanol-Verbrennung und 4 kg Kohlenstoffdioxid-Freisetzung bei der Octan-Verbrennung.
Material 1: Methanol-Synthese aus Wasserstoff und verschiedenen Kohlenstoffoxiden
Methanol ist eine wichtige Grundchemikalie, die auch direkt als Treibstoff verwendet werden kann. Methanol wird großtechnisch über zwei Synthesewege produziert. Bei der konventionellen Synthese wird Methanol aus Kohlenstoffmonooxid und Wasserstoff bei einer Temperatur von und einem Druck von
hergestellt.
Beim Hochdruckverfahren das z. B. das Unternehmen BASF anwendet, wird statt Kohlenstoffmonooxid Kohlenstoffdioxid verwendet und es entsteht als Nebenprodukt Wasser (BASF-Prozess). Die Temperatur liegt hierbei zwischen
Material 2: Umsetzung des Synthesegases
In beiden Fällen wird die Produktausbeute durch die Wahl der Reaktionsbedingungen beeinflusst.
Material 3: Thermodynamische Größen
| Verbindung | |
|---|---|
Material 4: Großtechnischer Prozess zur Methanol-Synthese
Die Methanol-Ausbeute ist bei allen Synthesemethoden durch die Lage des chemischen Gleichgewichts begrenzt. Um die Ausbeute zu erhöhen, werden in diesem Fall die Produkte mithilfe eines Lösungsmittels kontinuierlich entfernt. Bei der Auswahl des Lösungsmittels muss u. a. die Siedetemperatur berücksichtigt werden. Die von Methanol beträgt
| Lösungsmittel | Skelettformel | |
|---|---|---|
| n-Hexan | ||
| Tetraethylenglycol |
Material 5: Treibstoffe
Methanol kann in speziellen Verbrennungsmotoren direkt als Treibstoff verwendet werden oder lässt sich im sogenannten MtG-Verfahren, Methanol to Gasoline (Methanol zu Benzin), zu MtG-Benzin verarbeiten. Bei diesem energieaufwendigen Verfahren entsteht ein Gemisch, das zum größten Teil Alkane wie z. B. Isomere des Octans
enthält.
Die Einsatzmöglichkeiten eines Treibstoffs hängen unter anderem von der volumetrischen und gravimetrischen Energiedichte ab (Abb. 4). Diese Größen geben an, wie viel Energie in einem bestimmten Volumen (volumetrische Energiedichte) bzw. einer bestimmten Masse (gravimetrische Energiedichte) eines Stoffes gespeichert ist. Im Fall von Brennstoffen handelt es sich dabei jeweils um die Energie, die bei der Verbrennung freigesetzt wird. Bei der Verbrennung der Brennstoffe entsteht Kohlenstoffdioxid .
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Formulierung der Reaktionsgleichung
Angabe des Prinzips von Le Chatelier
Nach dem Prinzip von Le Chatelier weicht ein im Gleichgewicht befindliches System einem äußeren Zwang so aus, dass der Zwang minimiert wird.
Begründung der Steuerungsmöglichkeit
Aus Abbildung 1 lässt sich erkennen: Bei gleichbleibender Temperatur nimmt der Anteil des umgesetzten Kohlenstoffmonooxids mit steigendem Druck zu.
Aus 3 Mol gasförmiger Ausgangsstoffe entsteht 1 Mol eines gasförmigen Reaktionsprodukts, wodurch das Gesamtvolumen der Gase abnimmt.
Eine Erhöhung des Drucks führt dementsprechend zu einer höheren Konzentration des Produkts.
Ableitung der Enthalpieänderung beim BASF-Prozess
Aus Abbildung 2 wird deutlich: Mit steigender Temperatur wird weniger Kohlenstoffdioxid umgesetzt.
Das chemische Gleichgewicht verschiebt sich in Richtung der Edukte, was auf eine verstärkte Rückreaktion hinweist.
Da die Bildung von Methanol bei höheren Temperaturen weniger stark erfolgt, handelt es sich bei der Hinreaktion um eine exotherme Reaktion. Das bedeutet, die Reaktion gibt Wärme ab und die Enthalpieänderung ist negativ.
Berechnung der Enthalpieänderung
Erklärung der Prozesse
Die kontinuierliche Zufuhr von Edukten sowie das Lösen von Methanol im Lösungsmittel stören das Gleichgewicht zwischen Edukten und Produkten in der Gasphase fortlaufend.
Gemäß dem Prinzip von Le Chatelier begünstigen diese Vorgänge die Hinreaktion, wodurch kontinuierlich neues Methanol entsteht.
Das entstehende Stoffgemisch aus Lösungsmittel, Methanol und Wasser wird anschließend in den Verdampfer geleitet, wo die Produkte vom Lösungsmittel getrennt werden.
Diskussion zur Wahl des Lösungsmittels
Aufgrund der Löslichkeit:
Methanol ist ein hydrophiler Stoff, während Hexan hydrophob ist. Das bedeutet, Methanol ist in Hexan nicht löslich. Tetraethylenglycol hingegen ist ebenfalls hydrophil, sodass sich Methanol darin gut löst.
Aufgrund der Siedetemperatur:
Da im Verdampfer eine Trennung des Lösungsmittels erfolgen soll, muss dessen Siedetemperatur über der von Methanol liegen.
Die Siedetemperatur von Hexan liegt in etwa auf dem gleichen Niveau wie die von Methanol, wodurch im Verdampfer keine wirksame Trennung möglich ist.
Tetraethylenglycol besitzt eine höhere Siedetemperatur als Methanol, wodurch im Verdampfer nur Methanol in die Gasphase übergeht.
Daher ist Tetraethylenglycol als Lösungsmittel geeignet, Hexan hingegen nicht.
Berechnung der Masse
Methanol
Octan
Beurteilung der Eignung als Treibstoff
Gravimetrische Energiedichte
Die gravimetrische Energiedichte von MtG-Benzin ist ca. doppelt so groß wie die von Methanol.
Die Verbrennung von MtG-Benzin produziert aber bei gleicher Masse die ca. doppelt so große Masse an Kohlenstoffdioxid, d. h. es wird für die gleiche im Motor zur Verfügung stehende Energie bei MtG-Benzin und Methanol ungefähr die gleiche Masse an klimaschädlichem Kohlenstoffdioxid freigesetzt.
MtG-Benzin kostet in der Herstellung mehr, da Methanol erst zu Benzin verarbeitet werden muss, wofür zusätzliche Energie benötigt wird.
Es ist nicht ersichtlich, wie diese zusätzliche Energie erzeugt wird und ob dabei klimaschädliches Kohlenstoffdioxid freigesetzt wird.
Volumetrische Energiedichte
Die volumetrische Energiedichte ist bei Methanol deutlich geringer als bei MtG-Benzin.
Die maximale Reichweite ist bei Fahrzeugen gleichen Typs und gleicher Größe des Tanks bei der Verwendung von Methanol deutlich niedriger; Autos müssen also häufiger betankt werden.
Sachurteil
Chemisch betrachtet ist MtG-Benzin aufgrund seiner hohen volumetrischen und gravimetrischen Energiedichte besser als Kraftstoff geeignet. Jedoch ist Methanol unter Berücksichtigung der Herstellungsenergie und der CO2-Bilanz unter Umständen energetisch effizienter.