Aufgabe 3 – Wasserstoffperoxid & Weinsäure
Wähle zwischen den Aufgaben 3.1 und 3.2. Bearbeite nur eine dieser Aufgaben.
Wasserstoffperoxid
Im Haushalt kann dreiprozentige Wasserstoffperoxid-Lösung u. a. als Desinfektions- und Reinigungsmittel eingesetzt werden. Regelmäßige Qualitätskontrollen sind nötig, da diese Lösungen nicht beständig sind.
Beschreibe die Bindungen in einem Wasserstoffperoxid-Molekül (M 1).
Erkläre die gute Wasserlöslichkeit von Wasserstoffperoxid (M 1).
Erkläre unter Einbeziehung einer Reaktionsgleichung, dass es sich bei dem Zerfall von Wasserstoffperoxid um eine Disproportionierung handelt (M 1, M 2).
Begründe anhand der Gibbs-Helmholtz-Gleichung, dass der Zerfall von Wasserstoffperoxid unabhängig von der Temperatur exergonisch verläuft (M 1).
Formuliere die Teilgleichungen der Reaktion, die der Konzentrationsbestimmung einer Wasserstoffperoxid-Lösung zugrunde liegen (M 3).
Erläutere an diesen das Donator-Akzeptor-Prinzip.
Begründe, dass bei diesem Analyseverfahren kein Indikator für die Bestimmung des Äquivalenzpunktes benötigt wird (M 3).
Beurteile unter Verwendung von Standardpotenzialen die gegebene Vorschrift zum Einsatz der Säuren hinsichtlich der Genauigkeit des Titrationsergebnisses (M 3).
Führe das Experiment durch (M 4).
Überprüfe den vom Hersteller angegebenen Massenteil bei einer länger gelagerten Wasserstoffperoxid-Lösung (M 4).
Hinweis: Für den Fall, dass Du keine auswertbaren Beobachtungen erzielt hast, kannst du dir Ersatzbeobachtungen unter Nichterteilung von 1 BE geben lassen.
Material 1: Wasserstoffperoxid
Wasserstoffperoxid neigt dazu, in einer exothermen Reaktion leicht in Sauerstoff und Wasser zu zerfallen.

Darstellung der räumlichen Struktur (rechts)
Material 2: Spezielle Redoxreaktionen
Synproportionierung und Disproportionierung sind Spezialfälle der Redoxreaktion. Bei der Synproportionierung wird aus einer höheren und einer niedrigeren Oxidationsstufe einer Atomsorte in den Edukten eine mittlere Oxidationsstufe in den Produkten gebildet. Bei der Disproportionierung wird aus einer mittleren Oxidationsstufe einer Atomsorte in den Edukten eine höhere und eine niedrigere Oxidationsstufe in den Produkten gebildet.
Material 3: Konzentrationsbestimmung einer Wasserstoffperoxid-Lösung
Die Konzentrationsbestimmung einer angesäuerten Wasserstoffperoxid-Lösung kann durch eine Redoxtitration mit Kaliumpermanganat-Lösung erfolgen. Die dieser Analyse zugrunde liegende Reaktion wird durch die nachfolgende chemische Gleichung in Ionenschreibweise beschrieben:
Material 4: Experiment zur Bestimmung des Massenanteils an Wasserstoffperoxid
Im Handel vertriebene Wasserstoffperoxid-Lösung zur Desinfektion beinhaltet in der Regel laut Hersteller einen Massenanteil an Wasserstoffperoxid von .
Für die quantitative Analyse einer im Handel gekauften und über längere Zeit gelagerten Wasserstoffperoxid-Lösung wurden 10 mL dieser Lösung entnommen und mit destilliertem Wasser auf 100 mL verdünnt (Analysen-Lösung).
- Weithalserlenmeyerkolben
(V = 200 mL bis V = 300 mL) - Vollpipette (V = 10 mL) mit Pipettierhilfe
- Bürette mit Stativmaterial
- Messzylinder (V = 10 mL)
- Kaliumpermanganat-Lösung als Maßlösung
- Schwefelsäure-Lösung
- Wasserstoffperoxid-Lösung
als Analysenlösung - destilliertes Wasser
Durchführung:
Entnimm der vorbereiteten Analysen-Lösung 10 mL und säuere diese mit ca. 5 mL der bereitgestellten Schwefelsäure-Lösung an. Fülle das Gemisch mit destilliertem Wasser auf ca. 100 mL auf.
Titriere diese Lösung mit der zur Verfügung stehenden Kaliumpermanganat-Lösung bis zum bleibenden Farbumschlag.
Führe mindestens zwei Titrationen durch.
Hinweis zur Auswertung:
Gehe bei Deinen Berechnungen davon aus, dass die Dichte der für die Analyse hergestellten Wasserstoffperoxid-Lösung beträgt.
Weinsäure
Weinsäure ist eine bei Raumtemperatur in festem Aggregatzustand vorliegende Dicarbonsäure, die natürlich in Weintrauben vorkommt. Sie wird in der Lebensmittelindustrie als Zusatzstoff verwendet und dient in der chemischen Industrie zur Trennung von Enantiomeren.
Erkläre mithilfe von Strukturformeln am Beispiel der Weinsäure-Moleküle den Begriff Enantiomere (M 1).
Kennzeichne die asymmetrischen Kohlenstoff-Atome in einer Deiner Strukturformeln.
Gib den systematischen Namen der Weinsäure an (M 1).
Formuliere unter Nutzung von Strukturformeln eine mögliche Reaktionsgleichung für die Reaktion 1, die Bildung von Metaweinsäure (M 1).
Leite aus der Reaktionsgleichung für Reaktion 2 die vorliegende Reaktionsart ab (M 1).
Beschreibe eine Möglichkeit, Weinsäure experimentell vom Endiol zu unterscheiden (M 1).
Benenne die Bindungen zwischen dem zweiten und dritten Kohlenstoff-Atom im Weinsäure- und im Endiol-Molekül nach dem Orbitalmodell (M 1).
Führe das Experiment durch (M 3).
Leite ausgehend von Deinen Beobachtungen einen Vergleich der Stabilitäten der beiden Kupfer(II)-Komplexe ab (M 2, M 3).
Erkläre Deine Beobachtungen bezüglich der Komplexbildung in Abhängigkeit des pH-Werts (M 2, M 3).
Erläutere Deine Beobachtung in Reagenzglas 2 anhand einer Reaktionsgleichung (M 3).
Ordne Lösungen gleicher Stoffmengenkonzentration von Weinsäure, Butansäure und 4-Hydroxybutansäure nach sinkendem pH-Wert. Begründe.
Beurteile die Nutzung von Weinsäure als Säuerungsmittel im Wein (M 4).
Material 1: Reaktionen der Weinsäure
Reaktion 1
Weinsäure-Moleküle können unter Abspaltung von Wasser-Molekülen miteinander reagieren. Dabei bildet sich z. B. aus zwei Molekülen der Weinsäure ein Molekül Metaweinsäure. Metaweinsäure kann der Stoffklasse der Ester zugeordnet werden. Sie wird Weinprodukten zugesetzt, um die Ausfällung von Weinstein zu verlangsamen.
Reaktion 2
Weinsäure wird durch Reaktion mit z. B. Wasserstoffperoxid zu 2,3-Dihydroxybut-2-endisäure, ein Endiol, umgewandelt.
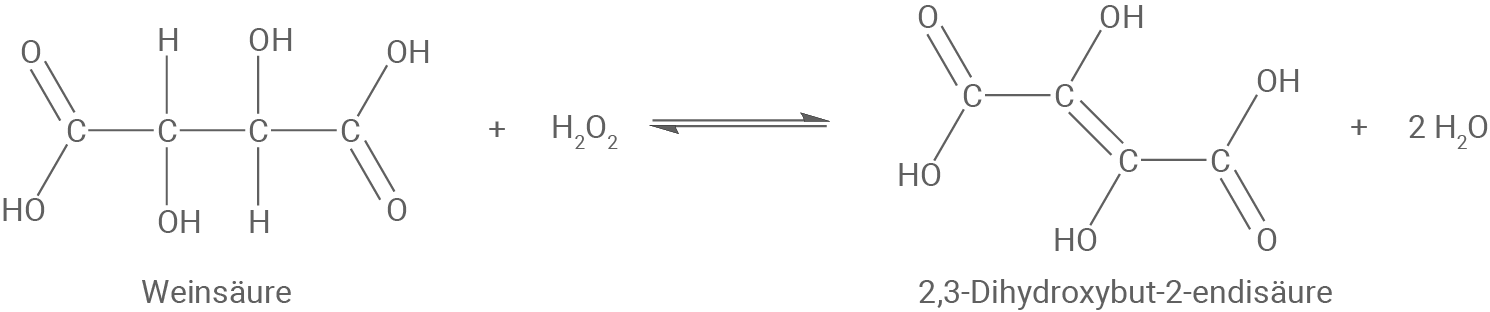
Material 2: Bildung von Kupfer-Komplexen
Die Salze der Weinsäure werden als Tartrate bezeichnet. Das Tartrat-Ion kann in Gegenwart starker Basen als Säure reagieren und deprotoniert werden.
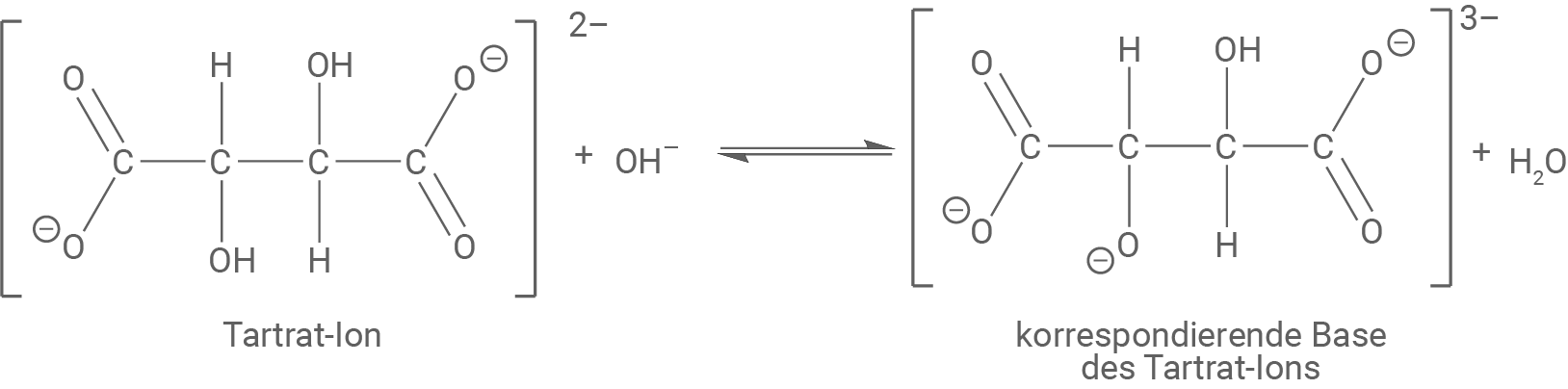
Die korrespondierende Base des Tartrat-Ions kann mit Kupfer(II)-Ionen Komplexe bilden, Weinsäure-Moleküle und Tartrat-Ionen können dies nicht.
Material 3: Reaktionen von Kupfer(II)-sulfat-Lösung
Experiment:
Stelle die in der Tabelle beschriebenen Stoffgemische her.
Bei diesem Experiment bilden Kupfer(II)-Ionen Komplexe mit Wasser-Molekülen bzw. deprotonierten Tartrat-Ionen.
Material 4: Säuerung von Wein
In Abhängigkeit der klimatischen Bedingungen beim Weinanbau kann es sinnvoll sein, dem Wein während der Gärung ein Säuerungsmittel zuzusetzen. Dabei kommen in der Regel racemische Gemische von Äpfelsäure bzw. Milchsäure oder reine L-Weinsäure in Betracht. Je niedriger der pH-Wert eines Weins ist, umso stärker wird das Wachstum unerwünschter Mikroorganismen eingeschränkt.
Doch nicht nur der pH-Wert während der Gärung spielt eine Rolle für die Qualität des Weins, sondern ebenso der Gehalt an Kalium-Ionen. Liegen zu wenige Kalium-Ionen in einem Wein vor, so hat dies negative Auswirkungen auf den Geschmack des Getränks.
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Wasserstoffperoxid
Beschreibung der Bindungen im Wasserstoffperoxid-Molekül
Es gibt ein bindendes Elektronenpaar zwischen den Sauerstoff-Atomen, welche jeweils die gleichen Elektronegativitätswerte besitzen. Diese Elektronenpaarbindung ist also unpolar.
Zusätzlich gibt es bindende Elektronenpaare zwischen den Sauerstoff- und Wasserstoff-Atomen, wobei es sich hier aufgrund unterschiedlicher Elektronegativitätswerte um polare Elektronenpaarbindungen handelt.
Erklärung der Wasserlöslichkeit von Wasserstoffperoxid
Wasser- und Wasserstoffperoxid-Moleküle sind polare Moleküle. Es kommt zur Ausbildung von Wasserstoffbrücken zwischen positiv polarisierten Wasserstoff-Atomen und freien Elektronenpaaren der Sauerstoff-Atome eines anderen Moleküls.
Nach dem Prinzip „Ähnliches löst Ähnliches“ ist Wasserstoffperoxid somit gut in Wasser löslich.
Erklärung der Disproportionierung
Der Zerfall von Wasserstoffperoxid-Molekülen lässt sich mit folgender Reaktionsgleichung beschreiben:
Die Oxidationszahl beim Sauerstoff-Atom des Wasserstoffperoxid-Moleküls erhöht sich von –I zu 0 (Sauerstoff-Molekül) bzw. verringert sich zu –II (Wasser-Molekül)
Begründung des exergonischen Verlaufs
Der Zerfall von Wasserstoffperoxid ist exotherm, d. h. < 0
Außerdem kommt es zu einer Zunahme der Anzahl gasförmiger Teilchen beim Zerfall, d. h. > 0
Mit < 0 und
> gilt nach
unabhängig der Temperatur:
< 0
< 0 bedeutet einen exergonischen Verlauf.
Formulierung der Teilgleichungen
Erläuterung des Donator-Akzeptor-Prinzips
Wasserstoffperoxid-Moleküle sind Elektronendonatoren. Die Sauerstoff-Atome im Wasserstoffperoxid-Molekül geben jeweils ein Elektron ab.
Permanganat-Ionen sind Elektronenakzeptoren. Die Mangan-Teilchen des Permanganat-Ions nehmen jeweils fünf Elektronen auf.
Es findet also ein Elektronenübergang vom Wasserstoffperoxid-Molekül zum Permanganat-Ion statt.
Begründung zur Äquivalenzpunktbestimmung
Eine Lösung mit Permanganat-Ionen ist violett. Bei der Titration werden diese zu Mangan(II)-Ionen reduziert. Lösungen mit Mangan(II)-Ionen sehen schwach rosa/farblos aus.
Der Äquivalenzpunkt ist erreicht, wenn alle Wasserstoffperoxid-Moleküle oxidiert wurden. Bei weiterer Zugabe von Permanganat-Ionen werden diese nicht mehr zu Mangan(II)-Ionen reduziert.
Es tritt ein Farbumschlag von schwach rosa nach violett auf. Kein Indikator ist notwendig.
Beurteilen der Vorschrift
Für pH = 0 ; 25 °C und 101,325 kPa gilt: <
<
Wasserstoffperoxid-Moleküle und Chlorid-Ionen werden durch Permanganat-Ionen oxidiert. <
<
Wasserstoffperoxid-Moleküle werden durch Permanganat-Ionen oxidiert; es kommt aber zu keiner Oxidation von Sulfat-Ionen.
Bei Verwendung von Salzsäure werden zusätzlich Chlorid-Ionen oxidiert. Dies führt zur Verfälschung des Analysenergebnisses durch höheren Verbrauch an Maßlösung.
Bei Verwendung von Schwefelsäure-Lösung findet keine zusätzliche Oxidation statt, es kommt somit zu keinem Mehrverbrauch an Maßlösung.
Der gegebene Hinweis ist für eine genaue Analyse zu beachten.
Durchführung des Experiments
Bewertet wird eine fachgerechte Durchführung (siehe Beobachtungsbogen) inklusive Angabe der Messwerte. Ein beispielhafter Beobachtungsbogen könnte wie folgt aussehen:
Beobachtungen:
- Die Lösung war vor der Titration farblos.
- Bei Zugabe von KMnO₄ zeigte sich jeweils eine kurzzeitig violette Farbe, die sofort verschwand.
- Nach Erreichen des Äquivalenzpunkts blieb eine dauerhafte hellrosa Färbung bestehen.
- Kein Indikator notwendig, da KMnO₄ als Selbstindikator wirkt.
- Mittelwert: 10,0 mL
Überprüfung der Angabe des Herstellers
Berechnung des Mittelwerts aus beiden Titrationen.
Verhältnisgleichung:
Berechnung des Massenanteils:
Massenanteil unter Beachtung der Verdünnung:
Der Wasserstoffperoxid-Gehalt der untersuchten Desinfektionslösung entspricht nicht mehr den Angaben des Herstellers.
Weinsäure
Erklärung Enantiomere
Enantiomere sind isomere Teilchen, die zueinander wie Bild und Spiegelbild vorliegen und weder durch Drehung noch durch Verschiebung zur Deckung zu bringen sind.
Strukturformel der Weinsäure:
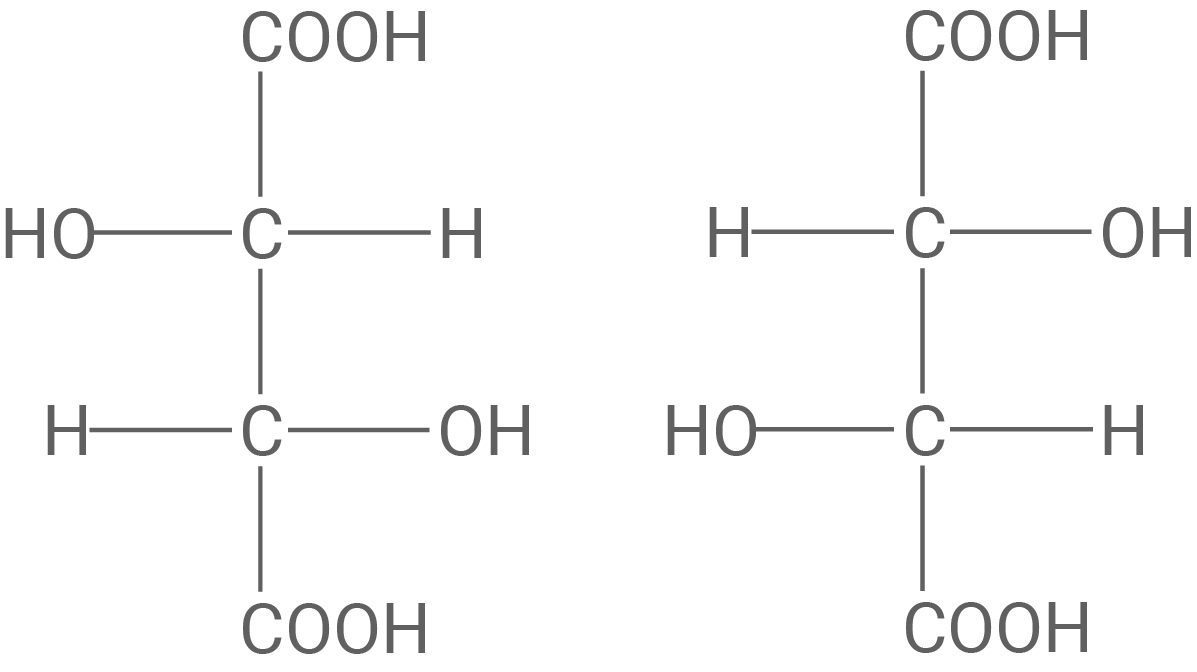
Die Hydroxy-Gruppen an den asymmetrischen Kohlenstoff-Atomen müssen unterschiedlicher Orientierung sein.
Kennzeichnung asymmetrischer Kohlenstoff-Atome:
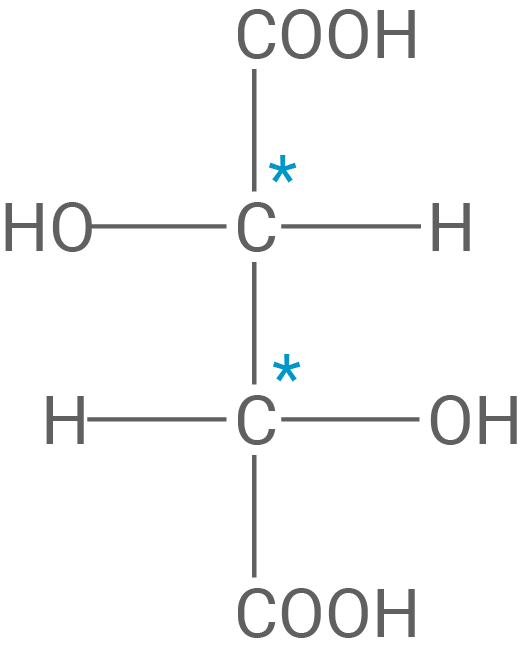
Angabe des systematischen Namens:
Dihydroxybutandisäure
Formulierung der Reaktionsgleichung (Reaktion 1)
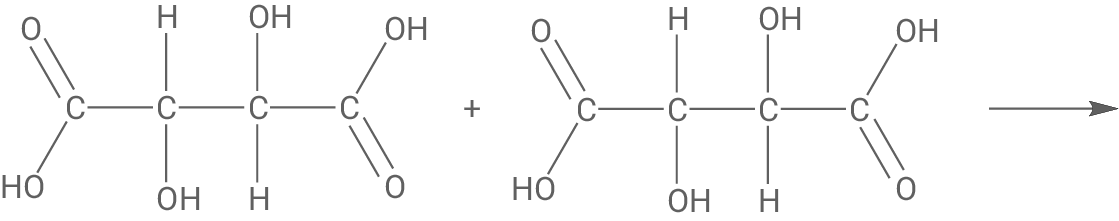
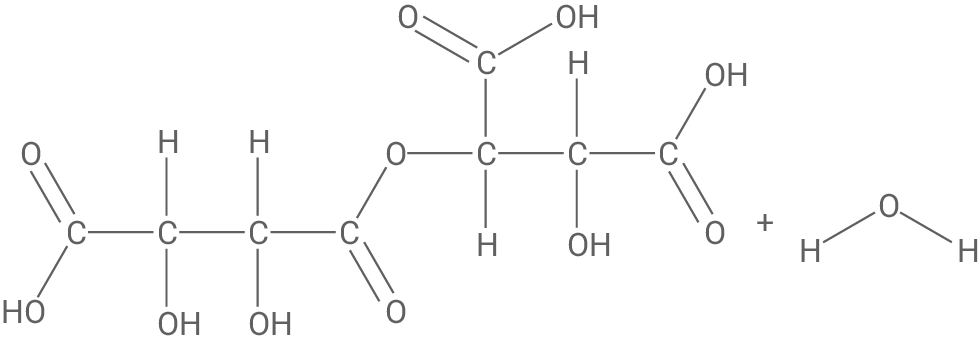
Ableitung der Reaktionsart (Reaktion 2)
Da es zu einer Abspaltung von Wasserstoff-Atomen und einer Umwandlung einer C-C-Einfachbindung in eine Doppelbindung kommt, handelt es sich um eine Eliminierung.
Beschreibung der Möglichkeit zur Unterscheidung
Nachweismittel: Bromwasser
Durchführung: Zugabe des Nachweismittels
Beobachtung: Entfärbung einer der Lösungen
Die Lösung mit dem Endiol entfärbt sich, da Brom elektrophil an die C=C-Doppelbindung des Endiols addieren kann. Dabei wird Brom verbraucht, wodurch dessen Konzentration in der Lösung sinkt und die charakteristische gelb-bräunliche Farbe verschwindet.
Weinsäure hingegen besitzt keine C=C-Doppelbindung, daher bleibt das Brom in Lösung erhalten und die Lösung entfärbt sich nicht.
Benennung der Bindungen
Weinsäure: -
-σ-Bindung
Endiol: -
-σ-Bindung und p-p-π-Bindung
Teil der Bewertung ist die Durchführung des Experiments.
Durchführung:
Zur Untersuchung der Komplexbildung von Weinsäure mit Kupfer(II)-Ionen wurden gemäß Tab. 1 vier Reagenzgläser mit den angegebenen Reagenzien befüllt:
- In jedes Reagenzglas wurden 1 mL Kupfer(II)-sulfat-Lösung und 1 mL Natronlauge gegeben.
- In Reagenzglas 3 und 4 wurde zusätzlich je eine Spatelspitze Kalium-Natrium-Tartrat (Reagenzglas 3) bzw. Weinsäure (Reagenzglas 4) zugegeben.
- Die Lösungen wurden gut geschüttelt und auf sichtbare Veränderungen hin beobachtet.
Ableitung der Komplexstabilitäten
Beobachtungen:
Reagenzglas 1: hellblaue Lösung
Reagenzglas 2: blauer Niederschlag bei Zugabe von Natronlauge zu Kupfer(II)-sulfat-Lösung
Reagenzglas 3: blauer Niederschlag bei Zugabe von Natronlauge zu Kupfer(II)-sulfat-Lösung, Auflösung des Niederschlags nach Zugabe von Tartrat-Ionen; dunkelblaue Lösung
Schlussfolgerung
Kupfer(II)-Ionen sind gegenüber Hydroxid-Ionen nach Zugabe von Tartrat-Ion maskiert.
Bezüglich der Komplexstabilitäten ist der Aqua-Komplex instabiler.
Erklärung der pH-Wert-Abhängigkeit
Beobachtungen:
Reagenzglas 3: dunkelblaue Lösung
Reagenzglas 4: hellblaue Lösung
Erklärung:
Bei niedrigen pH-Werten liegt die korrespondierende Base des Tartrat-Ions nicht mehr in ausreichender Konzentration vor.
Es kommt zu keiner Komplexbildung in Reagenzglas 4.
Erläuterung der Beobachtung in Reagenzglas 2
Es kommt zur Bildung von in Wasser schwerlöslichem Kupfer(II)-hydroxid.
Ordnung nach sinkendem pH-Wert der jeweiligen Lösung
Butansäure, 4-Hydroxybutansäure, Weinsäure
Begründung der Einordnung
Je näher die Hydroxy-Gruppe an der Carboxy-Gruppe ist, umso stärker ist der -I-Effekt.
Je stärker der -I-Effekt, desto leichter spalten sich Protonen aus der Carboxy-Gruppe ab.
Bei Butansäure gibt es keinen -I-Effekt durch Atome außerhalb der Carboxy-Gruppe.
Bei 4-Hydroxybutansäure gibt es einen -I-Effekt durch die Hydroxy-Gruppe am 4. C-Atom.
Bei der Weinsäure gibt es einen -I-Effekt durch Hydroxy-Gruppen am 2. und 3. C-Atom.
Beurteilung zur Eignung als Säuerungsmittel
L-Weinsäure senkt den pH-Wert am stärksten, reduziert aber gleichzeitig deutlich die Kalium-Ionen-Konzentration, was den Geschmack beeinträchtigen kann.
D/L-Apfelsäure senkt den pH-Wert moderat, erhält den Kaliumgehalt weitgehend und ist am günstigsten; insgesamt die ausgewogenste Wahl.
D/L-Milchsäure senkt den pH-Wert stärker als Apfelsäure und erhöht die Kalium-Ionen-Konzentration leicht, ist aber im Durchschnitt fast doppelt so teuer.