Aufgabe 2 – Luftschadstoffe
Bei der Verbrennung fossiler Energieträger entstehen Abgase, die u. a. Kohlenstoffdioxid, Schwefel- und Stickstoffoxide enthalten. Diese Emissionen werden seit vielen Jahren reduziert.
Erkläre mithilfe der Elektronenkonfiguration die Stabilität der Oxidationsstufen der Schwefel-Atome in zwei der folgenden Teilchen: Schwefelwasserstoff-, Schwefeldioxid- und Schwefelsäure-Molekül.
Erläutere das Donator-Akzeptor-Konzept an der Reaktion von Schwefelwasserstoff mit Wasser und der Bildung von Schwefeldioxid aus den Elementen. Beziehe in Deinen Ausführungen Reaktionsgleichungen ein.
Gib den wesentlichen Unterschied der beiden Reaktionsarten an.
Berechne den prozentualen Anteil an Schwefeldioxid, der zu schwefliger Säure reagiert hat, wenn eine gesättigte Lösung den pH-Wert von aufweist (M 1). Gehe bei deiner Berechnung von der ersten Protolysestufe aus. Nutze das Massenwirkungsgesetz.
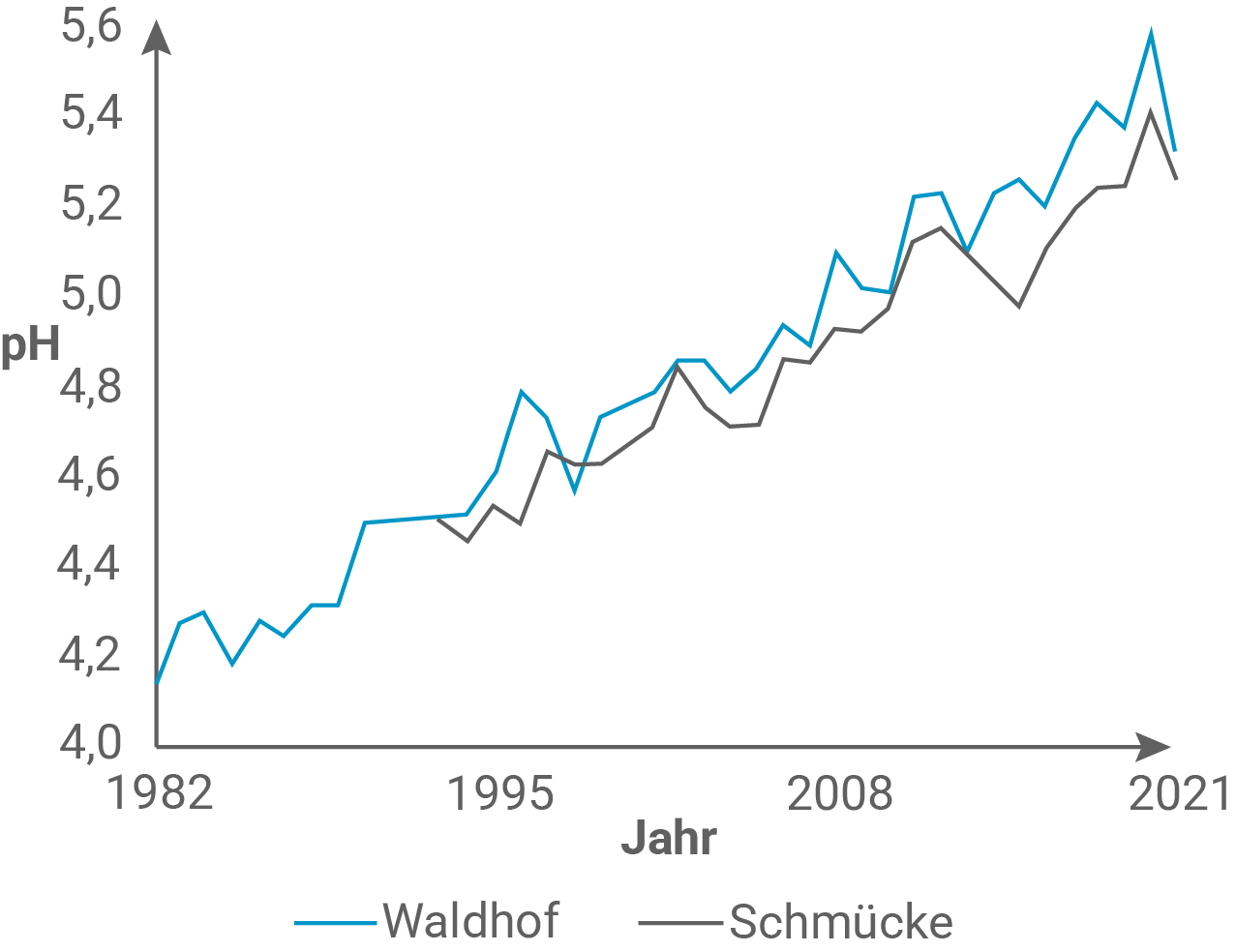
Erläutere den Trend der Veränderungen in Abbildung 1 unter Beachtung des Kalkwaschverfahrens (M 2, M 3).
Formuliere die Reaktionsgleichungen für dieses Verfahren (M 3).
Bewerte die Auswirkungen des geplanten Kohleausstiegs auf die Produktion von Gips (M 4).
Beurteile die Eignung von zwei Düngemittelbestandteilen, um einer Bodenversauerung entgegen zu wirken (M 5).
Material 1: Schweflige Säure
Schwefeldioxid ist ein Gas, welches schon in geringsten Mengen Vergiftungserscheinungen hervorruft. Bei 20 °C und Normaldruck lösen sich in einem Liter Wasser maximal 112,7 g Schwefeldioxid.
Die farblose, stechend nach Schwefeldioxid riechende Lösung reagiert sauer und ist Bestandteil des sauren Regens, der als Ursache für das Waldsterben in Europa galt.
Die Moleküle der schwefligen Säure sind starke Säuren. Im ersten Protolyseschritt entstehen Hydrogensulfit-Ionen.
Material 2: Saurer Regen
Als saurer Regen werden Niederschläge bezeichnet, die einen pH-Wert kleiner als 5,5 haben. Der saure Regen entsteht hauptsächlich durch Luftverschmutzung. Dabei reagieren Luftschadstoffe (Kohlenstoffdioxid, Stickoxide oder Schwefeloxide) mit dem Wasser in der Luft, wodurch saure Lösungen entstehen. Dieser Prozess senkt den pH-Wert des Regenwassers. In den Messstationen des Umweltbundesamts Waldhof (Niedersachsen, seit 1982) und Schmücke (Thüringen, seit 1993) werden die Konzentrationen saurer und säurebildender Regeninhaltsstoffe gemessen. In Mitteleuropa befinden sich die pH-Werte heute im Bereich der natürlichen, ohne menschliche Beeinflussung zu erwartenden Werte.
Material 3: Rauchgasentschwefelung
Zur Verhinderung von Schwefeldioxidemissionen sind mehrere Verfahren in der Umwelttechnologie gebräuchlich.
Beim Kalkwaschverfahren wird über Sprühebenen eine wässrige Kalk-Lösung (Calciumhydroxid-Lösung) in die Rauchgase eingebracht. Das dabei entstehende Calciumsulfat ist auch als Gips bekannt und kann weiterverwertet werden. Als Zwischenprodukt entsteht dabei Calciumsulfit

Material 4: Gips
Der Kohleausstieg in Deutschland nimmt Fahrt auf. Viele Steinkohle-Kraftwerke sind seit 2021 nicht mehr am Netz. Ein Nebeneffekt des Ausstiegs ist, dass Gips als Baustoff knapp werden könnte. Dies wurde bisher kaum diskutiert.
Gips fällt als Nebenprodukt z. B. bei der Stromproduktion aus Kohle an. Nach Alternativen wird händeringend gesucht. Die Industrie fordert daher den verstärkten Abbau von Naturgips. Umweltschützer warnen davor.
Rund zehn Millionen Tonnen Gips werden jährlich in Deutschland im Bausektor eingesetzt – in Putz und Estrich, in Form von Gipskartonplatten und -bauteilen. Bisher stammt der Gips jeweils etwa zur Hälfte aus der Rauchgasentschwefelung und aus dem Abbau von Naturgips. Gips fällt in den Kraftwerken seit den 1980er Jahren mit der Installation von Anlagen zur Rauchgasentschwefelung an. Saurer Regen, der das Waldsterben verursachte, sollte so zurückgedrängt werden. Der anfallende Gips wird von der Baustoffindustrie als Rohstoff gerne abgenommen. In den neuen Bundesländern wurden die Schwefelfilter in den Kraftwerken nach 1990 eingeführt.
Material 5: Bodenkalkung - Düngemittel
Um einer Bodenversauerung durch z. B. sauren Regen entgegenzuwirken, werden u. a. Düngemittel eingesetzt. Düngemittel sind Stoffgemische, die z. B. Ammoniumnitrat, Calciumcarbonat oder Kaliumsulfat enthalten können.
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Erklärung Oxidationsstufen
Elektronenkonfiguration
Erklärung der Stabilität der Schwefel-Atome anhand zweier Teilchen
Die Oxidationsstufe des Schwefel-Atoms in beträgt +IV. Durch Abgabe von vier Valenzelektronen wird ein vollbesetztes 3s-Unterniveau erreicht.
Die Oxidationsstufe des Schwefel-Atoms in beträgt +VI. Durch Abgabe aller sechs Valenzelektronen wird Edelgaskonfiguration erreicht.
Die Oxidationsstufe des Schwefel-Atoms in beträgt -II. Durch Aufnahme zweier Valenzelektronen wird auch hier Edelgaskonfiguration erreicht.
Teilchen sind besonders stabil, wenn das energetisch höchstbesetzte Unterniveau voll besetzt ist.
Erläuterung des Donator-Akzeptor-Konzepts
Säure-Base-Reaktion:
Protonendonator:
Protonenakzeptor:
Es kommt zu einem Protonenübergang.
Redoxreaktion:
Elektronendonator:
Elektronenakzeptor:
Es kommt zu einem Elektronenübergang.
Der wesentliche Unterschied beider Reaktionen liegt in der Art des übertragenen Teilchens. Bei der Säure-Base-Reaktion handelt es sich um eine Protonenübertragungsreaktion, bei der Redoxreaktion um eine Elektronenübertragungsreaktion.
Berechnung des Anteils an umgesetztem Schwefeldioxid
Erläutern des Trends des pH-Werts
Der pH-Wert steigt im Messzeitraum. Durch Rauchgasentschwefelung, wie in M2 beschrieben, gelangt Schwefeldioxid nämlich nicht in die Atmosphäre. Es folgt ein Ausbleiben der Bildung schwefliger Säure. So bilden sich auch keine Oxonium-Ionen und schlussendlich steigt der pH-Wert.
Formulieren der Reaktionsgleichungen
Bewerten der Auswirkungen des geplanten Kohleausstiegs
Mit dem Ende der Kohleverbrennung geht ein Ende der Gipsproduktion aus der Rauchgasentschwefelung einher. Gips wird jedoch weiterhin als Baustoff benötigt und somit wird eine Erschließung neuer Quellen, z. B. durch Bergbau, notwendig.
Ökologisch gesehen stellt der Kohleausstieg und die Umlagerung auf erneuerbare Energien eine immense Entlastung dar. Es wird jedoch auch klar, dass die Nachhaltigkeit dieser Entscheidung vielseitig ist: Der Abbau natürlicher Gipsquellen ist ökologisch nämlich auch bedenklich.
Dies verdeutlicht die Wichtigkeit der Forschung an neuen Baustoffen. Daher zeigt sich: Nur wenn der Strukturwandel von Beginn an ganzheitlich gedacht und mit innovativen Alternativen begleitet wird, kann er langfristig als ökologisch und gesellschaftlich verantwortungsvoll bewertet werden.
Beurteilung der Düngemittel
Ammoniumnitrat
Durch Protolyse der Ammonium-Ionen kommt es zur Bildung von Oxonium-Ionen. Es kommt zum Absinken des pH-Werts. Die Nitrat-Ionen haben keinen Einfluss auf den pH-Wert.
Calciumcarbonat
Durch Reaktion von Carbonat-Ionen mit Oxonium-Ionen im Boden kommt es zur Anhebung des pH-Werts. Calcium-Ionen haben hierbei keinen Einfluss auf den pH-Wert.
Kaliumsulfat
Der Einfluss von Kalium und Sulfat auf den pH Wert ist jeweils vernachlässigbar. Sulfat ist das Säureanion der mittelstarken Säure Hydrogensulfat. Entsprechend ist Sulfat selbst gerade einmal eine mittelstarke korrespondierende Base. Im Düngemittel dient es überwiegend als Nährstoffzusatz für Pflanzen.
Ammoniumnitrat wirkt also bodenversauernd, während Calciumcarbonat den Boden neutralisiert; dies trägt zur Stabilisierung des pH-Werts bei. Kaliumsulfat hat keinen Beitrag zur pH-Wert Einstellung.
Hinweis: Zur Erreichung der vollen Punktzahl war es nur notwendig, zwei der Bestandteile zu erläutern.