Teil C – Experimente: Unbekannte Stoffe und Metalle
Hinweis: Von den nachfolgenden Aufgabenteilen C1 und C2 soll in der Prüfung nur einer bearbeitet werden.
Aufgabe C1
Bei der Analyse unbekannter Stoffe werden qualitative und quantitative Methoden angewendet.
1
Experiment A
Bestimme mit Hilfe einer Säure-Base-Titration die Stoffmengenkonzentration von Essigsäure (Ethansäure) im Haushaltsessig. Pipettiere dazu Haushaltsessig in einen Erlenmeyerkolben. Titriere mit einer unbekannten Hydroxidlösung der Stoffmengenkonzentration
Haushaltsessig in einen Erlenmeyerkolben. Titriere mit einer unbekannten Hydroxidlösung der Stoffmengenkonzentration  Verwende als Indikator Phenolphthaleinlösung.
Führe die Titration zweimal durch. Gib deine Messwerte an.
Verwende als Indikator Phenolphthaleinlösung.
Führe die Titration zweimal durch. Gib deine Messwerte an.
Bestimme mit Hilfe einer Säure-Base-Titration die Stoffmengenkonzentration von Essigsäure (Ethansäure) im Haushaltsessig. Pipettiere dazu
(03 BE)
2
Die Lösung des Reaktionsprodukts aus Experiment A wurde vollständig eingedampft und steht Ihnen als Feststoffprobe zur Verfügung.
Experiment B
Versetze zwei Spatel des im Experiment A erzeugten Feststoffs mit ca. destilliertem Wasser. Gib zu der Lösung drei Tropfen Perchlorsäure
destilliertem Wasser. Gib zu der Lösung drei Tropfen Perchlorsäure 
Versetze zum Vergleich je ca. Natriumacetat- und Kaliumacetatlösung mit drei Tropfen Perchlorsäure.
Führe das Experiment durch. Gib deine Beobachtungen an.
Natriumacetat- und Kaliumacetatlösung mit drei Tropfen Perchlorsäure.
Führe das Experiment durch. Gib deine Beobachtungen an.
Versetze zwei Spatel des im Experiment A erzeugten Feststoffs mit ca.
Versetze zum Vergleich je ca.
(03 BE)
3
Perchlorsäure bildet bei der Protolyse Perchlorat-Ionen.
3.1
Entwickle die Reaktionsgleichung für die Protolyse der Perchlorsäure.
(01 BE)
3.2
Leite aus deinen Beobachtungen in Experiment B die Zusammensetzung der Hydroxidlösung ab.
(02 BE)
3.3
Entwickle die Reaktionsgleichung für die Titration in Experiment A.
Berechne die Stoffmengenkonzentration der Essigsäure im Haushaltsessig.
Berechne die Stoffmengenkonzentration der Essigsäure im Haushaltsessig.
(03 BE)
4
Essigsäure kann z.B. durch die Reaktion von Acetaldehyd (Ethanal) mit Sauerstoff oder durch die Reaktion von Ethanol mit Sauerstoff gewonnen werden.
Entwickle für beide Herstellungsverfahren die Reaktionsgleichungen.
Benenne die funktionelle Gruppe im Essigsäure-Molekül.
Benenne die funktionelle Gruppe im Essigsäure-Molekül.
(03 BE)
(15 BE)
Aufgabe C2
Die Reaktionen von Metallen und ihren Verbindungen finden in der Technik vielfältige Anwendungen.
1
Experiment A
Erhitze eine erbsengroße Stoffportion des vorgegebenen Reaktionsgemischs aus Kupfer -oxidpulver und einem Überschuss an Zinkpulver kräftig in einem Reagenzglas.
Experiment B
-oxidpulver und einem Überschuss an Zinkpulver kräftig in einem Reagenzglas.
Experiment B
Versetze das abgekühlte Reaktionsgemisch aus Experiment A vorsichtig mit ca. Salzsäure.
Salzsäure.
Erhitze eine erbsengroße Stoffportion des vorgegebenen Reaktionsgemischs aus Kupfer
Versetze das abgekühlte Reaktionsgemisch aus Experiment A vorsichtig mit ca.
1.1
Führe die Experimente durch. Gib deine Beobachtungen an.
(03 BE)
1.2
Erläutere jeweils eine Stoffumwandlung aus Experiment A und B.
(04 BE)
2
Metalle mit niedrigerem Standardelektrodenpotenzial fällen Metalle mit höherem Standardelektrodenpotenzial aus ihren Salzlösungen aus. Dagegen fällen Metalle mit höherem Standardelektrodenpotenzial Metalle mit niedrigerem Standardelektroden- potenzial nicht aus ihren Salzlösungen aus.
Belegen Sie diese Aussagen mithilfe von zwei Experimenten.
2.1
Experiment C
Plane dein Vorgehen.
Es stehen dir folgende Geräte und Chemikalien zur Verfügung:
Uhrglasschalen, Zink -sulfat, Kupfer
-sulfat, Kupfer -sulfat- und Silber
-sulfat- und Silber -nitratlösung jeweils mit der Stoffmengenkonzentration
-nitratlösung jeweils mit der Stoffmengenkonzentration 
Fordere weitere Stoffe an.
Plane dein Vorgehen.
Es stehen dir folgende Geräte und Chemikalien zur Verfügung:
Uhrglasschalen, Zink
Fordere weitere Stoffe an.
(03 BE)
2.2
Führe die geplanten Experimente durch. Gib deine Beobachtungen an.
(02 BE)
2.3
Erläutere deine Beobachtungen unter Verwendung der Standardelektrodenpotenziale.
(03 BE)
(15 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Lösung C1
1
Experiment A
| Durchführung: | Säure-Base-Titration von |
| Beobachtungen: | Die Maßlösung ( |
2
Beobachtungen in Experiment B
| Versetzung des Acetats aus der Titration mit Perchlorsäure: | Bildung eines weißen Niederschlags |
| Versetzung von Natriumacetat mit Perchlorsäure: | Keine Veränderung |
| Versetzung von Kaliumacetat mit Perchlorsäure: | Bildung eines weißen Niederschlags |
3.1
Reaktionsgleichung für die Protolyse von Perchlorsäure



3.2
Zusammensetzung der Hydroxidlösung
- Die Versetzung der Maßlösung mit Perchlorsäure zeigt die Bildung eines weißen Niederschlags.
- Da diese Niederschlagsbildung nur bei Kaliumacetat und nicht bei Natriumacetat vorkommt, muss es sich bei der Maßlösung um Kaliumacetat handeln.
- Das bedeutet, es wurde das Salz Kaliumacetat gebildet.
3.3
Reaktionsgleichung für die Titration
Berechnung der Stoffmengenkonzentration der Essigsäure
Die Stoffmengenkonzentration von Essigsäure kann aus der verbrauchten Maßlösung berechnet werden:


 Dabei gilt:
Dabei gilt:

 und
und 


![\(\begin{array}[t]{rll}
c(HAc) &=& \dfrac{V(KOH) \cdot c(KOH)}{V(HAc)} & \\[5pt]
&=& \dfrac{8,7\,\text{mL} \cdot 1 \,\text{mol} \cdot \text{L}^{-1}}{10\,\text{mL}} & \\[5pt]
&=& 0,87 \,\text{mol} \cdot \text{L}^{-1}
\end{array}\)](https://www.schullv.de/api/node/mathjax-to-svg/9a8b3760fb214bd6e8e6c3596e072aaec7020b729eda972a29456ba604f6cddf?mode=light) In Haushaltsessig ist eine Stoffmengenkonzentration von
In Haushaltsessig ist eine Stoffmengenkonzentration von  enthalten, wenn
enthalten, wenn  an Maßlösung verbraucht werden.
an Maßlösung verbraucht werden.
4
Reaktionsgleichungen für die Herstellungsverfahren

- Acetaldehyd (Ethanal) mit Sauerstoff:
- Ethanol mit Sauerstoff:
Lösung C2
1.1
Experiment A
Experiment B
| Beobachtung: |
|
| Beobachtung: |
|
1.2
Stoffumwandlungen
- Kupfer
-oxid und Zink reagieren zu Kupfer und Zinkoxid:
- Bei der Reaktion von Zink und Salzsäure werden Zink-Ionen und Wasserstoff gebildet:
2.1
Experiment C
Anforderung: Kupfer-, Zink- und Silberblech (jeweils mind. 2) Anordnungs– bzw. Durchführungsmöglichkeiten des Versuchs:
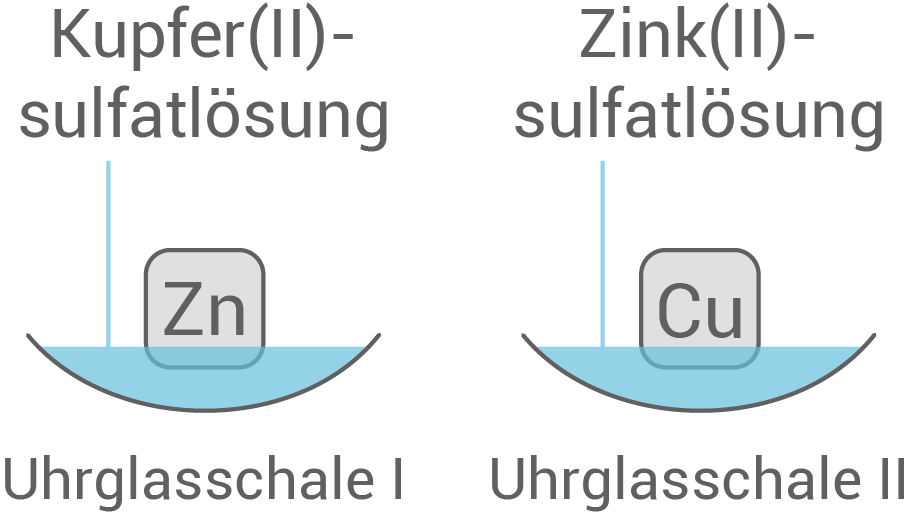
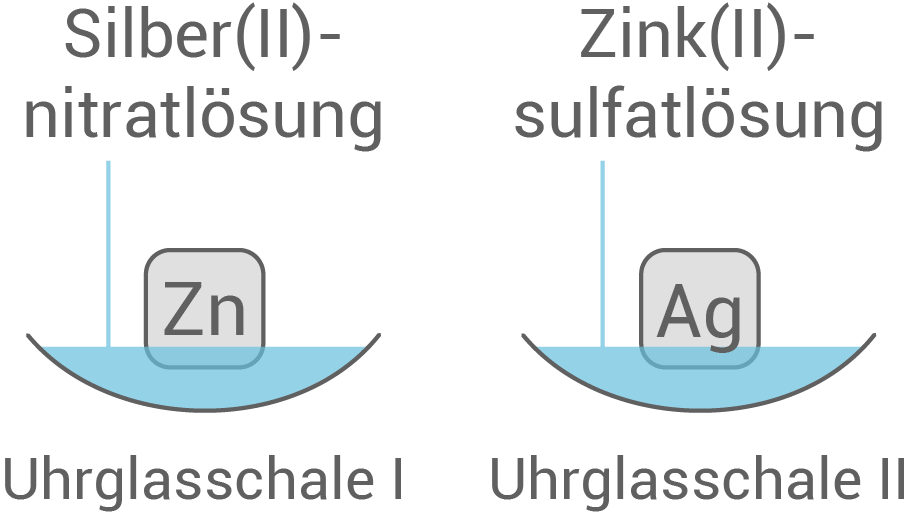
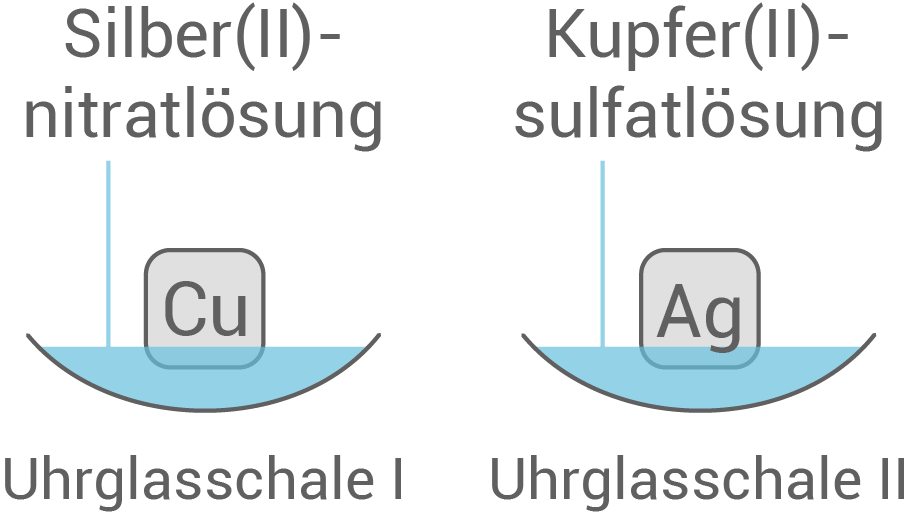
Anforderung: Kupfer-, Zink- und Silberblech (jeweils mind. 2) Anordnungs– bzw. Durchführungsmöglichkeiten des Versuchs:
a)

| Uhrglasschale I: | Zinkblech in einer Kupfer |
| Uhrglasschale II: | Kupferblech in einer Zink |
b)

| Uhrglasschale I: | Zinkblech in einer Silber |
| Uhrglasschale II: | Silberblech in einer Zink |
c)

| Uhrglasschale I: | Kupferblech in einer Silber |
| Uhrglasschale II: | Silberblech in einer Kupfer |
2.2
Beobachtungen
a)
| Uhrglasschale I: | rotbrauner Belag auf dem Zinkblech |
| Uhrglasschale II: | keine Reaktion |
b)
| Uhrglasschale I: | schwarzer Belag auf dem Zinkblech |
| Uhrglasschale II: | keine Reaktion |
c)
| Uhrglasschale I | schwarzer Belag auf dem Kupferblech |
| Uhrglasschale II | keine Reaktion |
2.3
Erläuterung der Beobachtungen in Experiment C
a)
| Uhrglas- schale I: |
|
| Uhrglas- schale II: |
b)
| Uhrglas- schale I: |
|
| Uhrglas- schale II: |
c)
| Uhrglas- schale I: |
|
| Uhrglas- schale II: |