Teil C – Experimente: Oxalsäure und Spüler-Tabs
Hinweis: Von den nachfolgenden Aufgabenteilen C1 und C2 soll in der Prüfung nur einer bearbeitet werden.



Aufgabe C1
In der Chemie unterscheidet man verschiedenen Reaktionsarten. Die Reaktion von Oxalsäure mit Wasser ist eine Säure-Base-Reaktion.
1
Experiment A
Versetze ca. einer Oxalsäurelösung mit ca.
einer Oxalsäurelösung mit ca.  Calciumchloridlösung.
Experiment B
Calciumchloridlösung.
Experiment B
Gib zu ca. Oxalsäurelösung
Oxalsäurelösung  Schwefelsäure und versetze dieses Gemisch anschließend mit zwei Tropfen Kaliumpermanganatlösung.
Führe die Experimente durch. Gib deine Beobachtungen nach einigen Minuten an.
Schwefelsäure und versetze dieses Gemisch anschließend mit zwei Tropfen Kaliumpermanganatlösung.
Führe die Experimente durch. Gib deine Beobachtungen nach einigen Minuten an.
Leite aus deinen Beobachtungen die jeweils vorliegende Reaktionsart ab.
Versetze ca.
Gib zu ca.
Leite aus deinen Beobachtungen die jeweils vorliegende Reaktionsart ab.
(05 BE)
2
Entwickle die Reaktionsgleichungen in Ionenschreibweise für die in Aufgabe 1 abgelaufenen Reaktionen. Gehe bei Experiment B von den Teilgleichungen aus.
Bei Experiment B entsteht unter anderem Kohlenstoffdioxid.
Bei Experiment B entsteht unter anderem Kohlenstoffdioxid.
(04 BE)
3
Der zeitliche Verlauf chemischer Reaktionen kann beeinflusst werden.
3.1
Experiment C
Versetze Oxalsäurelösung mit
Oxalsäurelösung mit  Schwefelsäure und teile das Gemisch auf zwei Reagenzgläser auf. Gib in ein Reagenzglas zusätzlich
Schwefelsäure und teile das Gemisch auf zwei Reagenzgläser auf. Gib in ein Reagenzglas zusätzlich  Mangan
Mangan -sulfatlösung.
-sulfatlösung.
Füge anschließend in beide Reagenzgläser je Kaliumpermanganatlösung hinzu.
Miss die Zeit bis zur vollständigen Entfärbung der Reaktionsgemische. Gib deine Messwerte an.
Kaliumpermanganatlösung hinzu.
Miss die Zeit bis zur vollständigen Entfärbung der Reaktionsgemische. Gib deine Messwerte an.
Versetze
Füge anschließend in beide Reagenzgläser je
(01 BE)
3.2
Nenne unter Berücksichtigung deiner Messwerte in Experiment C die Funktion des Mangan -sulfats.
-sulfats.
Erkläre den Einfluss solcher Stoffe auf den zeitlichen Verlauf einer exotherm ablaufenden Reaktion anhand eines Diagramms.
Erkläre den Einfluss solcher Stoffe auf den zeitlichen Verlauf einer exotherm ablaufenden Reaktion anhand eines Diagramms.
(04 BE)
3.3
Nenne eine weitere Reaktionsbedingung, die den zeitlichen Verlauf einer chemischen Reaktion beeinflusst.
(01 BE)
Aufgabe C2
Geschirrspülmittel für Maschinen in Form von Pulver gibt es seit 1929, die viel beliebteren Tabs sind seit 1999 auf dem Markt. Sie beinhalten ca. 30 bis 40 verschiedene Substanzen.
1
Untersuche einen Spüler-Tab auf einige seiner Inhaltsstoffe.
Experiment A
Gib in einem Becherglas zu der dir vorliegenden Menge eines Spüler-Tabs ca. heißes Wasser. Rühre um.
Experiment B
heißes Wasser. Rühre um.
Experiment B
Bestimme den pH-Wert der Lösung aus Experiment A. Gib dazu mit einem Glasstab einen Tropfen der Lösung auf einen Streifen Universalindikatorpapier. Experiment C
Führe mit der Lösung aus Experiment A die Flammenprobe durch. Experiment D
Versetze ca. Lösung aus Experiment A in einem Becherglas mit Salzsäure im Überschuss, ca.
Lösung aus Experiment A in einem Becherglas mit Salzsäure im Überschuss, ca.  Rühre um. Gib anschließend drei Tropfen Bariumchloridlösung zu.
Führe die Experimente durch. Gib deine Beobachtungen und den pH-Wert an.
Rühre um. Gib anschließend drei Tropfen Bariumchloridlösung zu.
Führe die Experimente durch. Gib deine Beobachtungen und den pH-Wert an.
Gib in einem Becherglas zu der dir vorliegenden Menge eines Spüler-Tabs ca.
Bestimme den pH-Wert der Lösung aus Experiment A. Gib dazu mit einem Glasstab einen Tropfen der Lösung auf einen Streifen Universalindikatorpapier. Experiment C
Führe mit der Lösung aus Experiment A die Flammenprobe durch. Experiment D
Versetze ca.
(06 BE)
2
Der pH-Wert der Lösung des Spüler-Tabs resultiert hauptsächlich aus der Protolyse von Carbonat-Ionen und der Dissoziation von Natriumhydroxid.
2.1
Entwickle für beide Reaktionen die Reaktionsgleichungen.
(02 BE)
2.2
Berechne die Stoffmengenkonzentration an Hydroxid-Ionen aus dem ermittelten pH-Wert in Experiment B.
(02 BE)
2.3
Gib das identifizierte Ion in Experiment C an.
(01 BE)
2.4
Erläutere die Beobachtungen in Experiment D.
(04 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Lösung C1
1
Experiment A
Experiment B
| Beobachtung: | weißer Niederschlag |
| Reaktionsart: | Fällungsreaktion |
| Beobachtung: | Entfärbung der Lösung (violett |
| Reaktionsart: | Redoxreaktion |
2
3.1
Experiment C
| Zeit bis zur Entfärbung [in Minuten] |
|
| Ohne Mangan |
|
| Mit Mangan |
3.2
Funktion des Mangan -sulfats
-sulfats
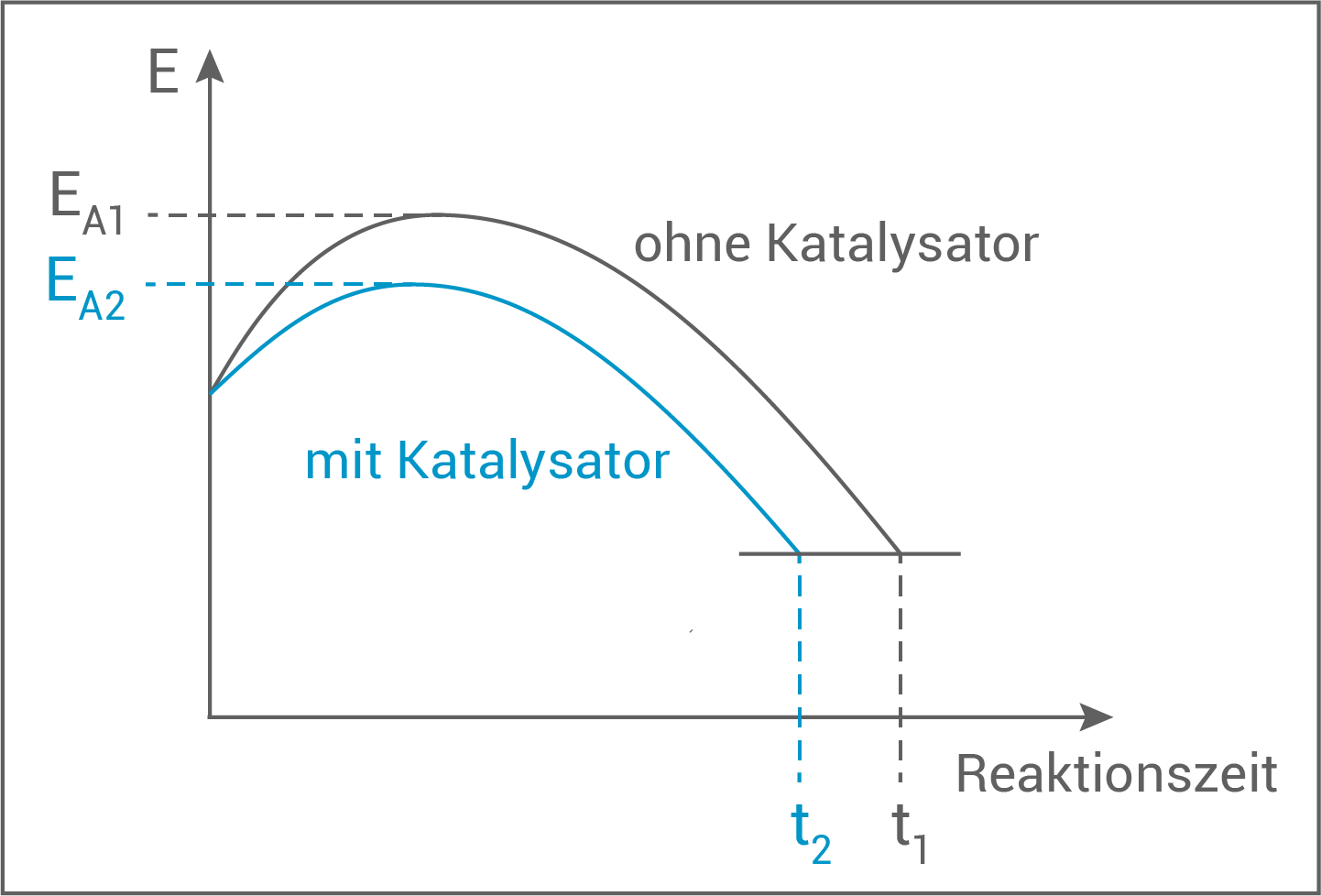
Das Diagramm veranschaulicht, dass die Reaktion mit Katalysator schneller abläuft und eine niedrigere Aktivierungsenergie  aufweist.
aufweist.
- Die Mangan
-sulfatlösung wird hier als Katalysator eingesetzt.
- Die Aktivierungsenergie
wird so herabgesetzt und die Reaktionsgeschwindigkeit erhöht.
- Ein Katalysator geht unverbraucht aus einer Reaktion hervor.

| Aktivierungsenergie ohne Katalysator | |
| Aktivierungsenergie mit Katalysator | |
| Reaktionszeit ohne Katalysator | |
| Reaktionszeit mit Katalysator |
3.3
Weitere Reaktionsbedingungen (nur eine gefordert)
- Temperatur: Durch die Erhöhung der Temperatur kann die Reaktionsgeschwindigkeit verdoppelt bis verdreifacht werden (RGT-Regel).
- Durchmischung bzw. Zerteilungsgrad der Ausgangsstoffe: Je besser die Ausgangsstoffe vermischt sind, desto schneller treffen sie aufeinander und reagieren.
- Einsatz von Inhibitoren: Ein Inhibitor kann eine Reaktion verlangsamen.
Lösung C2
1
Experiment A
Der Spüler-Tab löst sich praktisch vollständig auf. Experiment B
Die Lösung färbt das Universalindikatorpapier blau.
Der pH-Wert lässt sich auf festlegen.
Experiment C
festlegen.
Experiment C
Ein Magnesiumstäbchen wird in die Brennerflamme gehalten, nach dem Ausglühen kurz in die Lösung getaucht und anschließend wieder in die Brennerflamme gehalten.
Die Flamme erscheint intensiv gelb. Experiment D
Zugabe der Salzsäure: Das Gemisch schäumt auf und es entsteht ein Gas (farblos).
Zugabe der Bariumchlorid-Lösung: Es bildet sich ein weißer Niederschlag.
Der Spüler-Tab löst sich praktisch vollständig auf. Experiment B
Die Lösung färbt das Universalindikatorpapier blau.
Der pH-Wert lässt sich auf
Ein Magnesiumstäbchen wird in die Brennerflamme gehalten, nach dem Ausglühen kurz in die Lösung getaucht und anschließend wieder in die Brennerflamme gehalten.
Die Flamme erscheint intensiv gelb. Experiment D
Zugabe der Salzsäure: Das Gemisch schäumt auf und es entsteht ein Gas (farblos).
Zugabe der Bariumchlorid-Lösung: Es bildet sich ein weißer Niederschlag.
2.1
Reaktionsgleichungen
Protolyse von Carbonat-Ionen:


 Dissoziation von Natriumhydroxid:
Dissoziation von Natriumhydroxid:



2.2
Berechnung der Stoffmengenkonzentration an Hydroxid-Ionen
Basierend auf dem Ionenprodukt gilt für die Berechnung:
![\(\begin{array}[t]{rll}
c(H_3O^+) \cdot c(OH^-)&=& K_W & \\[5pt]
&=& 10^{-14} \,\text{mol}^2\cdot \text{L}^{-2} & \\[5pt]
pH + pOH &=& pK_W & \\[5pt]
&=& 14 &
\end{array}\)](https://www.schullv.de/resources/formulas/45ad612472f02382366d0a171f3a4ad60b643c0340979208c9d3ae1a8d8368fa_light.svg) Daraus ergibt sich:
Daraus ergibt sich:
![\(\begin{array}[t]{rll}
pOH &=& 14 - pH = 14 - 10 = 4 & \\[10pt]
c(OH^-)&=& 10^{-pOH} \,\text{mol}\cdot \text{L}^{-1} & \\[5pt]
&=& 10^{-4} \,\text{mol}\cdot \text{L}^{-1}
\end{array}\)](https://www.schullv.de/resources/formulas/ae6be7a422e86dea301c000d7241b1488d41b5e8c692ccf9a18bcde89b82f66a_light.svg) oder:
oder:
![\(\begin{array}[t]{rll}
c(H_3O^+) &=& 14^{-pH} \,\text{mol}\cdot \text{L}^{-1} & \\[5pt]
&=& 10^{10} \,\text{mol}\cdot \text{L}^{-1} & \\[5pt]
c(OH^-)&=& \dfrac{K_W}{c(H_3O^+)} & \\[5pt]
&=& \dfrac{10^{-14} \,\text{mol}^2\cdot \text{L}^{-2} }{10^{-10} \,\text{mol}\cdot \text{L}^{-1} }& \\[5pt]
&=& 10^{-4} \,\text{mol}\cdot \text{L}^{-1}
\end{array}\)](https://www.schullv.de/resources/formulas/033537db364d035d19dfcff93a7baba56abdf987010f7c6a89df49ad43bb87d7_light.svg)
2.3
Identifiziertes Ion in Experiment C
Die Flammenfärbung zeigte eine intensive gelbe Färbung, was auf Natrium-Ionen hindeutet.
2.4
Erläuterung der Beobachtungen in Experiment D
Zugabe der Salzsäure:


 Hier ist die Salzsäure die stärkere Säure und die Kohlensäure, die in Kohlenstoffdioxid und Wasser zerfällt, die schwächere Säure, wobei die Säurerest-Ionen
Hier ist die Salzsäure die stärkere Säure und die Kohlensäure, die in Kohlenstoffdioxid und Wasser zerfällt, die schwächere Säure, wobei die Säurerest-Ionen  an der Reaktion nicht beteiligt sind.
Zugabe der Bariumchlorid-Lösung:
an der Reaktion nicht beteiligt sind.
Zugabe der Bariumchlorid-Lösung:


 Durch die Vereinigung von Barium- und Sulfat-Ionen entstehen Kristalle des schwer wasserlöslichen Bariumsulfats, wobei weder die Chlorid-Ionen des Nachweismittels noch die Kationen im Spüler-Tab an der Reaktion beteiligt sind.
Durch die Vereinigung von Barium- und Sulfat-Ionen entstehen Kristalle des schwer wasserlöslichen Bariumsulfats, wobei weder die Chlorid-Ionen des Nachweismittels noch die Kationen im Spüler-Tab an der Reaktion beteiligt sind.