Aufgabe 1 – Farbenblindheit
Farbenblindheit
Bei kompletter Farbenblindheit (Achromatopsie) liegt eine mutationsbedingte Störung der Farbwahrnehmung vor, bei der nur Hell-Dunkel-Kontraste wahrgenommen werden können.
Mit Hilfe von gentherapeutischen Maßnahmen könnte eine Achromatopsie zukünftig behandelt werden.
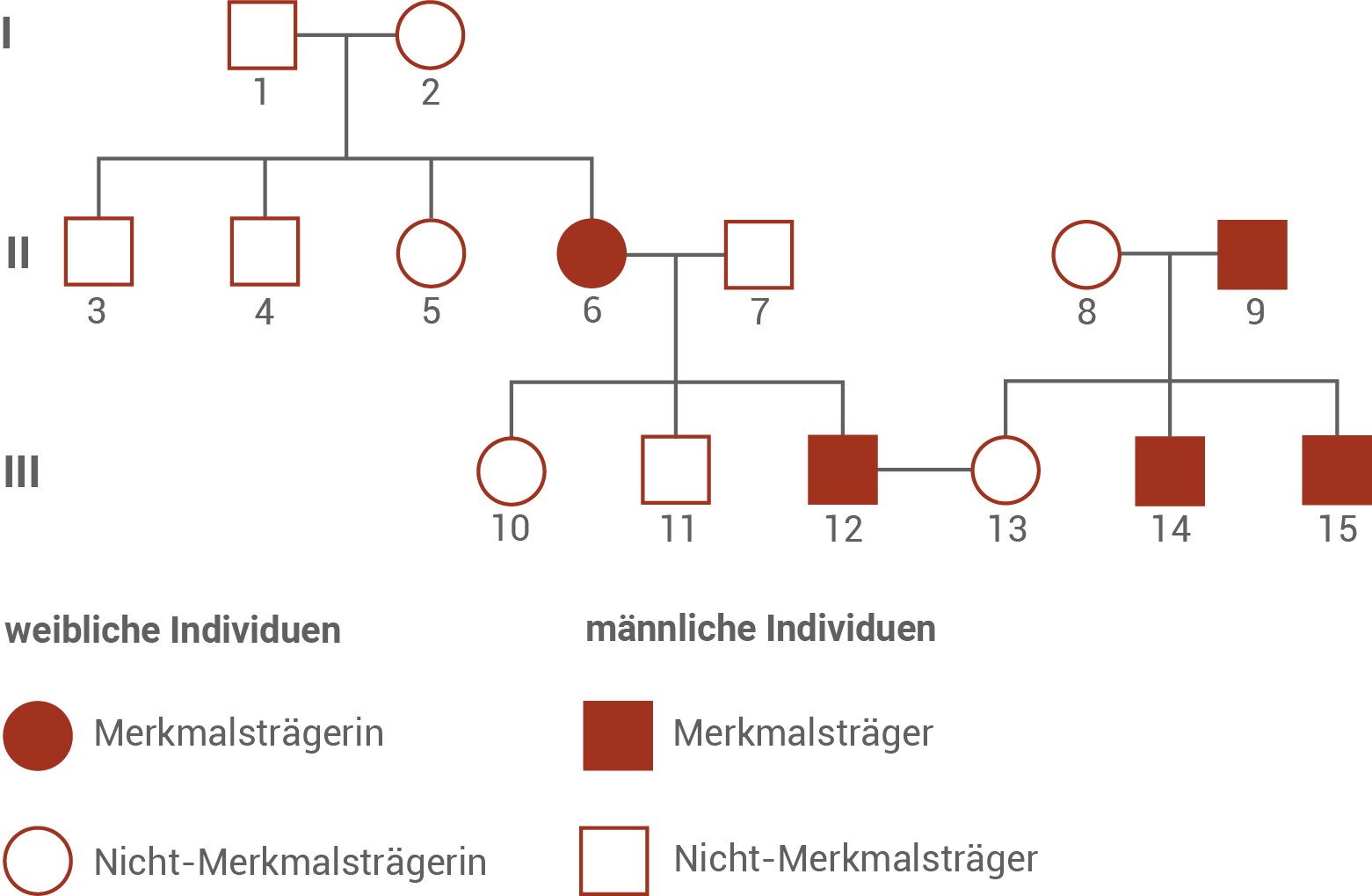
Leite aus dem Familienstammbaum die Art des Erbganges bei Achromatopsie ab (M 1).
Ermittle die Wahrscheinlichkeit, mit der ein Kind der Personen 12 und 13 von Achromatopsie betroffen sein wird (M 1).
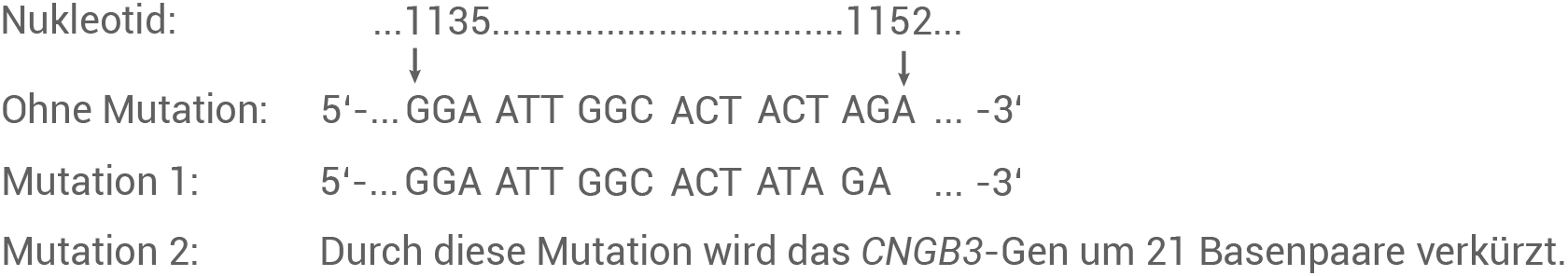
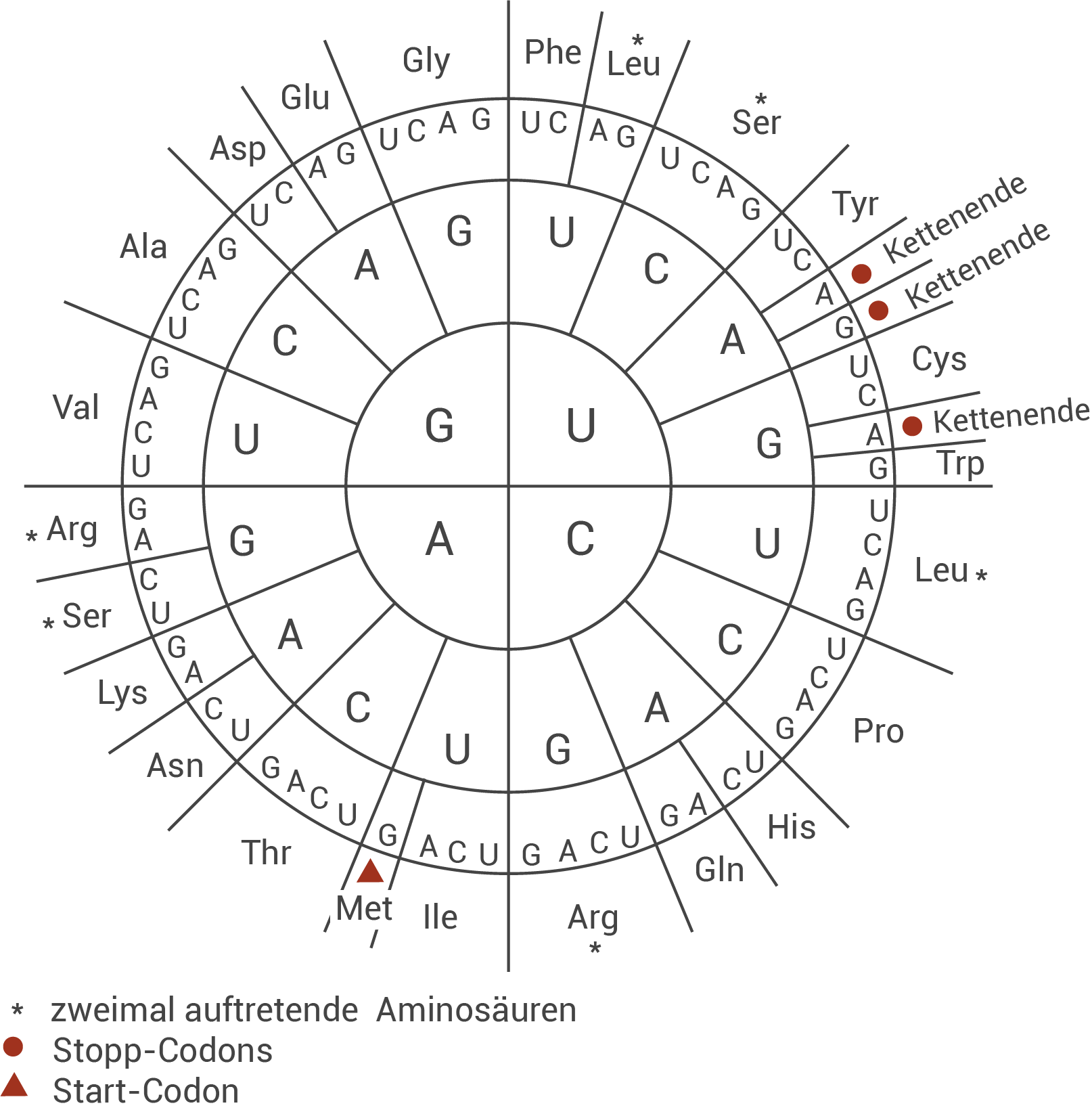
Ermittle jeweils die Aminosäuresequenzen der Genprodukte, die vom intakten und vom durch Mutation 1 betroffenen Genabschnitt codiert werden (M 2).
Leite die Auswirkung der Mutation 1 auf das Genprodukt ab (M 2).
Erkläre das Grundprinzip der Gelelektrophorese.
Leite aus den Untersuchungsergebnissen der Gelelektrophorese die Genotypen der drei untersuchten Personen ab und ordne jedem dieser drei Individuen eine mögliche Person aus dem Stammbaum zu (M 1, M 2, M 3).
Erläutere eine mögliche Auswirkung einer Spleißstellen-Mutation im CNGB3-Gen auf die Bildung und die Funktion des Genprodukts (M 4).
Begründe, warum Betroffene bereits im Kindesalter mit einer Gentherapie behandelt werden sollten (M 1, M 5).
Stelle den Entscheidungskonflikt beim Einsatz der gentherapeutischen Behandlung der Farbenblindheit mit je zwei Pro- und Contra-Argumenten dar (M 1, M 5).
Material M 1: Achromatopsie
Man unterscheidet zwei Arten von Lichtsinneszellen: Zapfen und Stäbchen.
Zapfen sind Lichtsinneszellen. Sie ermöglichen das Sehen bei hellem Licht (Tageslichtsehen) und sind für die Wahrnehmung von Farben nötig. Achromatopsie ist eine genetisch bedingte Netzhauterkrankung, bei der die Zapfen komplett funktionsuntüchtig sind. Dadurch leiden Betroffene unter totaler Farbenblindheit. Zapfen sind auch für das scharfe Sehen am Tage nötig. Daher sehen Achromaten nur ein nebliges Weiß/Grau, weshalb die Erkrankung auch Tagblindheit genannt wird. Im Laufe des Lebens betroffener Menschen kommt es zu einem fortschreitenden Verlust an Zapfen und damit verbundener Degeneration der Netzhaut.
Stäbchen sind ebenfalls Lichtsinneszellen, sie ermöglichen das Hell-Dunkel-Sehen. Sie sind die einzigen funktionsfähigen Lichtsinneszellen bei Achromatopsie. Stäbchen ermöglichen bei Normalsichtigen das Dämmerungssehen, denn sie sind lichtempfindlicher als Zapfen. Tagsüber bzw. bei Helligkeit leiden Achromaten dadurch unter einer extremen Blendungsempfindlichkeit. Da Stäbchen nur in geringer Dichte in der Netzhaut angeordnet sind, ist die Sehschärfe betroffener Personen deutlich herabgesetzt. Bei hellem Licht sind ihre Stäbchen überlastet, wodurch die Sehkraft fast völlig zurückgeht.
Material M 2: Mutationen des CNGB3-Gens
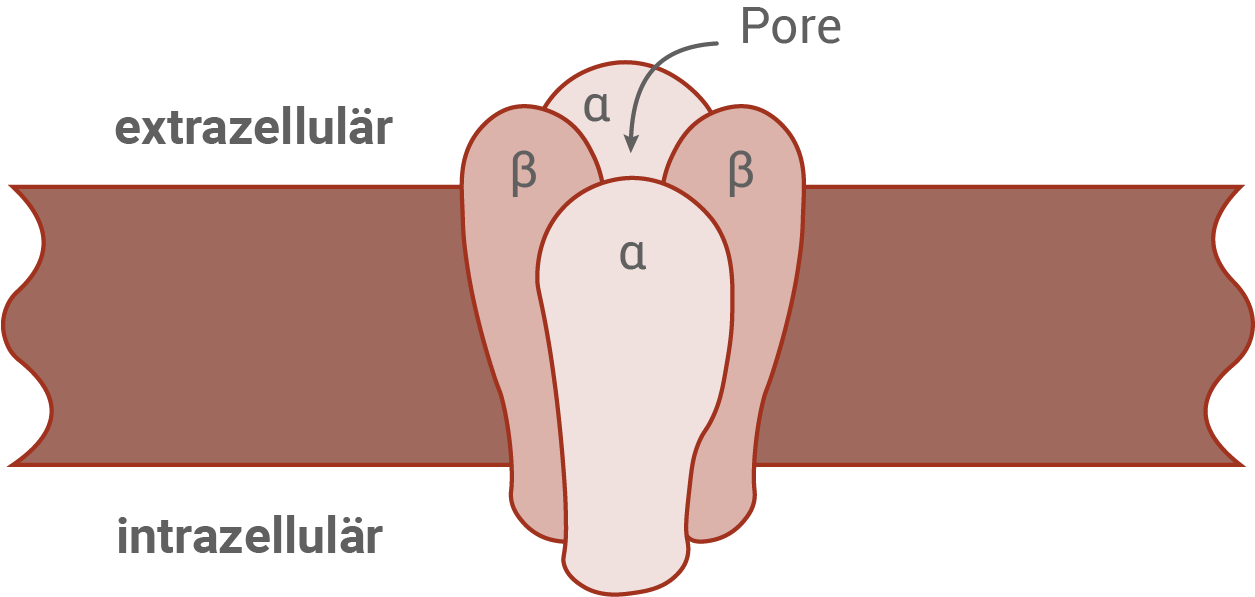
Der Funktionsverlust der Zapfen wird mit Mutationen u. a. im CNGB3-Gen in Verbindung gebracht, welches die β-Untereinheit eines Ionenkanals der Zapfen der Netzhaut codiert. Die Funktion dieses Ionenkanals ist der Transport von Kationen in die Zellen. Unter dunklen Bedingungen bleibt der Kanal offen, sodass Kationen einströmen können. Wenn Licht in das Auge eintritt, löst es die Schließung dieses Kanales aus und stoppt den Einstrom von Kationen, was letztendlich ein Signal erzeugt, das vom Gehirn als Sehen interpretiert wird.
In dem mehrere Tausende Nukleotide umfassenden CNGB3-Gen treten verschiedene Mutationen auf. In Abbildung 3 werden zwei Mutationen dargestellt. Gezeigt wird ein Ausschnitt aus dem nicht-codogenen Strang dieses Gens. Der nicht-codogene Strang ist der Strang, der nicht transkribiert wird.
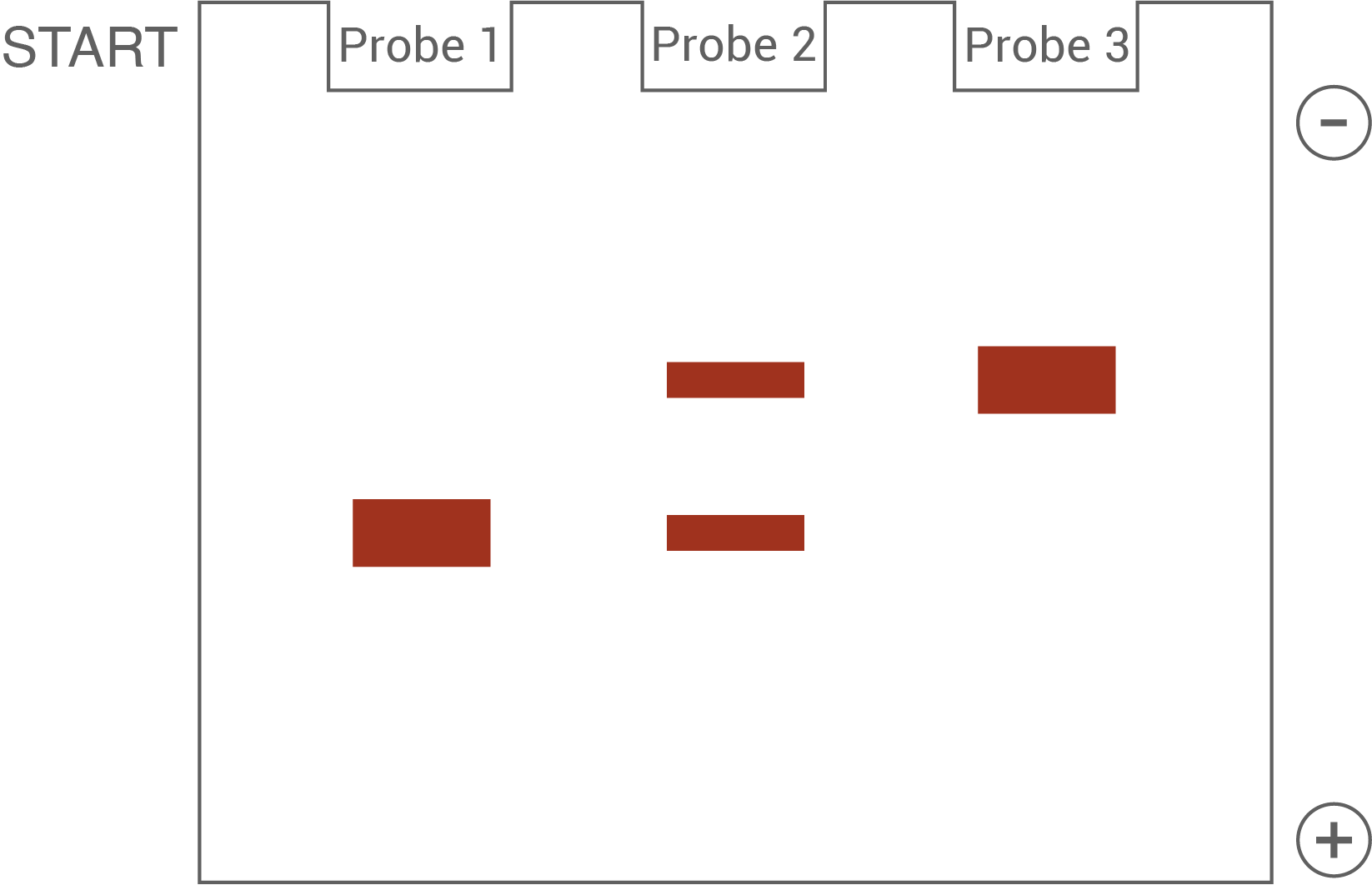
Material M 3: Gelelektrophorese
Drei Personen wurde jeweils eine Speichelprobe entnommen und daraus DNA isoliert. Ein Teilstück des CNGB3-Gens, das die Position der Mutation 2 einschließt, wurde mithilfe der PCR-Technik vervielfältigt.
Anschließend erfolgte die Untersuchung der Proben mittels einer Gelelektrophorese. Eine dieser Personen weist eine erbliche Farbenblindheit basierend auf der Mutation 2 (vgl. M 2) auf, die anderen beiden sind phänotypisch gesund. Das Ergebnis der Gelelektrophorese ist in Abbildung 5 dargestellt.
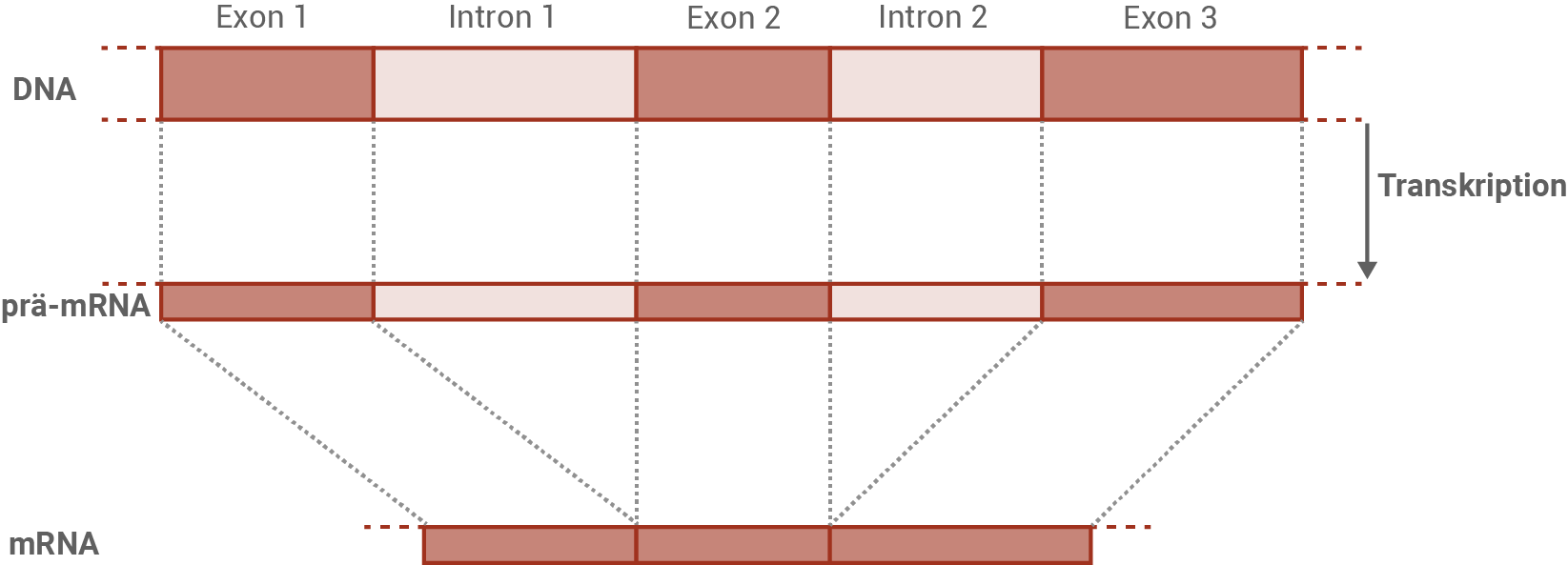
Material M 4: Spleißen
Gene der Eukaryoten bestehen aus codierenden Bereichen (Exons) und nicht-codierenden Abschnitten (Introns). Durch Transkription entsteht zunächst eine prä-mRNA, die noch im Zellkern einen Reifungsprozess durchläuft. Ein Teilprozess dieser Reifung ist das Spleißen. Als Ergebnis dieses Prozesses werden die nicht-codierenden Basensequenzen aus der prä-mRNA entfernt. Spleißosomen katalysieren diesen Prozess basengenau. Introns enthalten dafür spezielle Erkennungssequenzen, die der korrekten Erkennung von Exon-Intron-Grenzen dienen. Abbildung 6 zeigt diesen Reifungsschritt modellhaft. Im CNGB3-Gen konnten im Bereich der Spleißstellen (Schnittstelle) ebenfalls Mutationen, sogenannte Spleißstellen-Mutationen, identifiziert werden.
Material M 5: Gentherapie bei Achromatopsie
Die Behandlung der Ursache von Achromatopsie war bislang nicht möglich. Menschen mit Achromatopsie müssen lebenslang Hilfsmittel nutzen, um sich im Alltag zu orientieren oder die Lebensqualität zu verbessern. Beispiele für Hilfsmittel sind Lupen, spezielle Brillen oder Smartphones zum Diktieren oder Vorlesen. Der Alltag betroffener Personen bleibt jedoch stark eingeschränkt. Viele alltägliche Tätigkeiten wie Fahrrad- und Autofahren sind erschwert oder nicht möglich, die Berufswahl ist begrenzt.
Eine neue Behandlungsperspektive soll in Zukunft eine Gentherapie bieten. Bei dieser Gentherapie wird eine intakte Version des Gens mittels harmloser Viren in die Netzhaut der Betroffenen geschleust. Ziel ist es, dass die Netzhautzellen über das eingeschleuste Gen das entsprechend intakte Kanalprotein bilden, welches die Funktion der defekten Zapfen wiederherstellen soll. In einer ersten Studie an der Universitätsaugenklinik Tübingen wurden Achromatopsie-Patienten im Alter von 24 bis 59 Jahren behandelt. Die Probanden hatten in der Folge keine wirkstoffbezogenen Gesundheitsprobleme. Es gab leichte Verbesserungen sowohl bei der Sehschärfe als auch beim Kontrast- und Farbensehen.
Die behandelten Patienten waren im Erwachsenenalter und wiesen daher eine bereits mehr oder minder stark vorgeschädigte Netzhaut auf. „Außerdem verlieren die das Sehen verarbeitenden Anteile des Gehirns im Erwachsenenalter zunehmend an Plastizität“, wie der Direktor des Forschungsinstituts für Augenheilkunde betont. „Da das Gehirn von Achromatopsie-Betroffenen nie gelernt hat, Farbsehen zu verarbeiten, ist diese Plastizität eine notwendige Voraussetzung dafür, die neugewonnene Farbsehfähigkeit der Netzhaut in einen echten Seheindruck umzusetzen.“ Gentherapien sind teuer. Die Kosten für ein solches gentherapeutisches Produkt bei Augenkrankheiten liegen laut Lili Grell (Leiterin Expertengruppe „Arzneimittelversorgung“) pro Patientin oder Patient bei circa 900.000 Euro.
Bei einem Entscheidungskonflikt werden Pro- und Contra-Argumente gesammelt. Jedes Argument umfasst dabei drei Teile:
- Es enthält eine normative Aussage bzw. Werteaussage. Das ist eine Aussage, die sich auf einen Wert oder ein Bewertungskriterium bezieht (z. B. „Artenvielfalt soll erhalten und gefördert werden.“; zugrundeliegender Wert: „Artenvielfalt“).
- Die Werteaussage wird mit einer deskriptiven Aussage bzw. Sachinformation verknüpft (z. B. „Laub-Mischwälder sind deutlich artenreicher als Fichtenwälder.“).
- Aus dieser Verknüpfung ergibt sich dann eine Schlussfolgerung: entweder „pro“, weil der Wert erfüllt wird, oder „contra“, weil er verletzt wird.
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Erbgang bei Achromatopsie (Ausschlussverfahren):
- Dominanter Erbgang: Der Stammbaum zeigt, dass die phänotypisch nicht betroffenen Eltern (1+2) eine phänotypisch erkrankte Tocher (6) haben. Das ist nur bei einem rezessiven Erbgang möglich.
- X-Chromosomaler Erbgang: Eine gonosomale Vererbung über das X-Chromosom kann ebenfalls ausgeschlossen werden. Männliche Personen bekommen das X-Chromosom immer von der Mutter. Damit müsste eine phänotypisch erkrankte Mütter immer auch betroffene Söhne haben. Sohn 11 von Mutter 6 ist aber phänotypisch gesund.
- Y-Chromosomaler Erbgang: Beim Y-Chromosomalen Erbgang wir das betroffene Y-Chromosom vom Vater an die Söhne vererbt. Frauen können dabei nie betroffen sein, da sie kein Y-Chromosom besitzen. In dem Familienstammbaum prägen aber auch Frauen die Krankheit aus.
Wahrscheinlichkeit, mit der ein Kind der Personen 12 und 13 von Achromatopsie betroffen ist:
Die Mutter (13) ist heterozygot und der Vater (12) ist homozygot in Bezug auf das mutierte Allel. Damit liegt die Wahrscheinlichkeit bei 50 %, dass ein Kind dieser Personen von Achromatopsie betroffen sein wird.Aminosäuresequenzen:
Zunächst muss der komplementäre (codogene) Strang zu dem nicht-codogenen DNA Stang aus Material 2 gebildet werden. Dieser Stang ist in 3'| mRNA (nicht mutiert) | 5'-... GGA AUU GGC ACU ACU AGA ...-3' |
| Aminosäuresequenz (nicht mutiert) | ... Gly - Ile - Gly - Thr - Thr - Arg ... |
| mRNA (mutiert) | 5'-... GGA AUU GGC ACU AUA GA ...-3' |
| Aminosäuresequenz (mutiert) | ... Gly - Ile - Gly - Thr - Ile ... |
Auswirkungen der Mutation auf das Genprodukt:
Es handelt sich um eine Deletionsmutation, bei der die Base Cytosin (Nukleotid 1148) entfernt wurde. Die Folge ist eine Verschiebung des Leserasters, dabei rückt die Base Thymin an die zweite Position, und die Base Adenin an die dritte Position des Triplets. Dieses Triplet codiert nun für die Aminosäure Ile anstelle von Thr im nicht mutierten Strang.Prinzip der Gelektrophorese:
Das Verfahren der Gelelektrophorese dient der Unterscheidung geladener Teilchen (wie zum Beispiel DNA-Fragmente) nach ihrer Größe. Durch eine anschließende Färbung des Gels können diese Fragmente sichtbar gemacht werden. Die Gelelektrophorese besteht aus einer Kammer, in der sich ein Agarose-Gel befindet. Das Gel ist strukturell wie ein engmaschiges Netz aufgebaut, wodurch größere Fragmente langsamer wandern als kleinere. Auf der Kathodenseite des Gels werden die zu untersuchenden Proben gemeinsam mit einem Ladepuffer in dafür vorgesehene Taschen im Gel gegeben. In der Regel wird in eine äußere Tasche ein Größenmarker gegeben, um die DNA-Fragmente später zuordnen zu können. Im Anschluss wird eine elektrische Spannung angelegt, und die Fragmente beginnen zu wandern. Da die DNA polar und durch ihr Phosphatrückgrat negativ geladen ist, wandert sie im Gel von der Kathode in Richtung Anode. Nach einer definierten Zeitspanne, wird das Gel von der Spannungsquelle getrennt, und mit einem Farbstoff eingefärbt, der die Banden im UV-Licht sichtbar macht. Dadurch und durch den Vergleich mit dem Größenmarker kann die Länge und Häufigkeit der erhaltenen DNA Fragmente ermittelt werden.Ableiten der Genotypen und Zuordnung:
- Probe 1: Es ist eine relativ breite Bande zu erkennen. Es handelt sich damit um einen homozygoten Genotyp, bei dem beide Banden sind gleich groß sind und gleich weit im Gel wandern können. Im Vergleich zu Probe 3 ist Probe 1 weiter im Gel gelaufen, das Fragment ist also kürzer. Es handelt sich damit um Personen, die homozygot von der Krankheit betroffen sind (Genotyp aa). Dafür kommen Personen 6, 9, 12, 14 und 15 in Frage.
- Probe 2: Im Gel sind zwei schmale Banden zu erkennen. Das spricht für einen heteozygoten (Genotyp Aa). Diesen Genotyp weisen die Personen 1, 2, 3, 4, 5, 7, 8, 10, 11 oder 13 auf.
- Probe 3: Im Gel ist eine Bande vorhanden, die ebenfall etwas breiter ist. Es handelt sich um einen homozygoten Genotyp (AA). Da die Bande weiter oben im Gel liegt, als bei Probe 1 ist davon auszugehen, dass es sich um das nicht-mutierten, längeren Allele handelt. Dieser Genotyp kann auf die Personen 3, 4 oder 5 zutreffen.
Auswirkung einer Spleißstellen-Mutation im CNGB3-Gen:
Durch den Prozess des alternativen Spleißens werden unterschiedliche Introns ausgeschnitten. Bei einer Spleißstellen-Mutation kann es passieren, dass veränderte Erkennungssequenzen entstehen, und ein Intron zwischen den Exons nicht entfernt wird. Dadurch entsteht eine veränderte mRNA-Sequenz. Daraus entsteht wiederum ein verändertes Protein für die β-Untereinheit des Ionenkanals der Zapfen der Netzhaut. Die Ionenkanäle verlieren somit möglicherweise ihre Funktion, und die Farbwahrnehmung ist gestört.Gründe für eine Gentherapie im Kindesalter:
Im Kindesalter ist die Netzhaut weniger vorbelastet, als es im Erwachsenenalter der Fall ist. Außerdem ist die neuronale Plastizität im Kindes- und Jugendalter am höchsten. Für einen möglichst hohen Behandlungserfolg sollte die Gentherapie daher möglichst früh durchgeführt werden. So kann die fortscheitende Netzhautschädigung eingedämmt werden, und das Gehirn kann sich besser an die Signalverarbeitung beim Farbsehen gewöhnen.Entscheidungskonflikt:
- Pro-Argument:
- Die Lebensqualität von Menschen mit Achromatopsie muss gesteigert werden. (Wert: Lebensqualität)
- Durch die Gentherapie wird die Farbwahrnehmung ermöglicht, wordurch die Lebensqualität im Alltag gesteigert wird.
- Schlussfolgerung: Der Einsatz einer Gentherapie bei Menschen mit Achromatopsie ist zu befürworten.
- Pro-Argument:
- Betroffenen muss eine freie und selbstbestimmte Lebensgestaltung ermöglicht werden. (Wert: Freiheit)
- Durch die Gentherapie können Betroffene ihr Leben flexibler und selbstbestimmter gestalten, indem sie beispielsweise Fahrrad- oder Autofahren können, und haben mehr Entfaltungsfreiraum in ihrem Berufsleben.
- Schlussfolgerung: Der Einsatz einer Gentherapie bei Menschen mit Achromatopsie ist zu befürworten.
- Contra-Argument:
- Die Kosten für die Allgemeinheit müssen möglichst gering gehalten werden und dem Aufwand muss ein Nutzen entgegenstehen. (Wert: Wirtschaftlichkeit)
- Die Gentherapie verursacht sehr hohe Kosten, die erzielten Verbesserungen durch die Therapie wurden jedoch nur als leicht bewertet.
- Schlussfolgerung: Der Einsatz einer Gentherapie bei Menschen mit Achromatopsie ist nicht zu befürworten.
- Contra-Argument:
- Alle Betroffenen muss gleichberechtigt Zugang zu der Therapie ermöglicht werden. (Wert: Gerechtigkeit)
- Die Gentherapie verursacht sehr hohe Kosten, und ist für das Gesundheitssystem nicht tragbar.
- Schlussfolgerung: Der Einsatz einer Gentherapie bei Menschen mit Achromatopsie ist nicht zu befürworten.