HT 2 – Chemie trifft Kunst – Radierungen
Die Radierung ist eine Tiefdrucktechnik aus dem 16. Jahrhundert, die noch heute in der Kunst Verwendung findet. Die Vertiefungen in den Druckplatten zur Aufnahme der Druckfarben werden abhängig vom Plattenmaterial auf unterschiedlichen Wegen erzeugt. Unter anderem werden hierfür elektrochemische Verfahren genutzt.
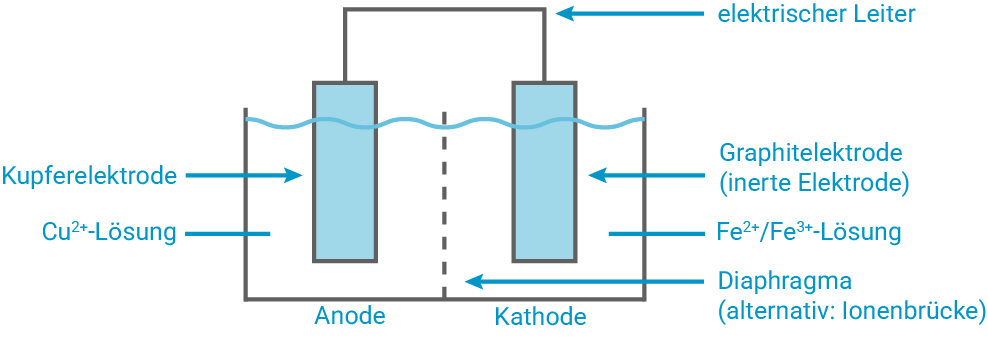
Zeichne ein zur Ätzradierung analoges beschriftetes galvanisches Element mit dem Zelldiagramm (Graphit-Kathode) (M 1).
Ermittle die ablaufenden Prozesse bei Betrieb des galvanischen Elements sowie die Spannung des galvanischen Elements unter Standardbedingungen.
Erkläre unter Annahme von Standardbedingungen, dass eine Eisen(III)-chloridlösung nicht zum Ätzen von Silberplatten geeignet ist.
Analysiere unter Nutzung der Nernst-Gleichung, ob bei Abweichen von Standardbedingungen das Ätzen von Silberplatten mit eisen(III)-haltigen Lösungen möglich ist.
Gib die Teilgleichungen und die Gesamtgleichung der beim Ätzen von Silberplatten mit Salpetersäure stattfindenden Redoxreaktion an (M 1).
Leite anhand von Oxidationszahlen ab, dass es sich bei der Reaktion von Nitrat-Ionen zu Stickstoffmonooxid-Molekülen um eine Reduktion handelt (M 1).
Beurteile die beiden in M 1 dargestellten Ätzverfahren unter Gefahren- und Entsorgungsaspekten und entscheide auf Basis dieser Aspekte, welches der Verfahren du bevorzugen würdest (M 1, M 2).
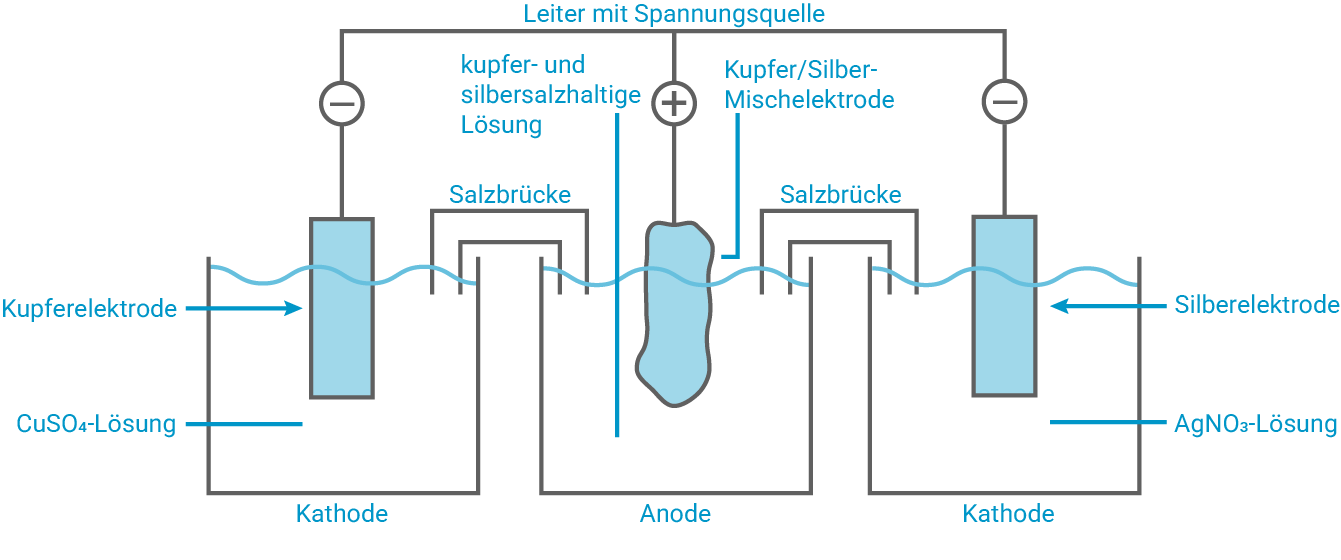
Plane mithilfe der in M 2 aufgeführten Chemikalien und selbst gewählten geeigneten Geräten zwei Modellexperimente, die die beiden Schritte der Rückgewinnung von Kupfer und Silber aus einer gemischten Lösung von Salzen beider Metalle verdeutlichen.
Beschreibe die zu erwartenden Prozesse in deinen Modellexperimenten.
M 1: Ätzradierungen
Eine Metallplatte aus Kupfer oder Silber wird zunächst mit einem nichtleitenden Lack überzogen. In die Lackschicht wird die Zeichnung seitenverkehrt eingeritzt, sodass unter der aufgetragenen Lackschicht das Metall erscheint. Die so vorbereitete Platte kann weiterverarbeitet werden.
Die beschichtete Platte wird für einige Minuten in eine Ätzlösung gelegt. An den vom Lack befreiten Stellen bilden sich Vertiefungen. Anschließend wird die Platte gespült und die restliche Lackschicht entfernt. Die Platte dient dann als Tiefdruckplatte.
Bei Kupferplatten dient eine Eisen(III)-chloridlösung als Ätzlösung; für Silberplatten wird Salpetersäure als Ätzlösung genutzt. Die ätzende Wirkung von Salpetersäure ist hierbei nicht auf die Oxonium-Ionen als Oxidationsmittel zurückzuführen. Hier dienen Nitrat-Ionen
im sauren Milieu als Oxidationsmittel, die zu Stickstoffmonooxid- und Wasser-Molekülen umgesetzt werden. Das entstehende Stickstoffmonooxid ist an der Luft nicht stabil und oxidiert spontan zu giftigem, gasförmigem Stickstoffdioxid.
M 2: Entsorgung kupfer- und silberhaltiger Lösungen
Kupfer- und silbersalzhaltige wässrige Lösungen sind als kostenintensive Sonderabfälle zu behandeln, da sie schon in sehr niedriger Konzentration giftig auf Wasserorganismen wirken. Zudem ist eine Rückgewinnung von Silber aus silberhaltigen Abfällen durchaus ökonomisch sinnvoll. Die Metalle können in einem zweistufigen Prozess aus kupfer- und silberhaltigen Lösungen, wie beispielsweise gebrauchten Ätzlösungen, zurückgewonnen werden. In einem ersten Schritt werden die Metall-Ionen durch Reduktion aus der Lösung als Metallgemisch ausgefällt. In einem zweiten Schritt wird das zu einer Elektrode verarbeitete Kupfer-Silber-Gemisch elektrolytisch getrennt.
Zur Entwicklung von Modellexperimenten stehen die folgenden Chemikalien zur Verfügung:
- Kupfer- und silbersalzhaltige Lösung
und
- Kupfer(II)-sulfat-Lösung,
- Silber(I)-nitrat-Lösung,
- Eisen (Wolle)
- Kupfer (Elektrodenform)
- Silber (Elektrodenform)
- Kupfer-Silber-Gemisch (Elektrodenform)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Zur Ätzradierung analoges galvanisches Element
Ermittlung ablaufender Prozesse
Anhand des Zelldiagramms aus der Aufgabenstellung und der Standardelektrodenpotentiale aus der Formelsammlung lassen sich die ablaufenden Prozesse und schließlich die vorherrschende Zellspannung berechnen:
Anode (Oxidation, links)
Kathode (Reduktion, rechts)
Gesamtgleichung
Zellspannung
Die Zelle liefert unter Standardbedingungen und läuft somit spontan in der angegebenen Richtung.
Warum eine Eisen(III)-chloridlösung Silber nicht ätzt
Statt Kupfer soll nun Silber geätzt werden. Hierzu müsste also zu
oxidiert werden, während weiterhin
zu
reduziert wird.
Mit den Standardpotentialen ergibt sich die folgende theoretische Zellspannung:
Die sich ergebende Zellspannung hat einen negativen Wert und die gewünschte Reaktion läuft somit unter Standardbedingungen nicht spontan ab.
Nernst-Gleichung und Abweichung von Standardbedingungen
Die Nernst-Gleichung lautet:
Für die jeweiligen Standardpotentiale und schließlich auch die Zellspannung gilt somit:
Die elementare Silberkonzentration streicht sich im letzten Term raus, da das Silber als Feststoff im Überschuss mit einer Aktivität von 1 angenommen werden kann.
Bei Abweichung von Standardbedingungen gelten somit folgende Zusammenhänge:
Je höher die Konzentration von ist, desto größer wird die Zellspannung, sodass die Reduktion von
leichter möglich wird.
Je mehr bereits vorhanden ist, desto stärker sinkt die Spannung und die Reaktion wird gebremst.
Entscheidend ist außerdem die Silber-Ionen-Konzentration: Je kleiner ist, desto stärker steigt die Zellspannung.
Rein rechnerisch ergibt sich somit, dass bei einer geeigneten Wahl der Konzentrationen, also der Abweichung von Standardbedingungen, die Reaktion durchaus ablaufen kann. Hierbei ist festzuhalten, dass sich in Eisen(III)-chloridlösung die gelöste Silber-Ionen-Konzentration ständig niedrig hält, da schwerlösliches Silberchlorid ausfällt. Praktisch kommt die Reaktion trotz all dem kaum vor, da die gebildete Silberchlorid-Schicht die Silberoberfläche passiviert und den Angriff stoppt.
Teilgleichungen
Reduktion
Oxidation
Gesamtgleichung
Hinweis: Unter Einbezug der Folgereaktion zu Stickstoffdioxid und Nichtbeachtung der Disproportionierung davon in Wasser ergibt sich folgende, auch richtige Gesamtgleichung:
Nachweis der Reduktion
Die Absenkung der Oxidationszahl (OZ) entspricht einer Reduktion. In hat Stickstoff die
, in
hingegen
. Durch Aufnahme von drei Elektronen sinkt die Oxidationszahl also und es liegt eine Reduktion vor.
Beurteilung der Ätzverfahren
Beim Ätzen mit fallen schwermetallhaltige Lösungen an, es entstehen jedoch keine nitrosen Gase. Beim Ätzen mit
bildet sich
, das an Luft zu giftigem
oxidiert, wodurch eine deutlich höhere akute Gefährdung entsteht. Diesen Aspekten entsprechend ist die Ätzradierung von Kupfer der von Silber vorzuziehen, entsorgt werden müssen die metallhaltigen Lösungen jedoch in beiden Fällen als Sonderabfall.
Reduktion zur Fällung des Metallgemisches
Skizze
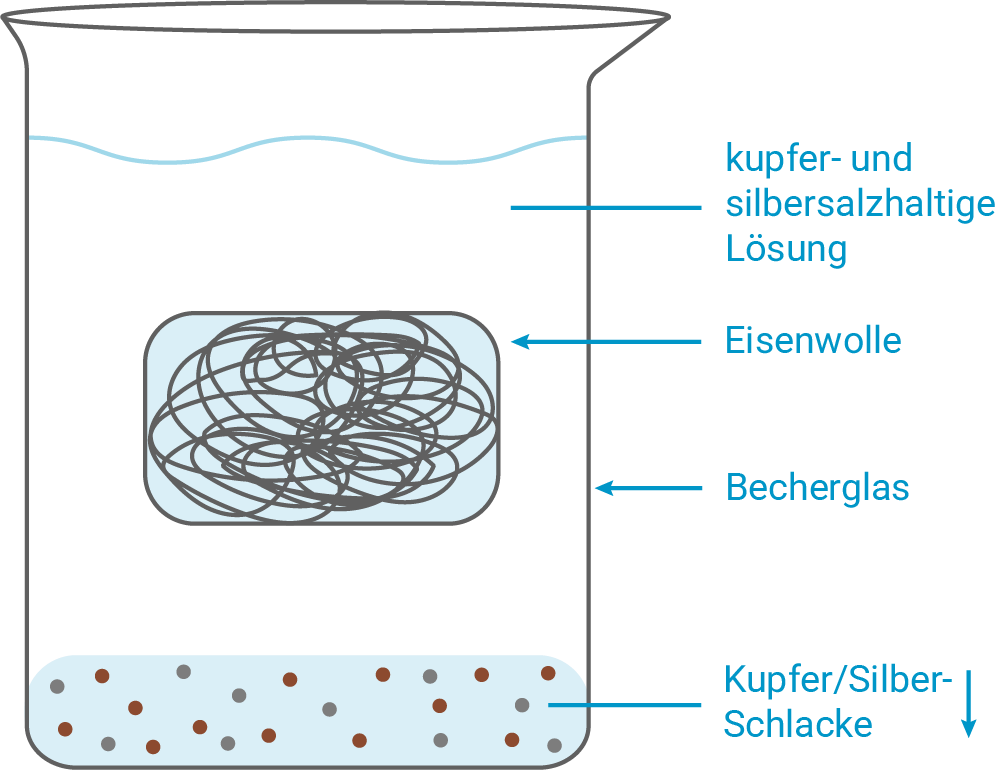
Eisen ist unedler als Kupfer und Silber und wird oxidiert:
Die edleren Metallionen werden reduziert und fallen als Metalle aus:
Es resultiert ein gemeinsam abgeschiedenes Metallgemisch aus Kupfer und Silber, während Eisenionen in Lösung gehen.
Elektrolytische Trennung des Metallgemisches
An der Anode (Pluspol, Mischelektrode) lösen sich die Metalle:
An den Kathoden scheiden sich die jeweiligen Metalle wieder ab:
In diesem Prozess wird die Anode fortlaufend aufgelöst und die Metalle räumlich getrennt wieder ausgefällt.