HT 4 – Prontosil – der heilsame Farbstoff
Prontosil ist ein Farbstoff und das erste Antibiotikum aus der Gruppe der Sulfonamide.
Für die Entdeckung der antibakteriellen Wirkung des Farbstoffes Prontosil erhielt der Entdecker Domagk 1939 den Nobelpreis für Medizin. Prontosil und die Sulfonamide wurden durch die Entdeckung des Penicillins weitgehend ersetzt.
Erkläre den allgemeinen Zusammenhang zwischen Lichtabsorption und Farbigkeit.
Ermittle unter Berücksichtigung des Spektrums der elektromagnetischen Strahlung das zu erwartende Absorptionsmaximum von Prontosil (M 1, M 2).
Begründe anhand der Molekülstruktur die Farbigkeit von Prontosil und ordne den Farbstoff begründet einer Farbstoffklasse zu (M 1).
Erläutere unter Angabe des Reaktionstyps die Reaktion von Zwischenprodukt I zu Zwischenprodukt II in Einzelschritten (M 2).
Erkläre mithilfe einer Reaktionsgleichung und unter Angabe des Reaktionstyps, zu welchem unerwünschten Produkt die direkte Umsetzung von Anilin mit Chlorsulfonsäure führen kann (M 2).
Gib das zweite Produkt neben dem Wirkstoff Sulfanilamid an, das bei der Spaltung des Farbstoffes im Körper entsteht. Beurteile den Einsatz von Prontosil als Arzneistoff (M 1, M 3).
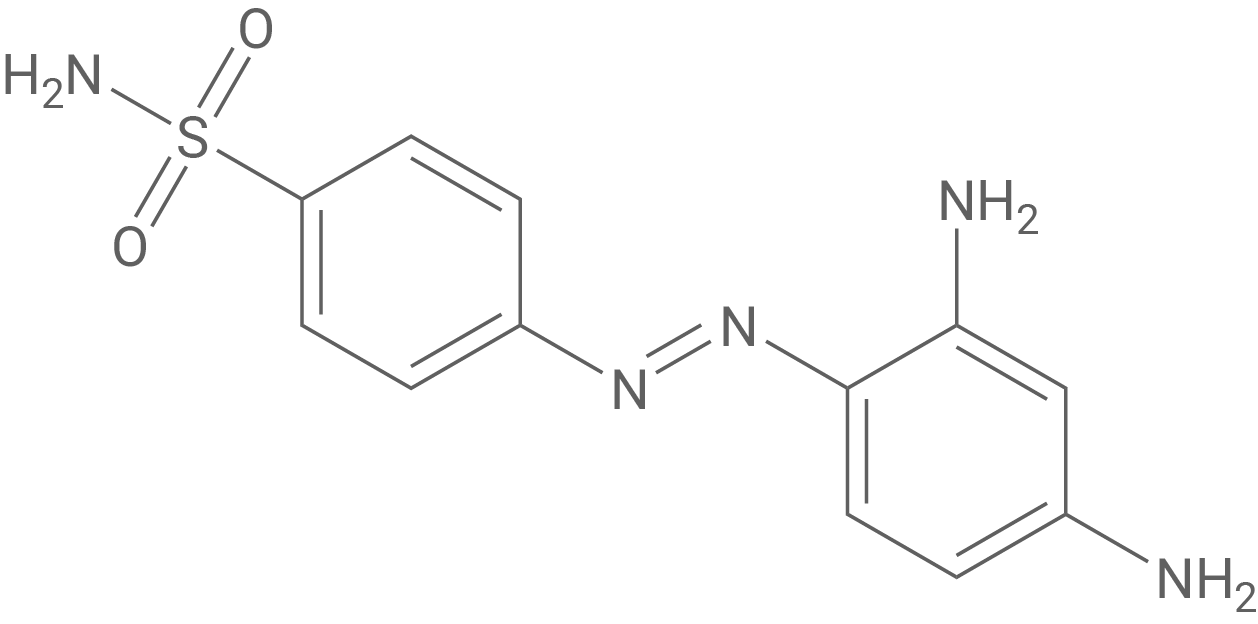
M 1: Prontosil
Prontosil gehört zu den Arzneistoffen der Gruppe der Sulfonamide. Sulfonamide sind Verbindungen aus der Gruppe der aromatischen Sulfonsäureamide, deren einfachster Vertreter das Sulfanilamid ist (siehe M 2). Das Präparat fällt besonders durch seine tiefrote Farbe auf, die auch als Nebenwirkung zur Verfärbung der Haut führen konnte.
M 2: Synthese von Sulfanilamid
Ein benötigtes Edukt zur Synthese von Prontosil ist Sulfanilamid, das aus Anilin nach folgendem Verfahren synthetisiert wird:
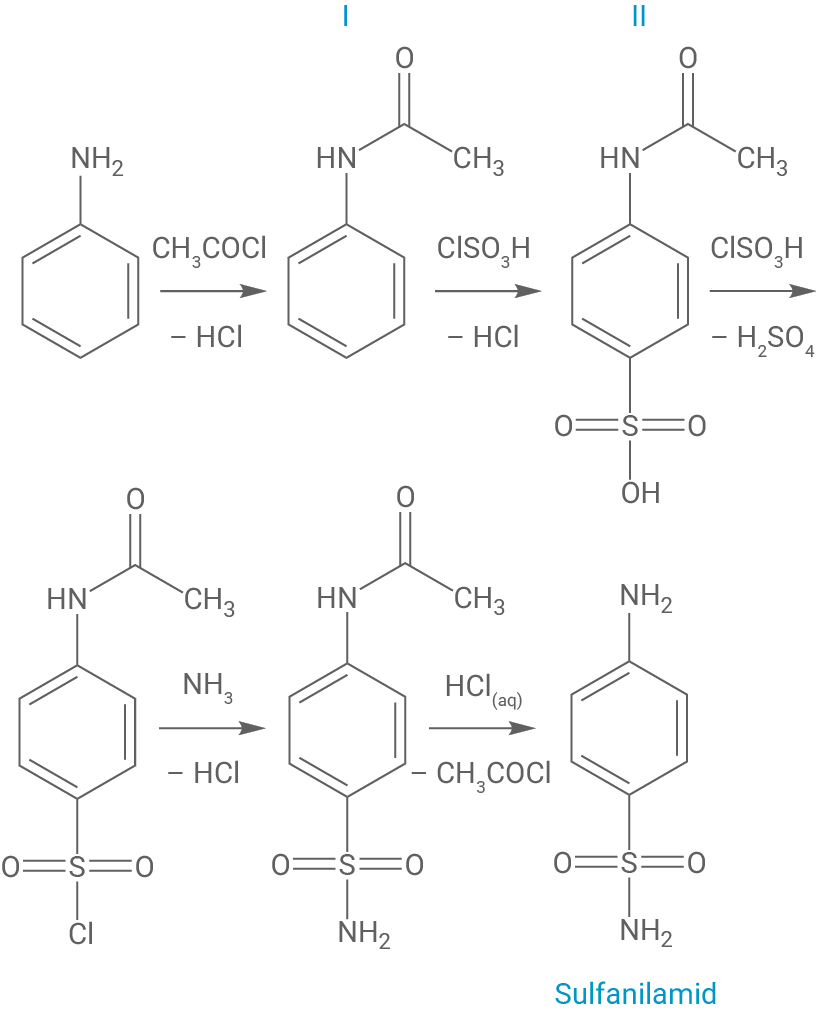
Dabei wird ausgehend vom Anilin zunächst Acetanilid (N-phenylacetamid, Zwischenprodukt I) durch Reaktion mit Acetylchlorid hergestellt. Erst anschließend kann die Umsetzung mit Chlorsulfonsäure in wässriger Lösung erfolgen (siehe Zwischenprodukt II), da es ansonsten zu unerwünschten Nebenprodukten kommt.
M 3: Freisetzung des Wirkstoffes
Im Verdauungstrakt kommt es nach Aufnahme von Prontosil zu einer Spaltung des Farbstoffes, bei der der eigentliche Wirkstoff Sulfanilamid und ein weiteres aromatisches Amin freigesetzt werden. Aromatische Amine gelten heutzutage als krebserregend.
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Zusammenhang Absorption und Farbigkeit
Ein Farbstoff erscheint in der Komplementärfarbe zu der Wellenlänge, die er am stärksten absorbiert. Das sichtbare Spektrum reicht grob von violett bis rot
Erwartetes Absorptionsmaximum von Prontosil
Da Prontosil tiefrot erscheint, muss die stärkste Absorption im komplementären Bereich liegen, also grün–cyan. Daraus folgt ein Absorptionsmaximum von etwa
Farbigkeit und Farbstoffklasse von Prontosil
Aufgrund der charakteristischen -Einheit (Azogruppe) lässt sich Prontosil schnell zur Klasse der Azofarbstoffe einordnen (azoaromatische Farbstoffe).
Diese Azogruppe verbindet zwei aromatische Ringe. Hierdurch bildet sich ein durchgehendes -konjugiertes System, welches Elektronendelokalisierung über den gesamten Chromophor erlaubt. Zusätzlich wirken Amino-Gruppen
als auxochrome Donoren (+M-Effekt), verlängern die effektive Konjugation und verschieben die Absorption so bathochrom (zu längeren Wellenlängen).
Die Energiedifferenz zwischen den - und
-Niveaus wird so schlussendlich verkleinert und Photonen geringerer Energie bzw. größerer Wellenlänge (sichtbarer Bereich) absorbiert.
Reaktionstyp
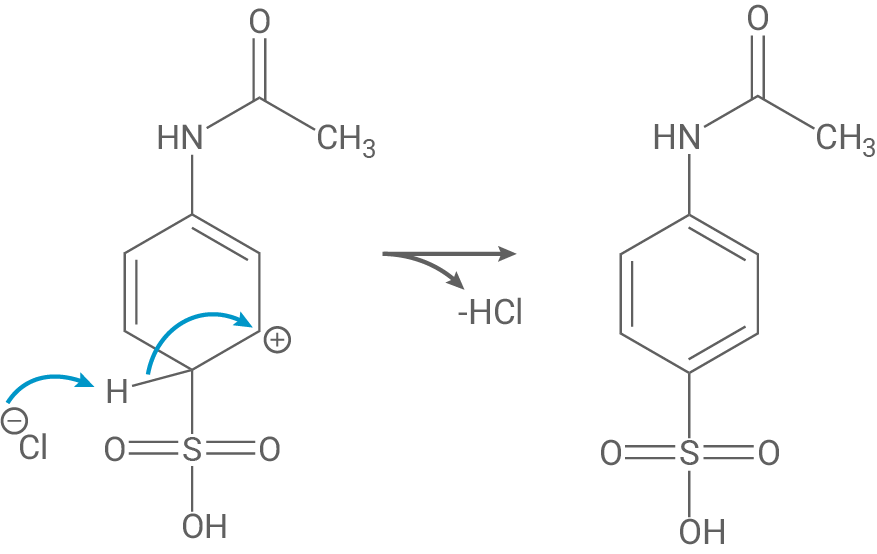
Die Umsetzung von Zwischenprodukt I (Acetanilid) zu Zwischenprodukt II ist eine elektrophile aromatische Substitution (Sulfonierung) am Benzolring.
Insgesamt läuft die elektrophile aromatische Substitution über gekoppelte Additions- und Eliminationsschritte ab.
Einzelschritte des Mechanismus
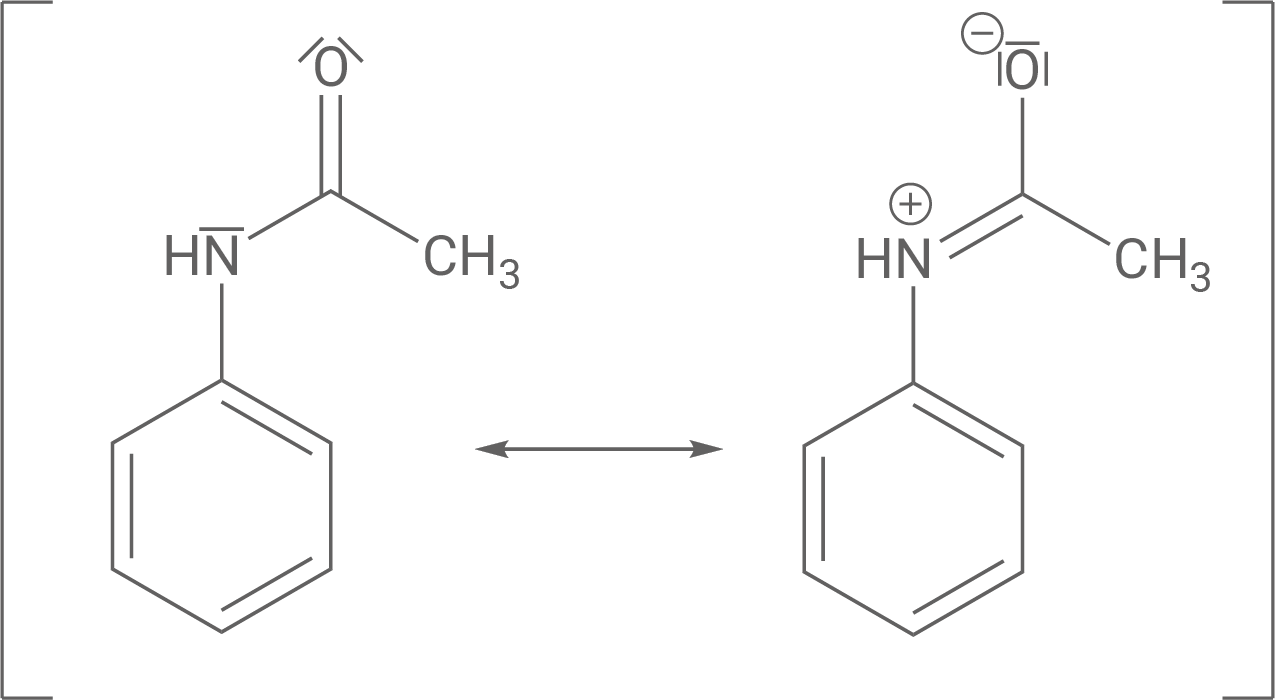
Schritt 1: Der +M-Effekt des N-Acetylsubstituenten dirigiert einen elektrophilen Angriff an das aromatische System in ortho- bzw. para-Stellung (s. mesomere Grenzformeln).
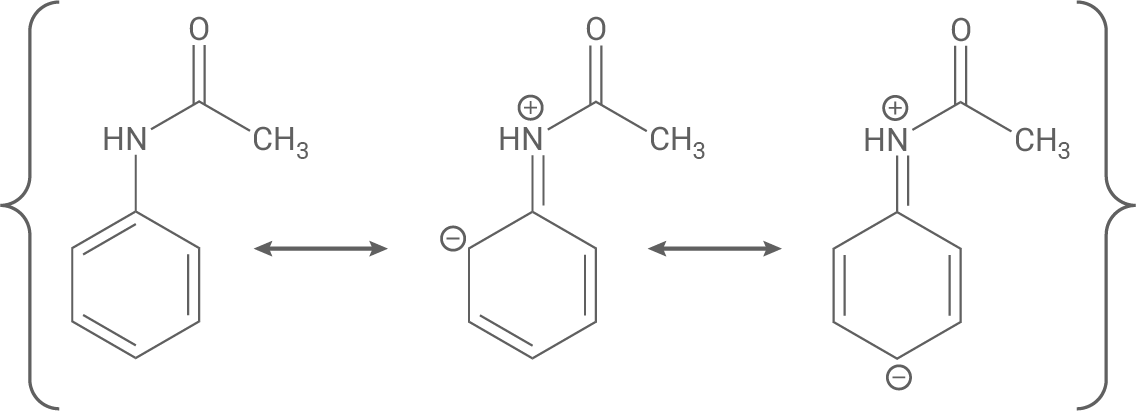
Schritt 2 (Addition): Nach Ausbildung des
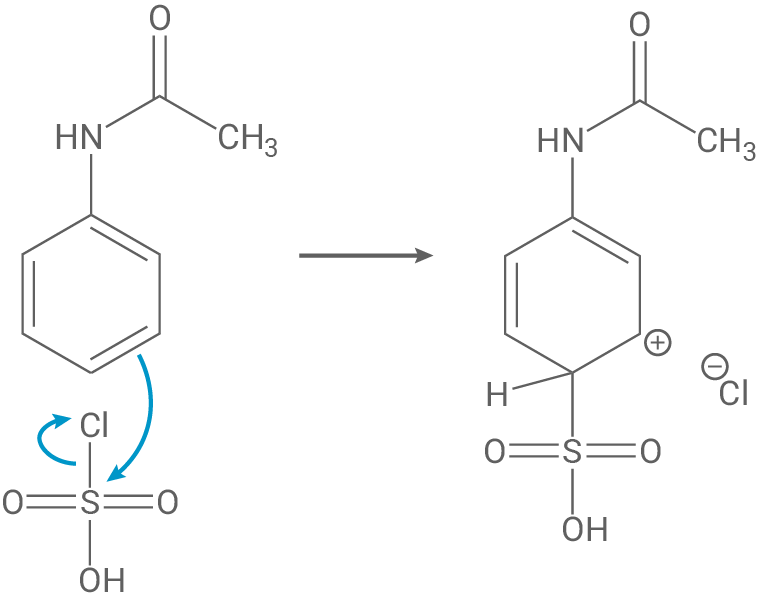
Auch hier wird erneut der dirigierende Effekt des N-Acetylsubstituenten deutlich, da die positive Ladung des Arenium-Ions auch über dem Substituenten selbst delokalisiert ist (im Vergleich stärkere Delokalisierung). Außerdem gibt mehr mesomere Grenzformeln als bei meta-Stellung, damit ist para-Stellung zusammenfassend stabiler.
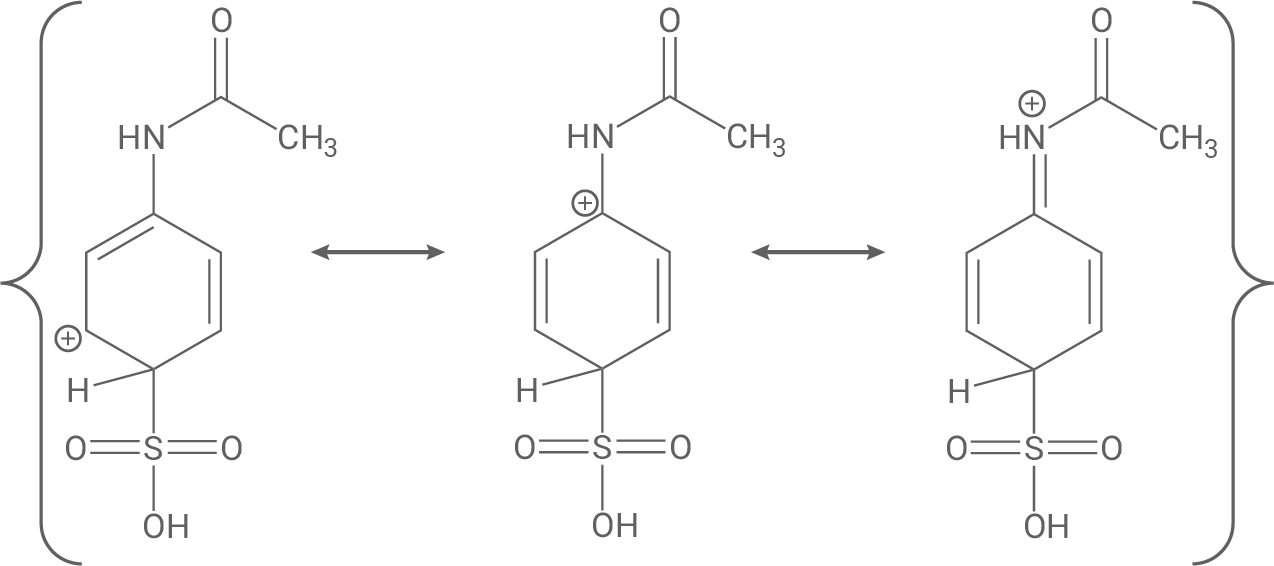
Im letzten Schritt spaltet sich ein Proton vom sp3-hybridisierten Kohlenstoffatom ab und dadurch wird die Aromatizität wiederhergestellt.
Unerwünschtes Produkt und Reaktionstyp
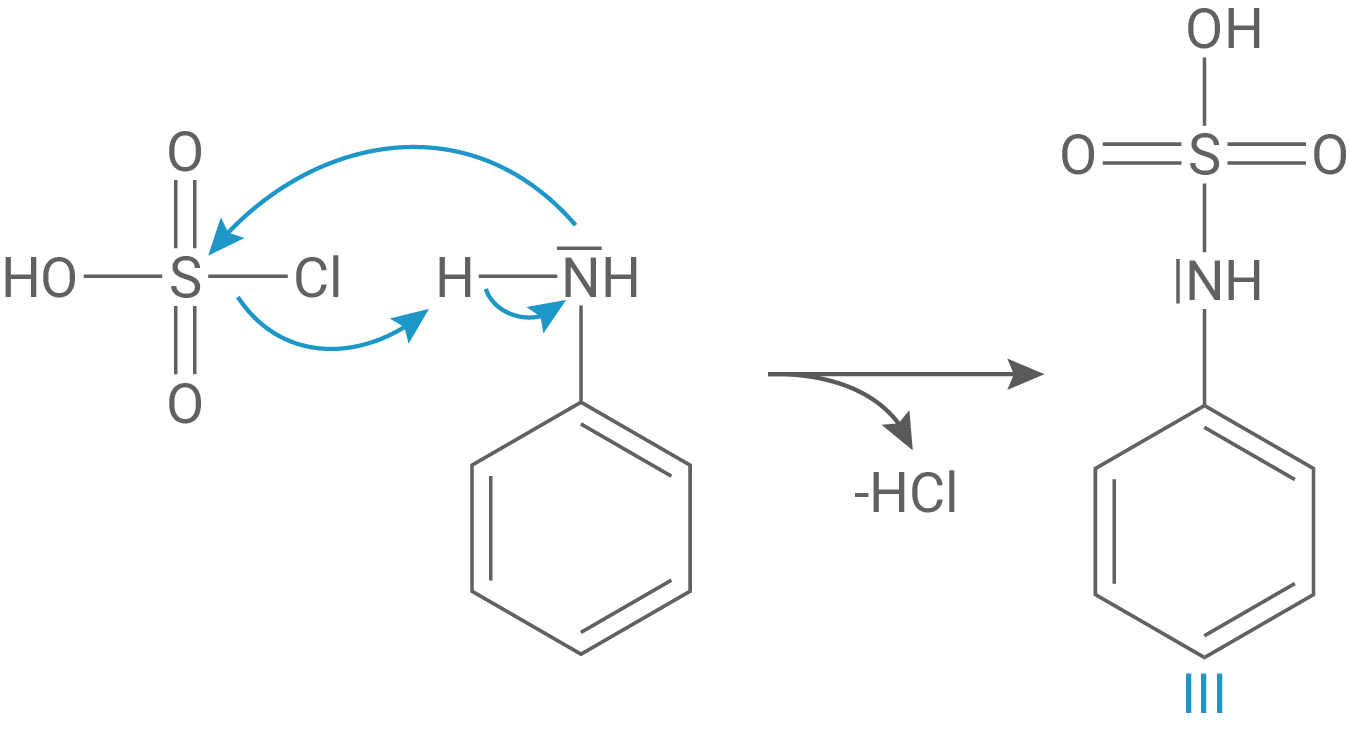
Reagiert Anilin direkt mit Chlorsulfonsäure, so greift das freie Elektronenpaar des Stickstoffatoms das elektrophile Schwefelzentrum der Chlorsulfonsäure an. Dadurch kommt es nicht zu der gewünschten elektrophilen aromatischen Substitution am Benzolring, sondern zu einer N-Sulfonierung, also einer nukleophilen Substitution am Schwefelatom: Es bildet sich ein Sulfamidsäure-Derivat (Phenylsulfaminsäure), bei dem die Sulfongruppe direkt am Stickstoff gebunden ist. Unter Abspaltung von Chlorwasserstoff entsteht somit das unerwünschte Hauptprodukt III. Diese Reaktion läuft bevorzugt vor der elektrophilen Substitution ab, da kein Aufbrechen des aromatischen Systems notwendig ist, was immer mit einer Energiestrafe verbunden ist.
Da diese Nebenreaktion die Bildung des gewünschten para-sulfonierten Anilinderivats verhindert, wird in der Synthese zunächst eine Acetylierung durchgeführt, um den Stickstoff zu blockieren und die Sulfonierung gezielt an der para-Position des aromatischen Rings ablaufen zu lassen (Einsatz einer Schutzgruppe). Der N-Acetylsubstituenten entzieht dem Stickstoff nämlich resonanzbedingt Elektronendichte, was einen unerwünschten elektrophilen Angriff dort verhindert.
Zweites Spaltprodukt
Bei der reduktiven Spaltung der Azo-Brücke von Prontosil im Körper entsteht neben dem Wirkstoff Sulfanilamid auf der Gegenseite der Azo-Bindung ein aromatisches Amin (Anilinderivat). Genau dies wird in M 3 genannt.
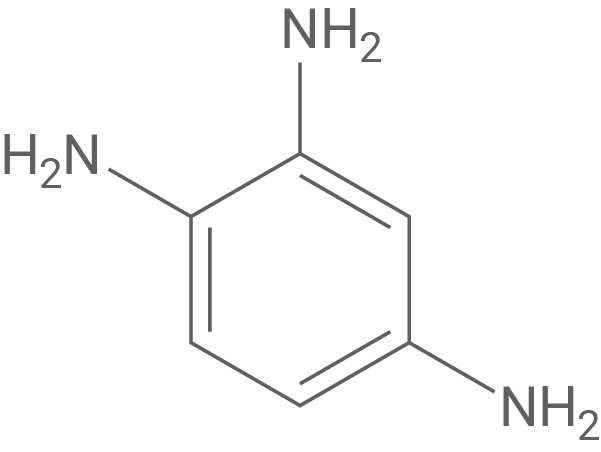
(1,2,4-Triaminobenzol)
Beurteilung des Arzneistoffeinsatzes
Pharmakologisch wirkt nicht Prontosil selbst, sondern das freigesetzte Sulfanilamid. Problematisch ist, dass bei der Spaltung zugleich ein aromatisches Amin entsteht, und aromatische Amine gelten als krebserregend. Unter Nutzen-Risiko-Abwägung ist der Einsatz von Prontosil nicht mehr zeitgemäß; es wurde historisch durch Sulfanilamid selbst bzw. sicherere Antibiotika (z. B. Penicilline) ersetzt.