A2 Wilde Malve
Hinweis: In der Prüfung musst du von den Aufgabenblöcken A, B und C jeweils einen der beiden Vorschläge 1 oder 2 bearbeiten.
Die Wilde Malve (Malva sylvestris) wird seit langer Zeit nicht nur als Zierpflanze für Gärten, sondern auch als Heilpflanze genutzt. Es werden vor allem die Blütenblätter der Pflanze verwendet (z. B. für Tees und Cremes), in denen antioxidativ wirksame Anthocyan-Blütenfarbstoffe wie das Malvin eingelagert sind.
Malventee ändert bei Zugabe von z. B. Zitronensaft seine Farbe. In Abhängigkeit vom pH-Wert lassen sich vom Anthocyan-Farbstoff Malvin (Abb. 1) verschiedene Absorptionsspektren messen (Abb. 2).


| Wellenlänge des absorbierten Lichts in nm | Farbe des absorbierten Lichts |
Komplemen- tärfarbe |
| Violett | Gelb | |
| Blau | Orange | |
| Blaugrün | Rot | |
| Gelbgrün | Purpur | |
| Gelb | Violett | |
| Orange | Blau | |
| Rot | Blaugrün |
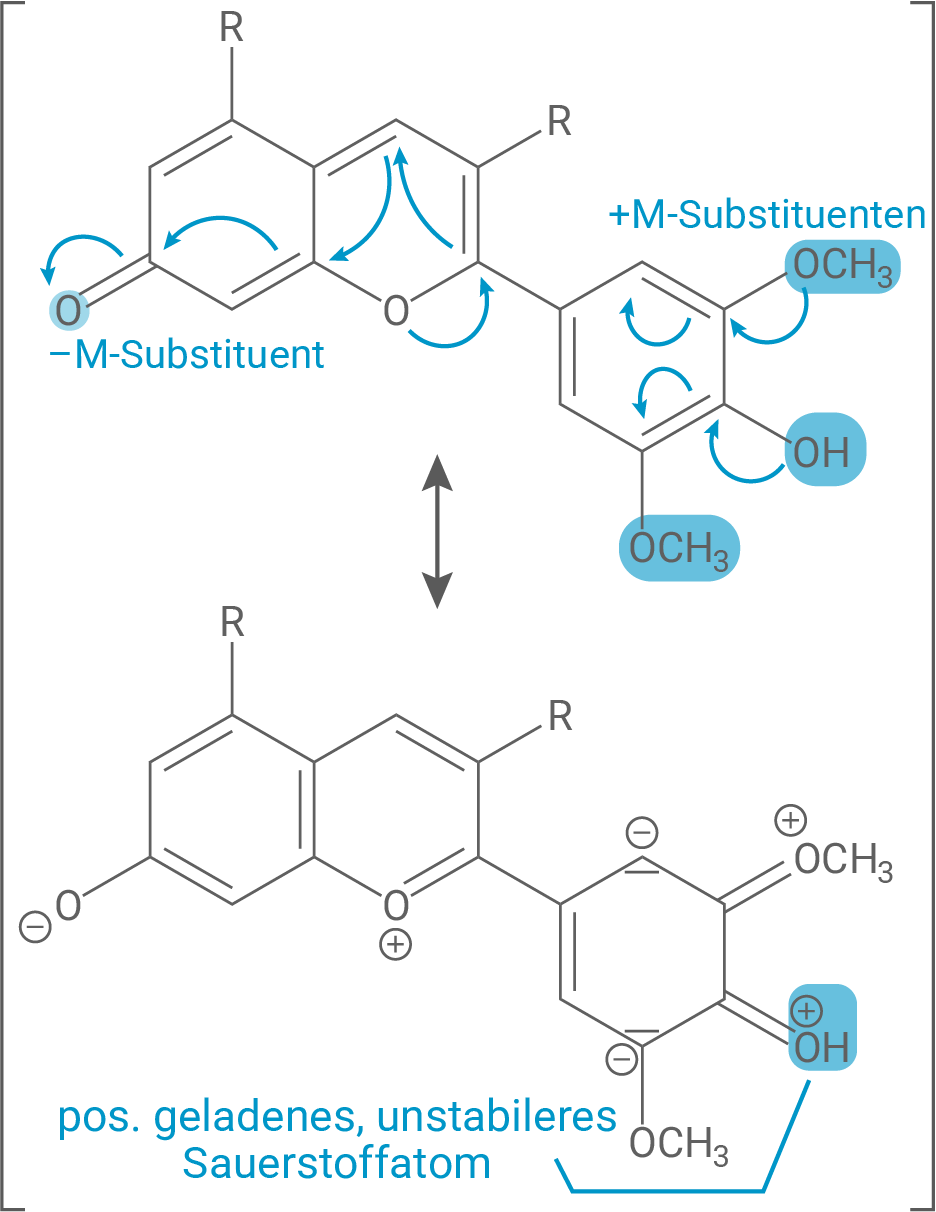
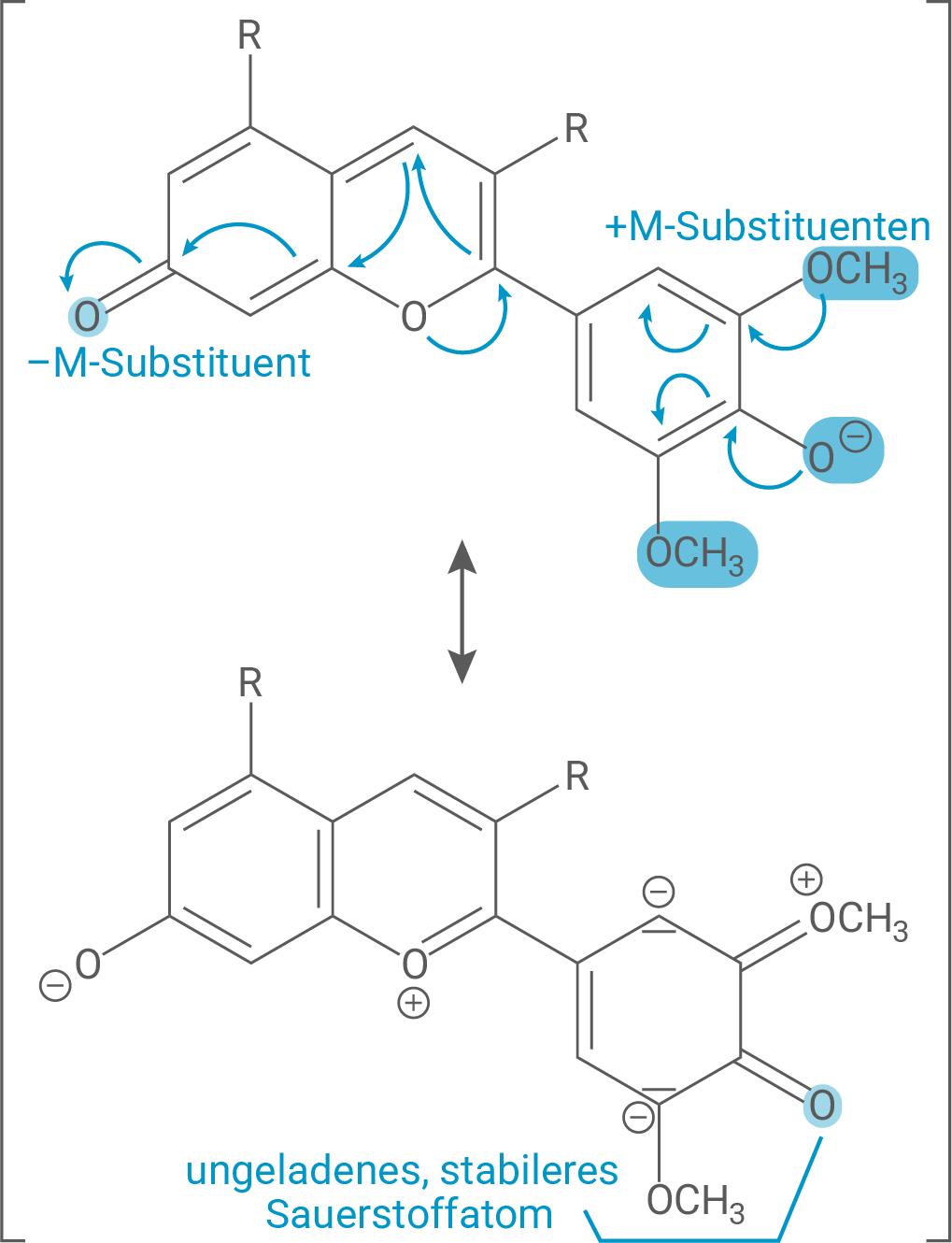
Ordne unter Verwendung von je einer zusätzlichen Grenzstrukturformel die Kurven A und B (Abb. 2) dem Malvin-Molekül bzw. dem Malvin-Anion zu und leite mithilfe von Tabelle 1 die Farben der beiden Stoffe ab. Betrachte dabei nicht nur die Länge des Chromophors, sondern auch Einflüsse der Substituenten auf die Güte der Delokalisierung.
Das Malvin-Molekül enthält bei den in Abbildung 1 mit R gekennzeichneten Molekülteilen je einen glykosidisch gebundenen Monosaccharid-Baustein (Abb. 3).

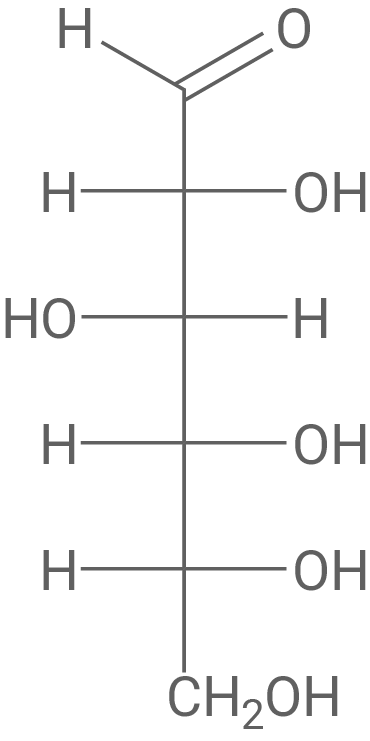
Formuliere die Fischer-Projektionsformel des Monosaccharids, das bei der sauren Hydrolyse von Malvin entsteht, und benenne dieses.
Beschreibe die Durchführung der Silberspiegel-Probe mit Malvin und formuliere eine Hypothese zu deren Ergebnis.
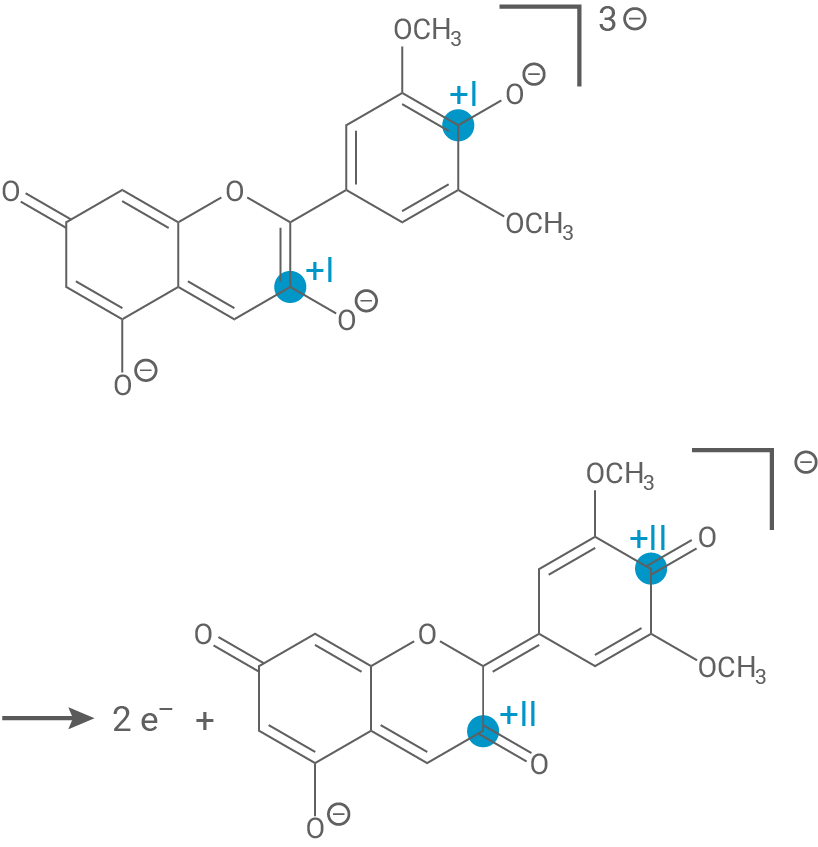
Wird Malvin hydrolysiert, entsteht Malvidin (Abb. 4), das im menschlichen Körper mit reaktiven Sauerstoffspezies wie z. B. Wasserstoffperoxid reagiert und so u. a. Schädigungen der DNA-Moleküle verhindert. Bei der Reaktion von Malvidin mit Wasserstoffperoxid entsteht Wasser und Malvon (Abb. 4).
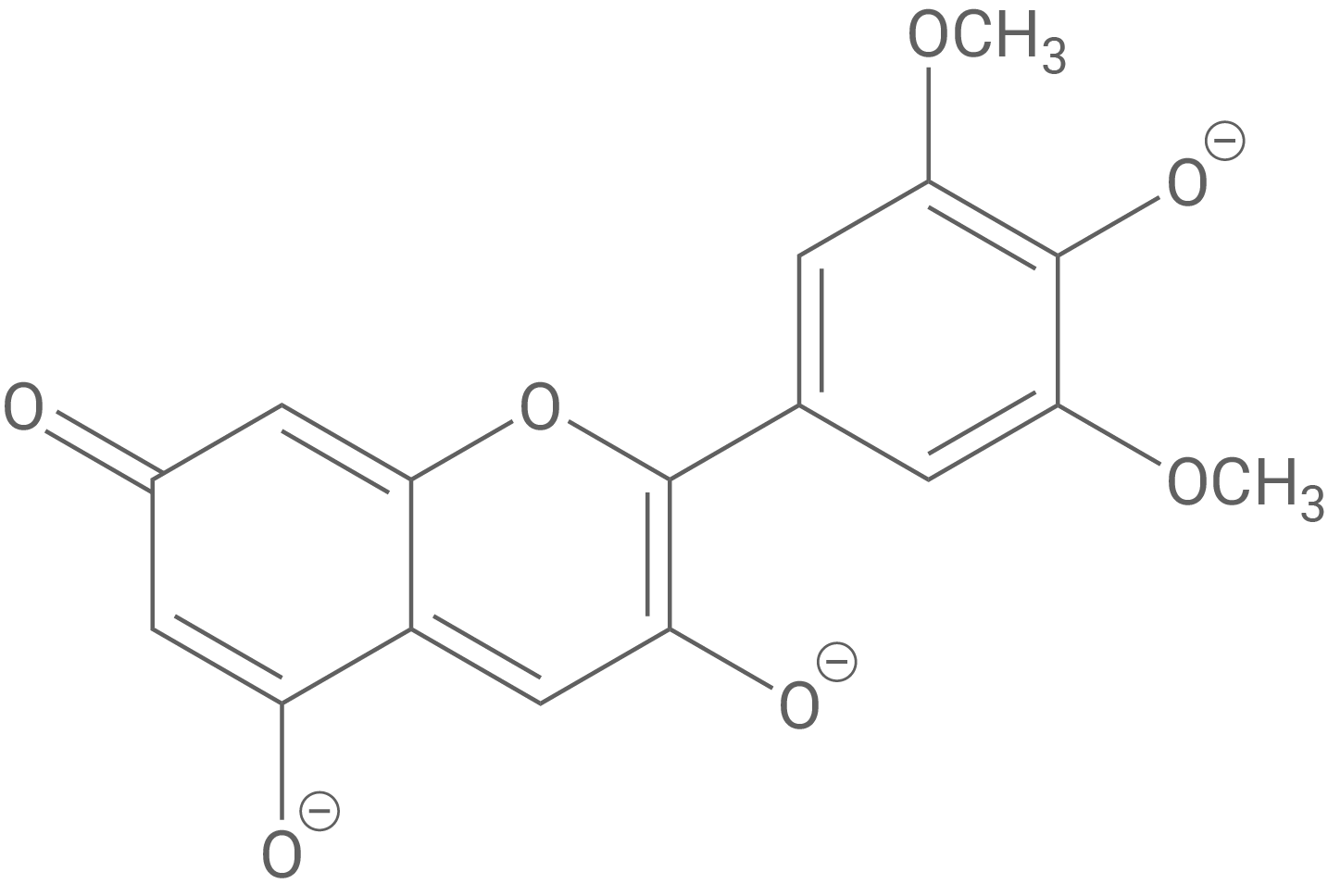
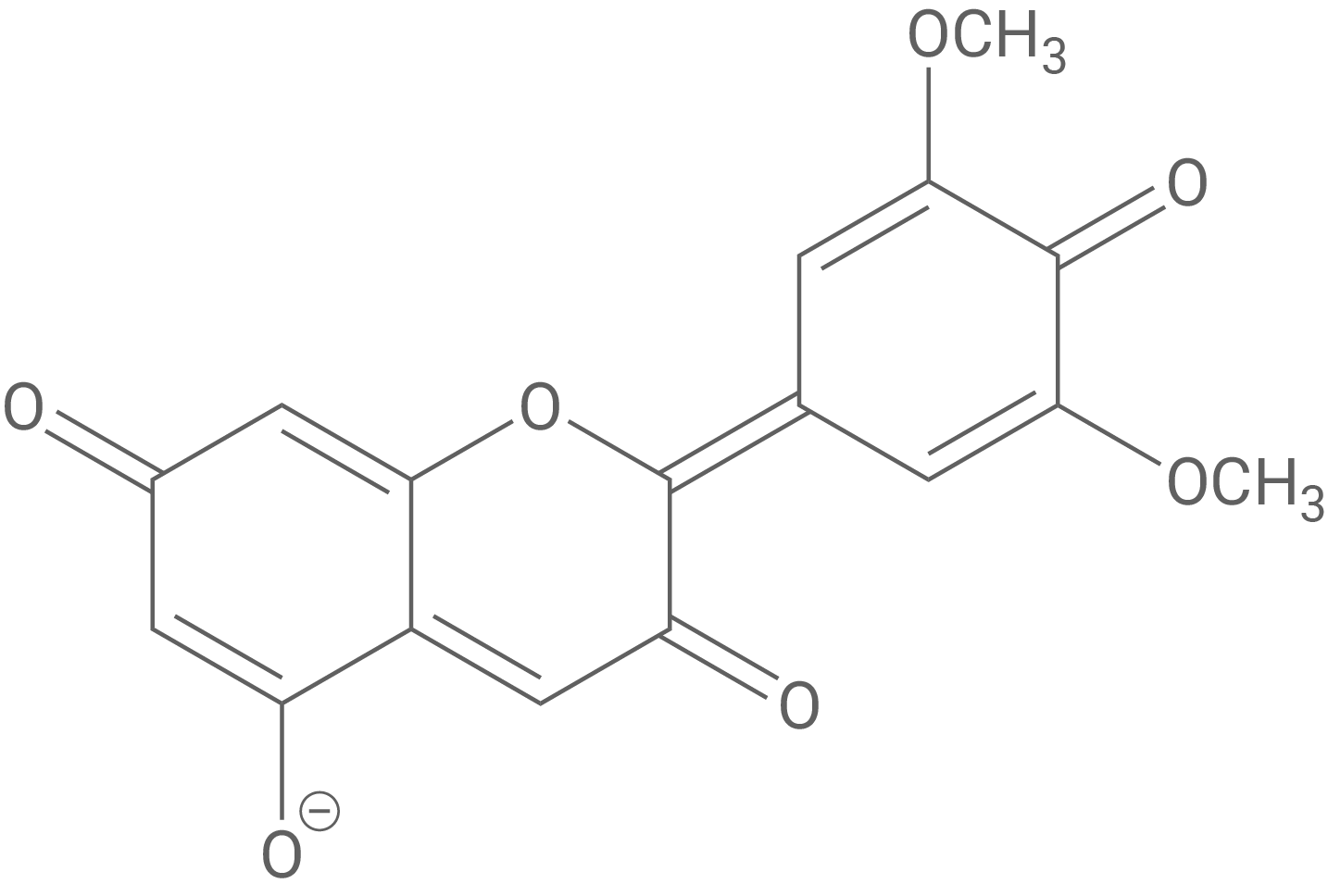
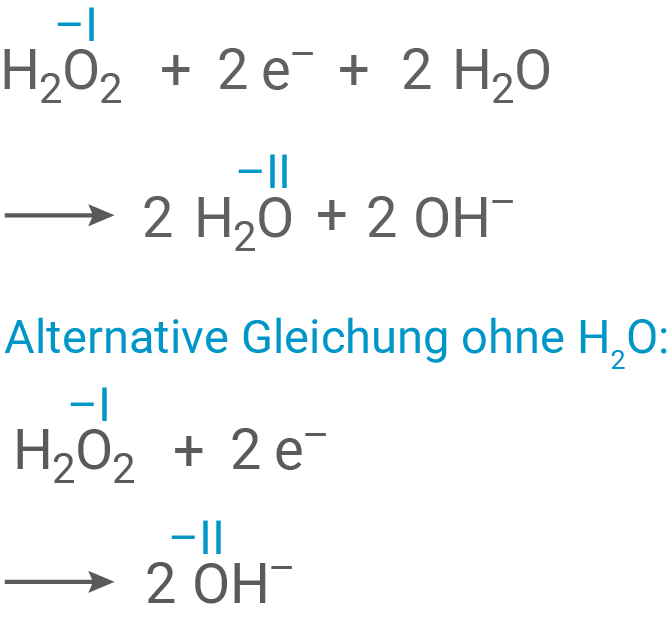
Formuliere die Teilgleichungen der Reaktion von Malvidin mit Wasserstoffperoxid in basischer Lösung.
Bei der Herstellung von Cremes aus Malvenextrakt können die wässrigen Anteile mit verschiedenen Fetten (Tab. 2) zu Emulsionen vermengt werden. Tabelle 3 zeigt die größten Anbaugebiete der zur Fettgewinnung genutzten Pflanzen.
Formuliere die Strukturformel eines chiralen Fett-Moleküls aus Erdnussfett und begründe dessen Chiralität.
Als Emulgator für Cremes kann u. a. Cetylalkohol (Hexadecan-1-ol) verwendet werden. Erkläre anhand der Strukturformel dessen Eignung als Emulgator.
Cremes werden häufig auf Basis von Erdnussfett hergestellt. Aufgrund der allergieauslösenden Wirkung empfiehlt das Bundesinstitut für Risikobewertung (BfR), die Verwendung von Erdnussfett zu vermeiden. Beurteile anhand von Tabelle 2 und 3 den Ersatz von Erdnussfett durch Haselnuss- oder Kokosfett sowohl unter Konsistenz- als auch Nachhaltigkeitsaspekten für eine in Deutschland produzierte Creme.
Quelle:
1 Dangles, O. O. & Fenger, J. (2018). The Chemical Reactivity of Anthocyanins and Its Consequences in Food Science and Nutrition. Molecules, 23(8), 1970.
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Zuordnung der Kurven
Die Größe der Chromophore beim Malvin-Molekül und beim Malvin-Anion sind gleich; Beide Teilchen absorbieren Licht im sichtbaren Bereich (VIS), was auf die Größe des delokalisierten -Elektronensystems zurückzuführen ist. Je größer das Chromophor, desto weniger Energie ist notwendig, um die Elektronen im System anzuregen. Das bedeutet, dass elektromagnetische Strahlung geringerer Energie, also niedrigerer Frequenz bzw. größerer Wellenlänge, vom System absorbiert wird. Das Chromophor erstreckt sich sowohl beim Malvin-Molekül als auch beim Malvin-Anion über das jeweils ganze Teilchen ununterbrochen über ein durchgehend konjugiertes delokalisiertes
-Elektronensystem.
Ein weiterer Effekt auf das Absorptionsverhalten und Hauptunterschied zwischen den hier betrachteten Molekülen ist der Einfluss der Substituenten auf die Güte der Delokalisierung:
Grundsätzlich können Substituenten das Chromophor vergrößern, wenn sie durch +M- oder −M-Effekte Elektronendichte in das System geben oder aus dem System ziehen können. Außerdem geht mit einem stärkeren +M- (bzw. auch −M-) Substituenten eine stärkere Delokalisierung von zusätzlichen Elektronen im konjugierten -Elektronensystem einher. Dies bedingt eine (stärkere) bathochrome Verschiebung, also eine Verschiebung der bevorzugt absorbierten Wellenlängen zu größeren Wellenlängen.
So besitzt sowohl Molekül als auch Anion als Substituenten eine Ketogruppe mit −M-Effekt und zwei Methoxygruppen mit +M-Effekt.
Das Malvin-Molekül besitzt nun eine Hydroxygruppe. Diese erweitert zwar das Chromophor und kann über +M-Effekt Elektronendichte in das System schieben, jedoch entsteht dadurch eine energetisch ungünstige, unstabile positive Ladung am Sauerstoffatom der Hydroxygruppe (siehe Grenzstrukturformel 1).
Beim Malvin-Anion hingegen ist genau diese Hydroxygruppe jedoch nun deprotoniert. Auch die deprotonierte Hydroxygruppe wirkt als +M-Substituent mit dem entscheidenden Unterschied, dass der elektronenschiebende Effekt hier deutlich stärker ist und das Sauerstoffatom beim Verschieben der Ladung ungeladen bleibt. Es entsteht lediglich eine vergleichsweise stabilere, negative Ladung an einem Kohlenstoffatom (siehe Grenzstrukturformel 2), welche im konjugierten π-Elektronensystem gut stabilisiert werden kann.
Je mehr stabile Grenzstrukturformeln es bei einem Chromophor gibt, wird analog zur Chromophorgröße weniger Energie notwendig, um die Elektronen im System anzuregen. Die gleiche Aussage kann über Substituenten mit stärkeren M-Effekten getätigt werden. Das bedeutet, dass elektromagnetische Strahlung geringerer Energie, also niedrigerer Frequenz bzw. größerer Wellenlänge, vom System absorbiert wird.
Aus diesen Gründen lässt sich das Malvin-Anion mit einem etwas stabileren Substituenteneinfluss zur Kurve B zuordnen, wo das Absorptionsmaximum bei einer größeren Wellenlänge liegt.
Das Malvin-Molekül gehört hingegen zu Kurve A.
Ableitung der Farben
Das Malvin-Molekül (Kurve A) besitzt ein Absorptionsmaximum um (Absorption im gelbgrünen Bereich). Nach Tabelle 1 erscheint der Farbstoff daher purpur.
Das Malvin-Anion (Kurve B) besitzt ein Absorptionsmaximum im Bereich von etwa oder höher (Absorption im orangen bis roten Bereich). Folglich erscheint die Lösung blau bis blaugrün.
Fischer-Projektionsformel des Monosaccharids
Durchführung der Silberspiegel-Probe
- Reagenz ansetzen: klare, ammoniakalische Silbernitrat-Lösung herstellen, also
-Lösung mit
-Lösung versetzen, bis sich der braune
-Niederschlag wieder löst. Hierbei entsteht der lösliche Diamminsilber(I)-komplex
- Probe vorbereiten: wenige Milliliter der Malvin-Lösung zugeben, sauber gespültes Reagenzglas verwenden.
- Erwärmen: vorsichtig im warmen Wasserbad schwenken, Glaswand nicht mit den Fingern berühren, saubere Oberfläche ist wichtig.
- Positivkontrolle: parallel eine Glucose-Lösung prüfen, sie dient als Referenz für einen positiven Silberspiegel.
Hypothese zum Ergebnis
Bei einer positiven Reaktion würde sich elementares Silber an der Glaswand abscheiden und einen glänzenden Spiegel bilden (wie bei der Kontrolle mit der reduzierenden Glucose). Im Falle von Malvin ist ein solches Ergebnis jedoch nicht zu erwarten. Der Grund liegt darin, dass die in Malvin vorhandenen Zuckerreste über ihre anomeren C-Atome glykosidisch gebunden sind und somit keine freien Aldehydgruppen vorliegen. Daraus folgt, dass ein reduzierendes Ende, wie es bei freien Monosacchariden vorhanden ist, hier fehlt.
Redoxteilgleichungen der Reaktion von Malvidin mit Wasserstoffperoxid
Reduktion:
Oxidation:
Chirales Fett-Molekül aus Erdnussfett
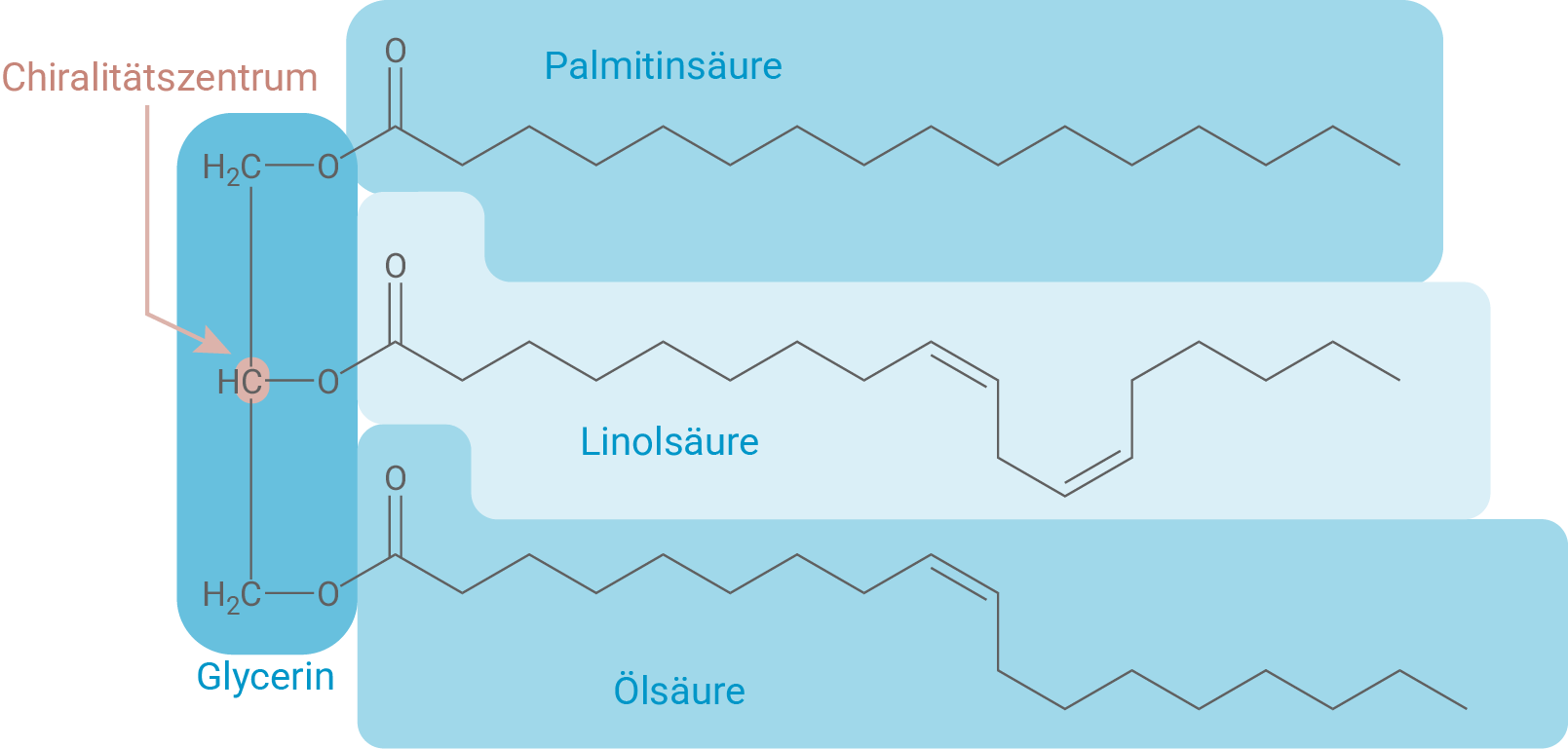
Hinweis: Zur Erreichung der vollen Punktzahl ist eine alternative Kombination dreier im Erdnussfett üblicher Fettsäuren für das Fett-Molekül zulässig, solange das Stereozentrum erhalten bleibt, die Fettsäuren an den Enden sich also unterscheiden.
Cetylalkohol und dessen Eignung als Emulgator

Beurteilung des Erdnussfett-Ersatzes
Bei der Herstellung einer Creme auf Basis von Erdnussfett stellt sich die Frage nach geeigneten Ersatzstoffen, da Erdnussfett wegen seiner allergenen Wirkung problematisch ist. Ein Vergleich der Fettsäurezusammensetzungen zeigt, dass Erdnussfett vor allem aus Ölsäure und Linolsäure
besteht und damit überwiegend ungesättigte Fettsäuren enthält. Dadurch ist es bei Raumtemperatur flüssig bis halbfest und eignet sich gut als Grundlage für Cremes.
Haselnussfett weist eine sehr ähnliche Zusammensetzung auf, mit einem besonders hohen Anteil an Ölsäure und einem mittleren Anteil an Linolsäure
Aufgrund dieser Ähnlichkeit sind Konsistenz und physikalische Eigenschaften von Haselnussfett mit denen von Erdnussfett vergleichbar. Damit kann Haselnussfett als nahezu gleichwertiger Ersatz eingesetzt werden. Nachhaltigkeitsaspekte sprechen ebenfalls für Haselnüsse, da ein wesentlicher Teil der weltweiten Produktion in Europa (Türkei, Italien) stattfindet, sodass Transportwege nach Deutschland vergleichsweise kurz sind.
Kokosfett hingegen unterscheidet sich deutlich: Es enthält sehr hohe Anteile an gesättigten Fettsäuren, vor allem Laurin- und Myristinsäure
Dadurch ist es bei Raumtemperatur fest und besitzt eine wachsartige Konsistenz. Würde es Erdnussfett ersetzen, so hätte die Creme eine wesentlich festere Konsistenz und müsste in der Formulierung entsprechend angepasst werden. Auch unter Nachhaltigkeitsaspekten ist Kokosfett weniger günstig, da es überwiegend in tropischen Regionen wie Indonesien und den Philippinen produziert wird und daher lange Transportwege anfallen.
Insgesamt ist Haselnussfett der geeignetere Ersatz für Erdnussfett, da es ähnliche Konsistenzeigenschaften bietet und zugleich nachhaltiger verfügbar ist. Kokosfett unterscheidet sich dagegen stark in den physikalischen Eigenschaften und ist aufgrund seiner Herkunft ökologisch weniger vorteilhaft.