C2 Antiseptika
Hinweis: In der Prüfung musst du von den Aufgabenblöcken A, B und C jeweils einen der beiden Vorschläge 1 oder 2 bearbeiten.
Antiseptika sind chemische Stoffe, die in der Medizin zur Verhinderung von Wundinfektionen eingesetzt werden.
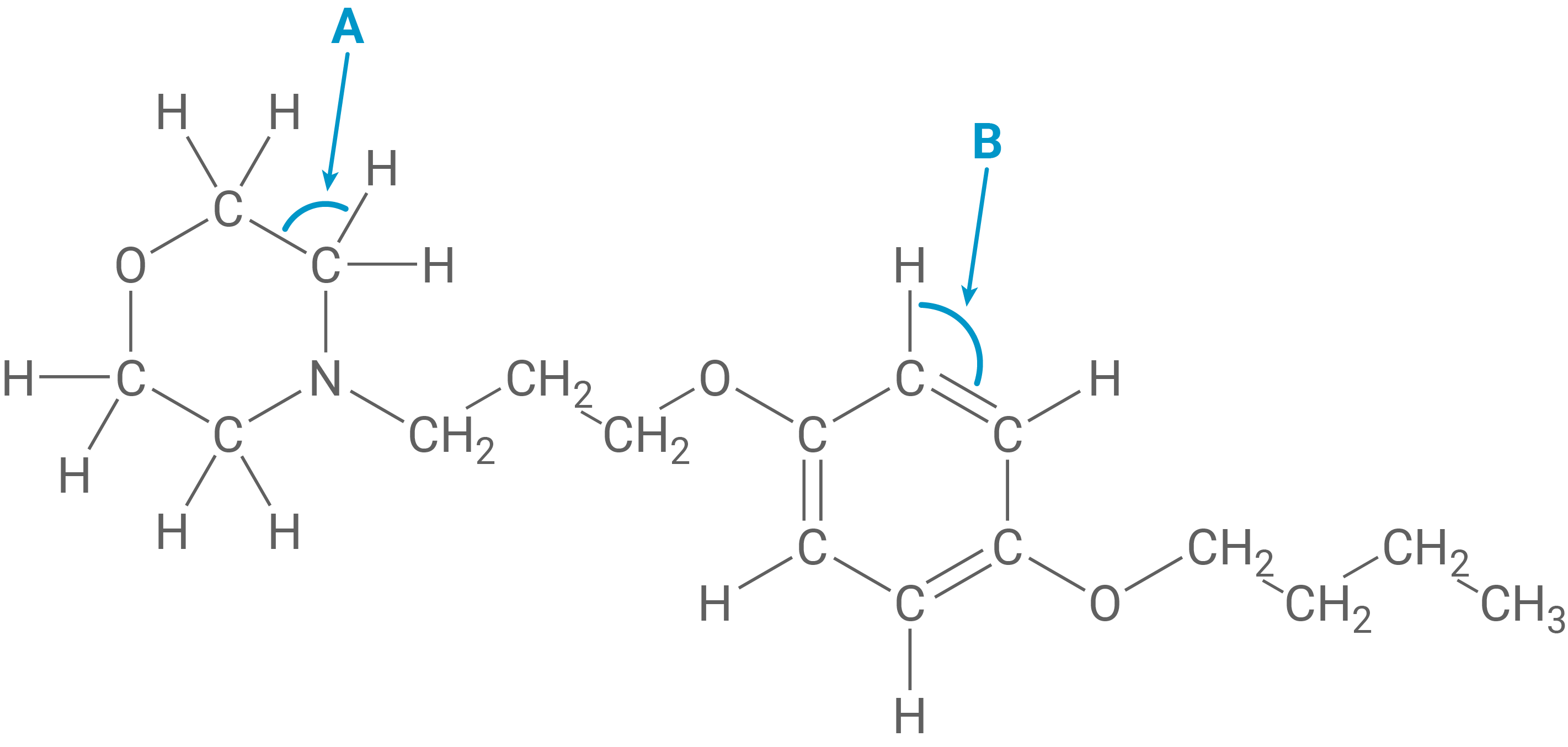
Zur Behandlung von oberflächlichen Schürfwunden können sog. Wund- und Heilsalben eingesetzt werden. Diese enthalten neben antiseptisch wirkenden Substanzen wie Chlorhexidin (Abb. 1) manchmal auch Wirkstoffe wie Pramocain (Abb. 2), die schmerzlindernd wirken.
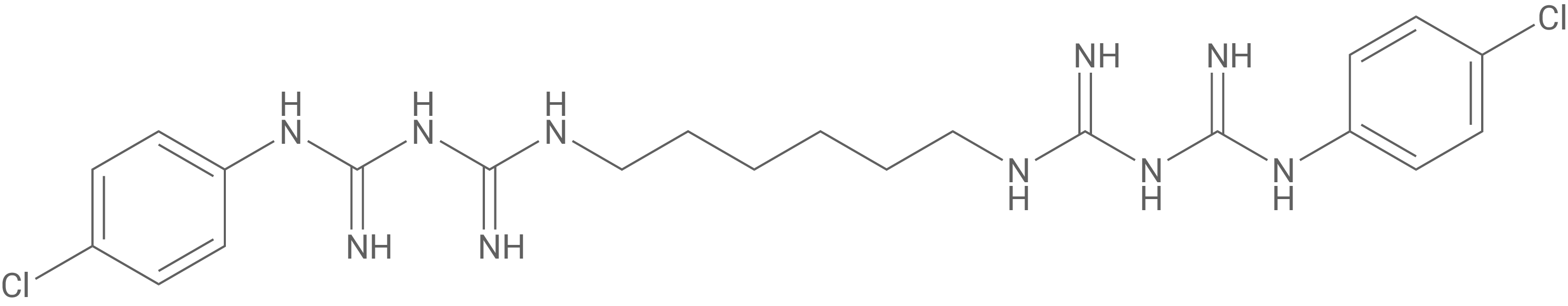
Im ersten Schritt der Synthese von Chlorhexidin (Abb. 1) wird Benzol zu Chlorbenzol umgesetzt. Formuliere für diesen Reaktionsschritt den Reaktionsmechanismus.
Schätze die Größe der beiden markierten Bindungswinkel A und B im Pramocain-Molekül (Abb. 2) ab und begründe deine Angabe.
Auch Iod kann zur Desinfektion von Wunden eingesetzt werden. Früher wurde dazu u. a. Lugolsche Lösung verwendet. Dabei handelt es sich um eine Mischung aus in Wasser gelöstem Kaliumiodid und Iod. In der Lösung stellt sich das folgende Gleichgewicht ein:
Die Bildung des Triiodid-Anions verläuft exergonisch.
Leite für die Enthalpieänderung und die Entropieänderung
dieser Reaktion jeweils ab, ob deren Werte größer oder kleiner Null sind.
In einem Experiment wurden die Gleichgewichtskonzentrationen der verschiedenen Iod-Spezies des oben angegebenen Gleichgewichts in verdünnter und unverdünnter Lugolscher Lösung bei sonst gleichen Bedingungen ermittelt.
| Konzentration in mol/L | ||
| Lugolsche Lösung, unverdünnt |
Lugolsche Lösung, 1:100 verdünnt |
|
| Iodid | ||
| Iod | ||
| Triiodid | ||
Berechne die Gleichgewichtskonstante für das Iod-Iodid-Triiodid-Gleichgewicht der beiden angegebenen Lösungen.
Interpretiere das Ergebnis deiner Berechnungen.
Ein unter dem Namen Povidon-Iod erhältliches Antiseptikum enthält den Kunststoff PVP (Polyvinylpyrrolidon), der aus Vinylpyrrolidon (Abb. 3) hergestellt wird. Wird PVP Lugolscher Lösung zugesetzt, so bildet sich Povidon-Iod. In diesem Molekül wechseln sich Abschnitte mit und ohne gebundene Triiodid-Anionen ab (Abb. 4).
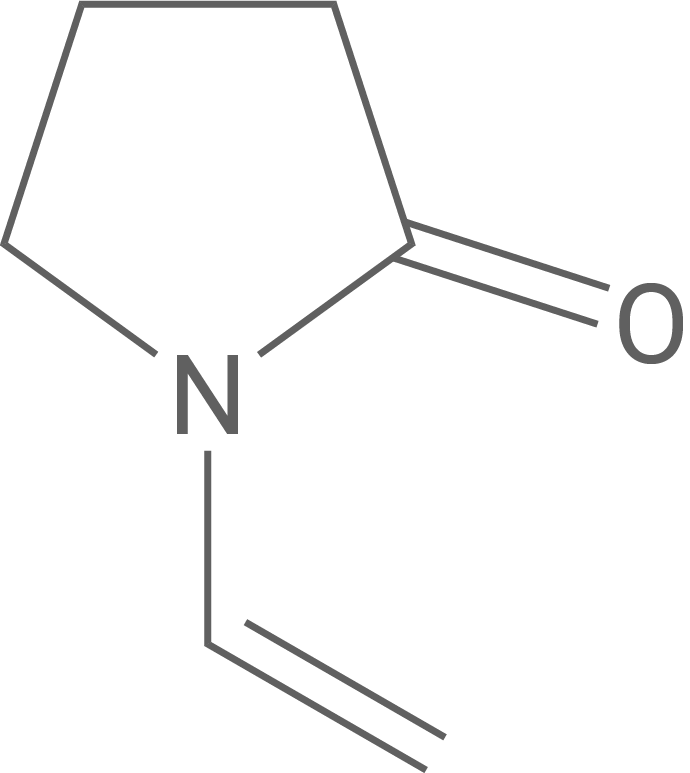
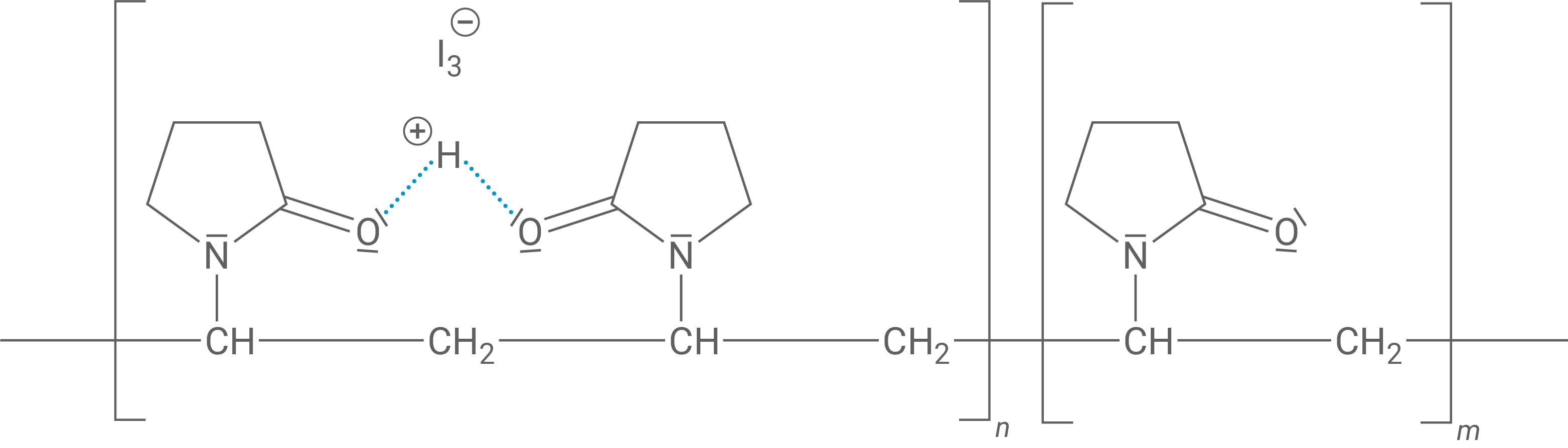
Abhängig von den Reaktionsbedingungen lässt sich PVP mit verschiedenen mittleren Molekülmassen herstellen, was sich auf die physikalischen Eigenschaften auswirkt.
Der K-Wert ist dabei eine Größe, mithilfe derer die mittlere Molekülmasse der PVP-Moleküle beschrieben werden kann. Je größer dieser Wert ist, desto größer ist die mittlere Molekülmasse.
Formuliere ausgehend von einem Startermolekül den Reaktionsmechanismus der Synthese von PVP. Erkläre eine Möglichkeit zur Steuerung des K-Werts bei der Synthese.
Durch den Zusatz eines zweiten Monomers (Abb. 5) zu Vinylpyrrolidon kann der Kunststoff Crospovidon synthetisiert werden, der zur Herstellung eines antiseptischen Puders verwendet wird.
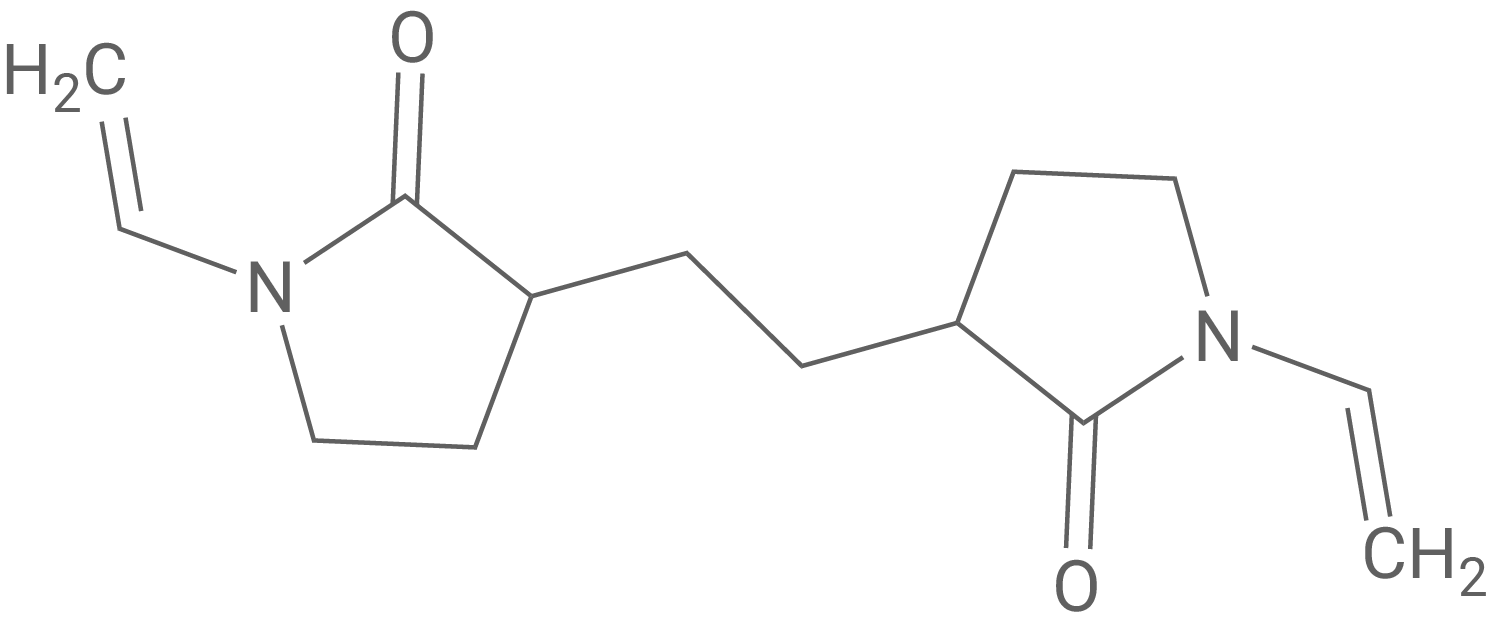
Formuliere je eine Hypothese zum Verhalten von Crospovidon sowie PVP beim Erhitzen.
PVP wird auch zur Herstellung von Gelen mit unterschiedlicher Viskosität verwendet. Je höher die Viskosität ist, desto dickflüssiger ist eine Flüssigkeit.
Erkläre den Zusammenhang zwischen der Viskosität des Gels und dem K-Wert des eingesetzten PVP bei ansonsten gleichen Bedingungen.
Quelle:
1 Themes, U. (2021). Iodine and Iodine-Containing Compounds. Basicmedical
Key. https://basicmedicalkey.com/iodine-and-iodine-containing-compounds/,
aufgerufen am 01.10.24.
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Reaktionsmechanismus im ersten Schritt der Chlorhexidinsynthese
Bei der betrachteten Reaktion von Benzol zu Chlorbenzol handelt es sich um eine elektrophile aromatische Substitution.
Schritt 1:
Im ersten Schritt erfolgt die Erzeugung des Elektrophils. Aluminiumchlorid dient hier als Katalysator und über Reaktion als Lewis-Säure (Elektronenpaarakzeptor) aktiviert und polarisiert er das Elektrophil aus Chlor.
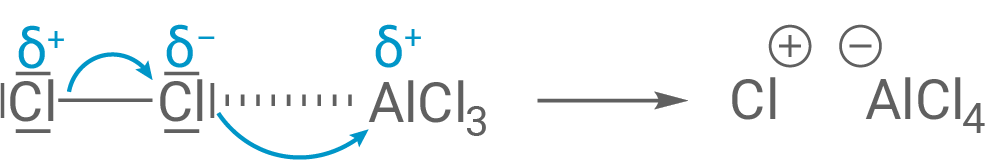
Schritt 2:
Das Elektrophil lagert sich erst über einen π-Komplex an Benzol an und reagiert unter Bildung eines σ-Komplexes daran. Dabei kommt es zum Aufbrechen der Aromatizität im Benzol.
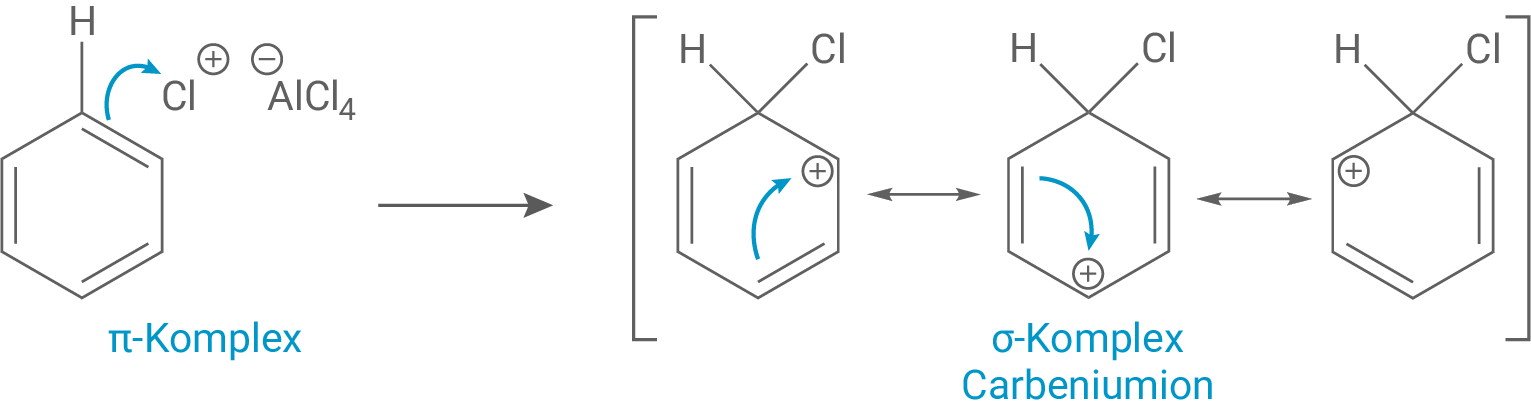
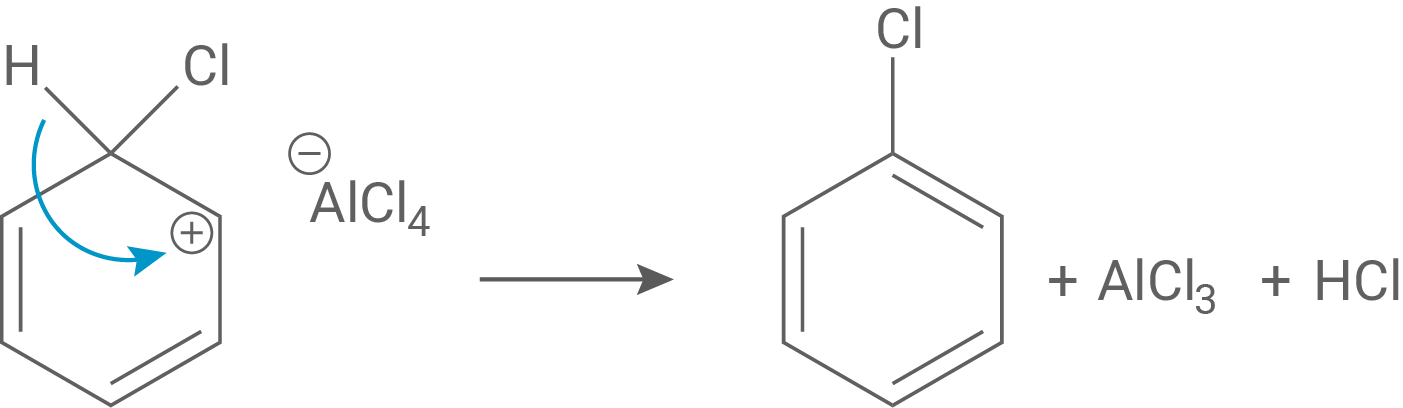
Schritt 3:
Als letztes reagiert das Intermediat im letzten Schritt als Brönsted-Säure und gibt somit ein Proton ab, wobei es zur Rearomatisierung kommt.
Der Katalysator ist zudem nun auch regeneriert.
Bindungswinkel im Pramocain-Molekül
Die beiden markierten Bindungswinkel im Pramocain-Molekül lassen sich über die Hybridisierung der beteiligten Atome erklären. Winkel A befindet sich an einem sp3-hybridisierten Kohlenstoffatom. Daraus ergibt sich ein Bindungswinkel von etwa eventuell etwas kleiner, da die freien Elektronen des benachbarten Stickstoffs die Bindungswinkel leicht verkleinern.
Winkel B liegt an einem Kohlenstoffatom des aromatischen Rings, das sp2-hybridisiert ist. In dieser trigonal-planaren Umgebung beträgt der Winkel
Reaktionsenthalpie und -entropie bei der Bildung des Triiodid-Anions
Mithilfe der Gibbs-Helmholtz-Gleichung wird ersichtlich, für welche Werte der Enthalpie- und Entropieänderung die betrachtete Reaktion exergonisch verläuft:
Hierbei zeigt die freie Reaktionsenthalpie an, ob die betrachtete Reaktion exergonisch ist:
Da es zur Verringerung der Anzahl freier Teilchen kommt, verringert sich auch die Entropie und somit ist negativ. Um trotzdem einen positiven Wert für
zu erreichen, muss
nun auch einen negativen Wert besitzen.
Sowohl die Enthalpie- als auch Entropieänderung besitzen somit einen Wert kleiner als null, wobei der exotherme Effekt dominieren muss, damit die Gesamtreaktion exergonsich ist; der
-Term muss betragstechnisch größer sein als der
-Term.
Gleichgewichtskonstante der unverdünnten Lugolschen Lösung
Gleichgewichtskonstante der verdünnten Lugolschen Lösung
Interpretation der Berechnungen
Die Berechnungen zeigen, dass beide Lösungen die gleiche Gleichgewichtskonstante besitzen. Dies bestätigt, dass eine eigenschaftsspezifische Größe ist, die unter gleichen Bedingungen unabhängig von den Anfangskonzentrationen bleibt. Die Tatsache, dass
deutlich größer als 1 ist, deutet darauf hin, dass die Bildung des Triiodid-Anions
thermodynamisch begünstigt ist. Dies bestätigt weiterhin die Aussage, dass die Bildung des Triiodid-Anions exergonisch ist.
Mechanismus der PVP Synthese
Schritt 1: Initiation (Start)

Schritt 2: Elongation (Kettenverlängerung)
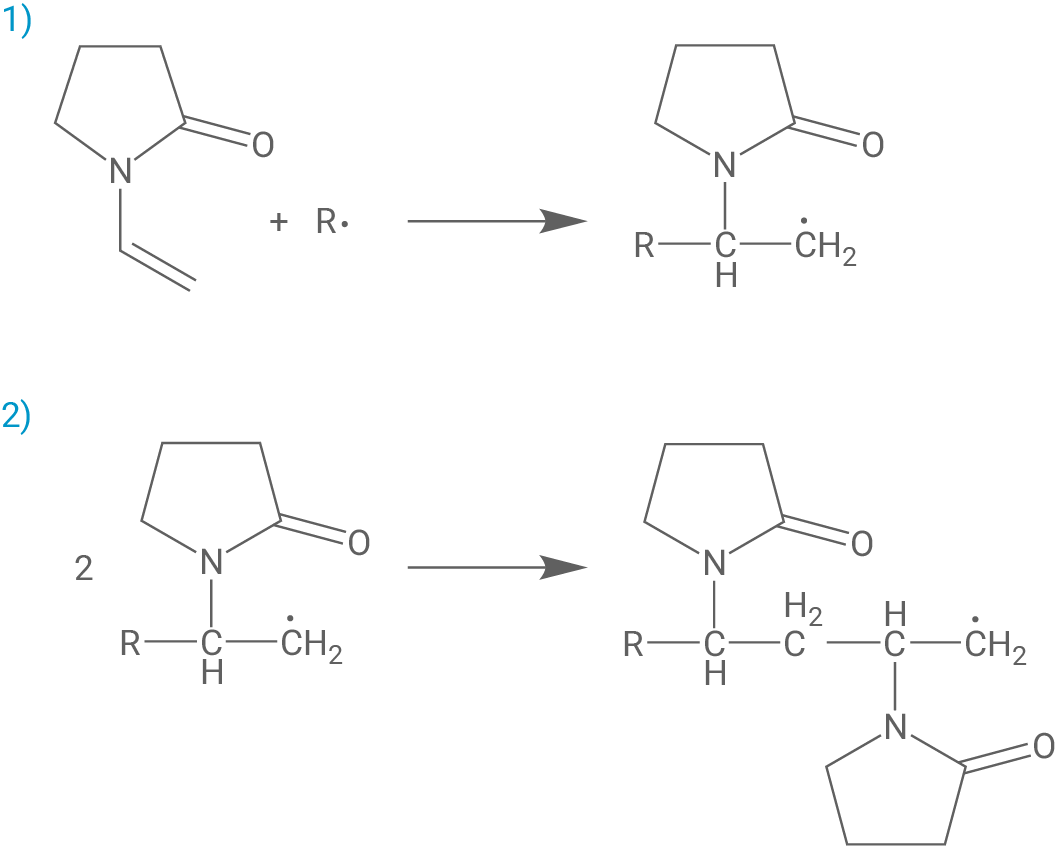
Schritt 3: Termination (Kettenabbruch)
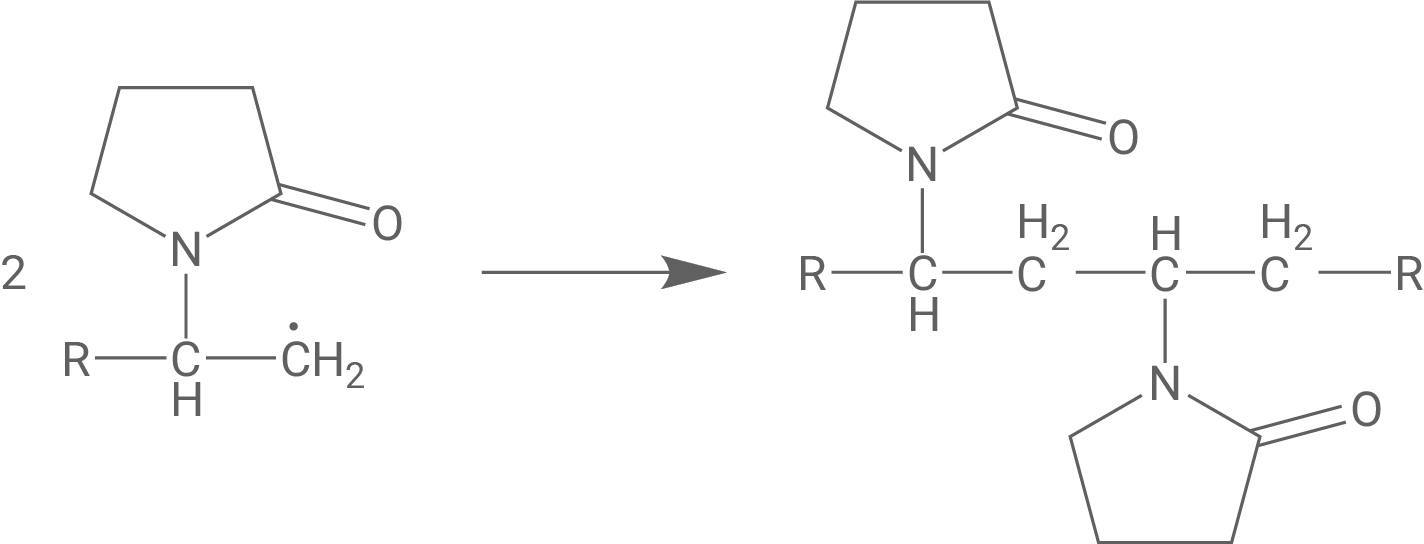
Hinweis: Zur Erreichung der vollen Punktzahl können auch andere Abbruchreaktionen gewählt werden, bei denen zwei Radikale zusammen zu einem nicht-radikalischen Produkt reagieren.
Steuerung des K-Werts
Eine Möglichkeit der Steuerung des K-Werts ist die Variation der Starterkonzentration: Eine höhere Konzentration von Starterradikalen erzeugt mehr Startpunkte, wodurch die Polymerketten kürzer werden und der K-Wert sinkt. Eine geringere Starterkonzentration führt zu längeren Ketten und einem höheren K-Wert. Alternativ können auch Reaktionstemperatur, Monomerkonzentration oder Kettenübertragungsmittel eingesetzt werden, um den K-Wert gezielt einzustellen.
Eine höhere Temperatur erhöht die Geschwindigkeit der Radikalbildung und der Kettenpropagation, kann aber auch die Kettenabbruchrate erhöhen, was zu einer Verkleinerung der Kettenlänge führt. Eine höhere Monomerkonzentration ermöglicht längere Kettenwachstumsphasen, da mehr Monomere pro Kettenstart vorhanden sind, wodurch der K-Wert steigt. Schließlich kann der Einsatz von Kettenübertragungsmitteln die Kettenlängen gezielt reduzieren, da sie Radikale von wachsenden Ketten auf andere Moleküle übertragen und damit die durchschnittliche Polymerkettenlänge verringern.
Erhitzen von Crospovidon
Beim Erhitzen zeigt Crospovidon ein stabiles Verhalten, da es sich um ein quervernetztes Polymer handelt. Während der Polymerisation können die beiden Doppelbindungen im Monomer reagieren und Vernetzungen zwischen den Polymerketten bilden. Diese Vernetzungen verhindern, dass Crospovidon bei höheren Temperaturen schmilzt oder seine Form verändert, sodass es fest und unverformbar bleibt. Dies passt zum Profil eines Duroplasten.
Erhitzen von PVP
Im Gegensatz dazu ist PVP ein lineares Polymer ohne Vernetzungen. Beim Erwärmen werden die Ketten beweglicher, da die nicht-kovalenten Wechselwirkungen zwischen den Polymerketten überwunden werden. Dadurch wird PVP weich und schmilzt, wobei die Polymerketten weiterhin intakt bleiben und sich bei Abkühlen wieder verfestigen. PVP lässt sich so zu den Thermoplasten zählen.
Viskosität eines Gels mit PVP in Abhängigkeit des K-Werts
Je höher der K-Wert ist, desto länger sind die Polymerketten. Dies erhöht die Reibung innerhalb der Flüssigkeit und damit die Viskosität des Gels. Bei ansonsten gleichen Bedingungen führt also die Verwendung von PVP mit höherem K-Wert zu einem dickflüssigeren Gel, während PVP mit niedrigem K-Wert ein flüssigeres Gel ergibt.