B2 Oxytocin
Hinweis: In der Prüfung musst du von den Aufgabenblöcken A, B und C jeweils einen der beiden Vorschläge 1 oder 2 bearbeiten.
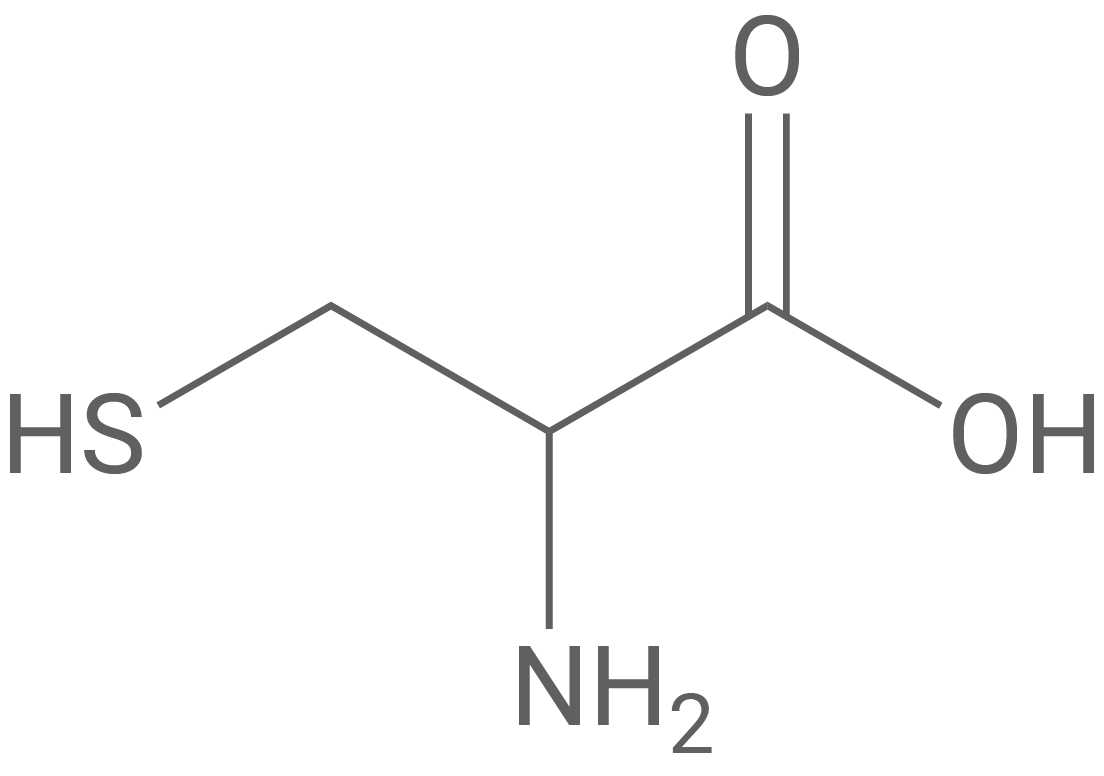
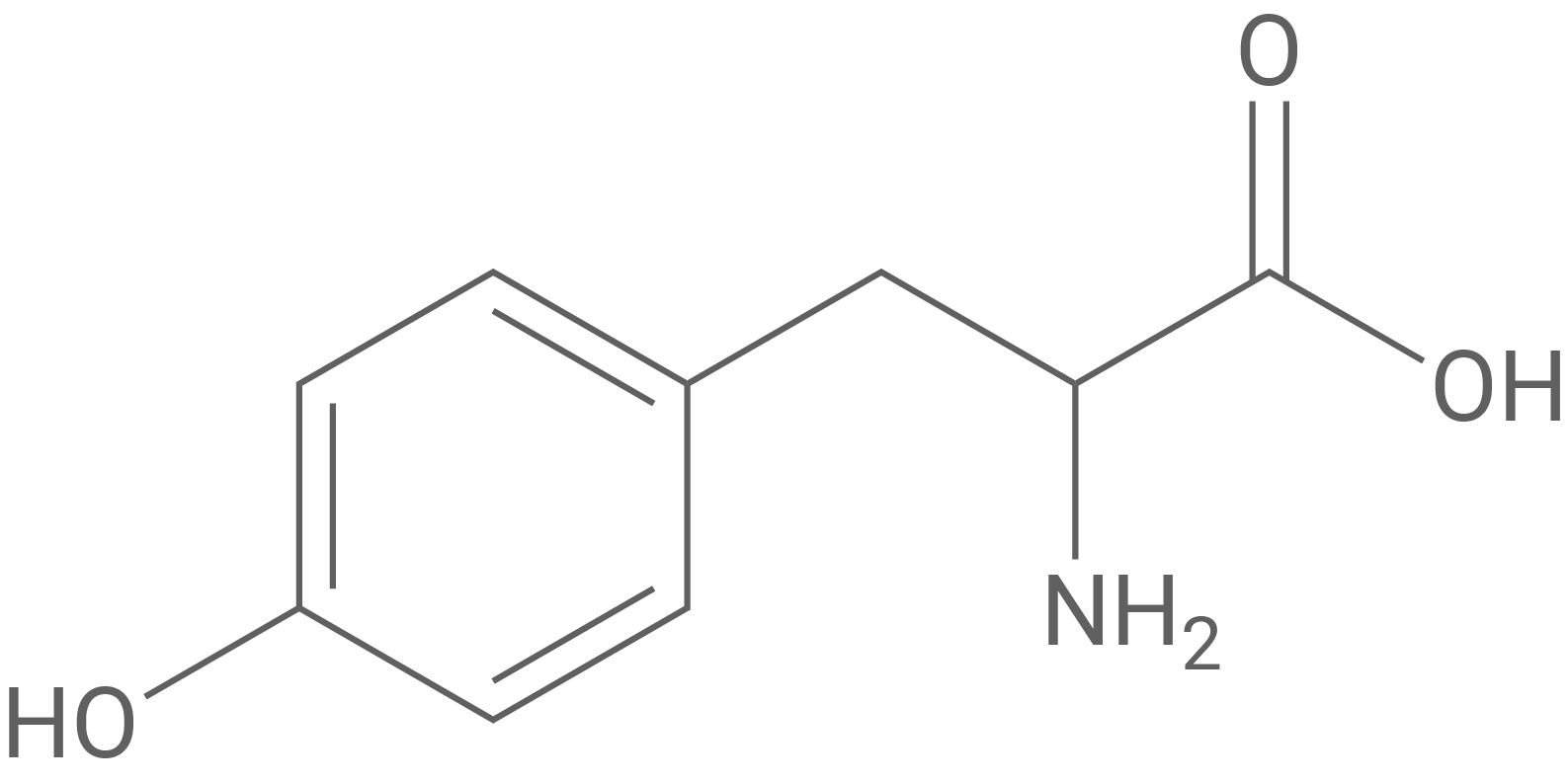
Oxytocin ist ein Peptid-Hormon, das im Gehirn gebildet wird und durch das körpereigene Enzym Oxytocinase wieder abgebaut werden kann. Es ist aus acht verschiedenen Aminosäure-Bausteinen aufgebaut (Tab. 1).
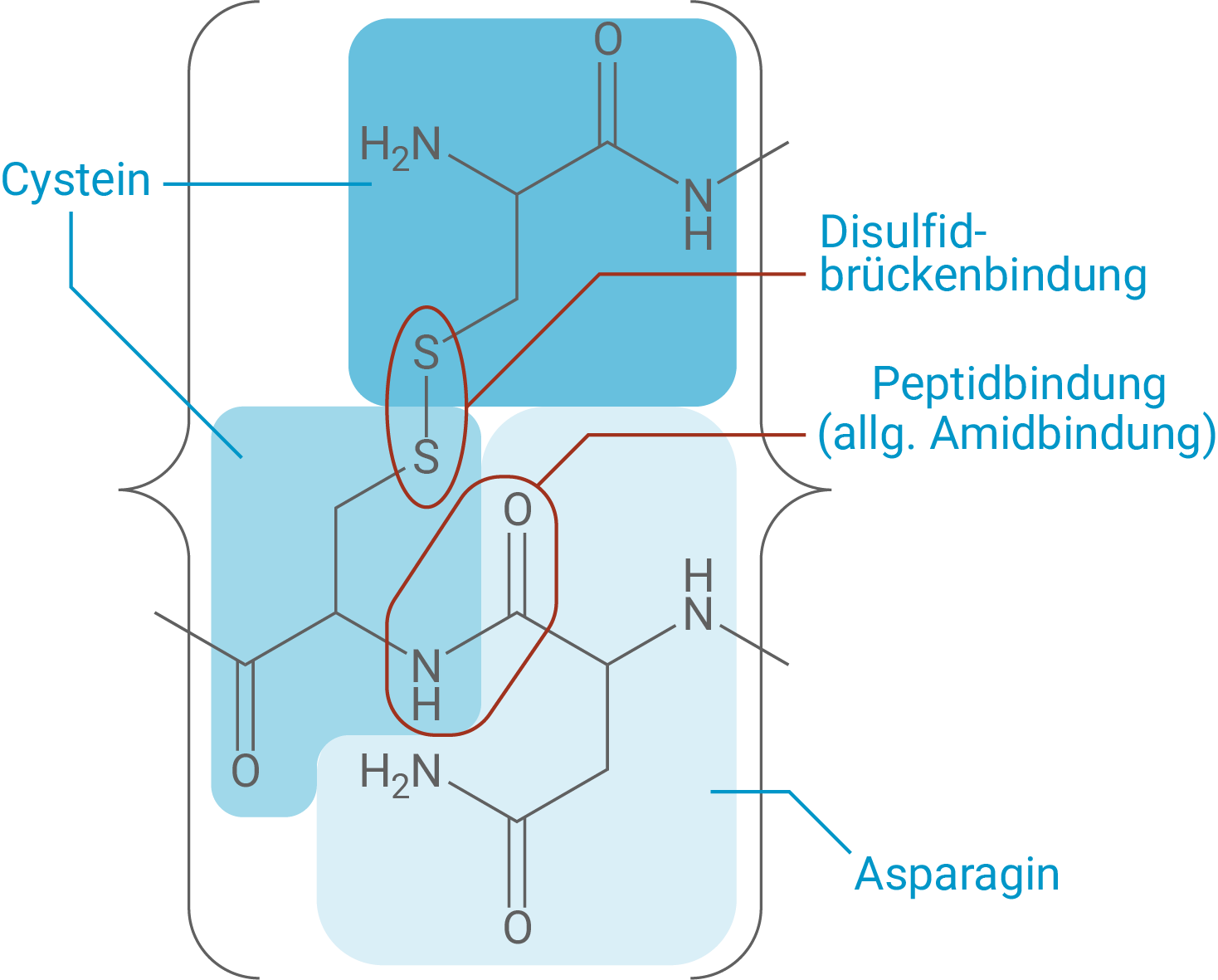
In Abbildung 1 ist eine modellhafte Darstellung des 1953 erstmals künstlich synthetisierten Oxytocin-Moleküls gezeigt.
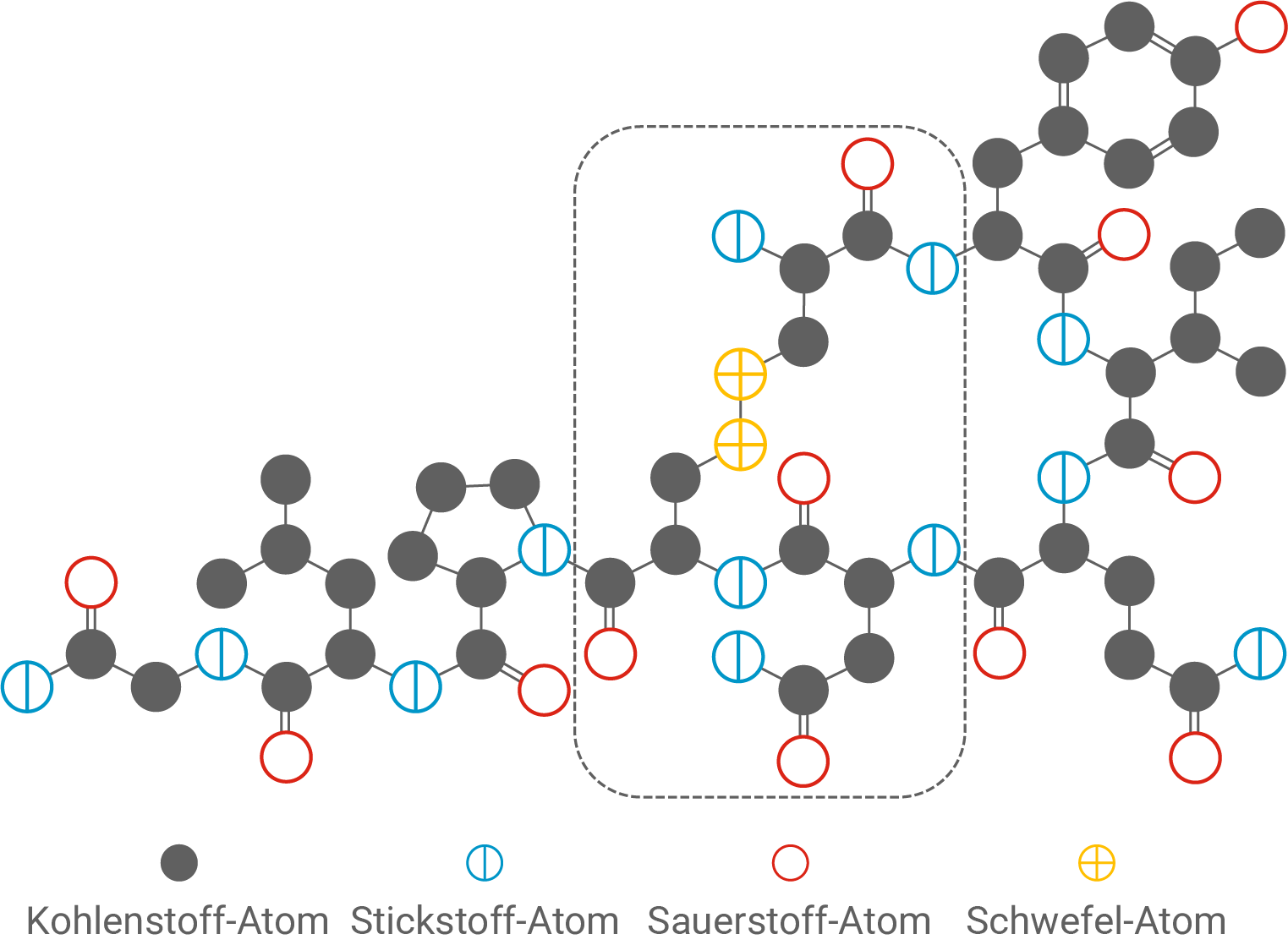
Formuliere den in Abbildung 1 markierten Ausschnitt des Oxytocin-Moleküls als Strukturformelausschnitt und benenne die enthaltenen Aminosäure-Bausteine mithilfe von Tabelle 1. Benenne auch die verschiedenen Bindungstypen zwischen den Aminosäure-Bausteinen.
Beschreibe die Durchführung und das zu erwartende Ergebnis eines Experiments zum Nachweis des Proteincharakters von Oxytocin.
Durch das Enzym Oxytocinase erfolgt ein hydrolytischer Abbau von Oxytocin zu einem Aminosäuregemisch.
Zur Auftrennung dieses Aminosäuregemisches wird das Hydrolyseprodukt auf ein Trägergel aufgebracht, in dem zuvor ein pH-Gradient erzeugt wurde. Anschließend wird an das Gel eine Gleichspannung angelegt. Das Ergebnis dieser sogenannten isoelektrischen Fokussierung ist in Abbildung 2 dargestellt.
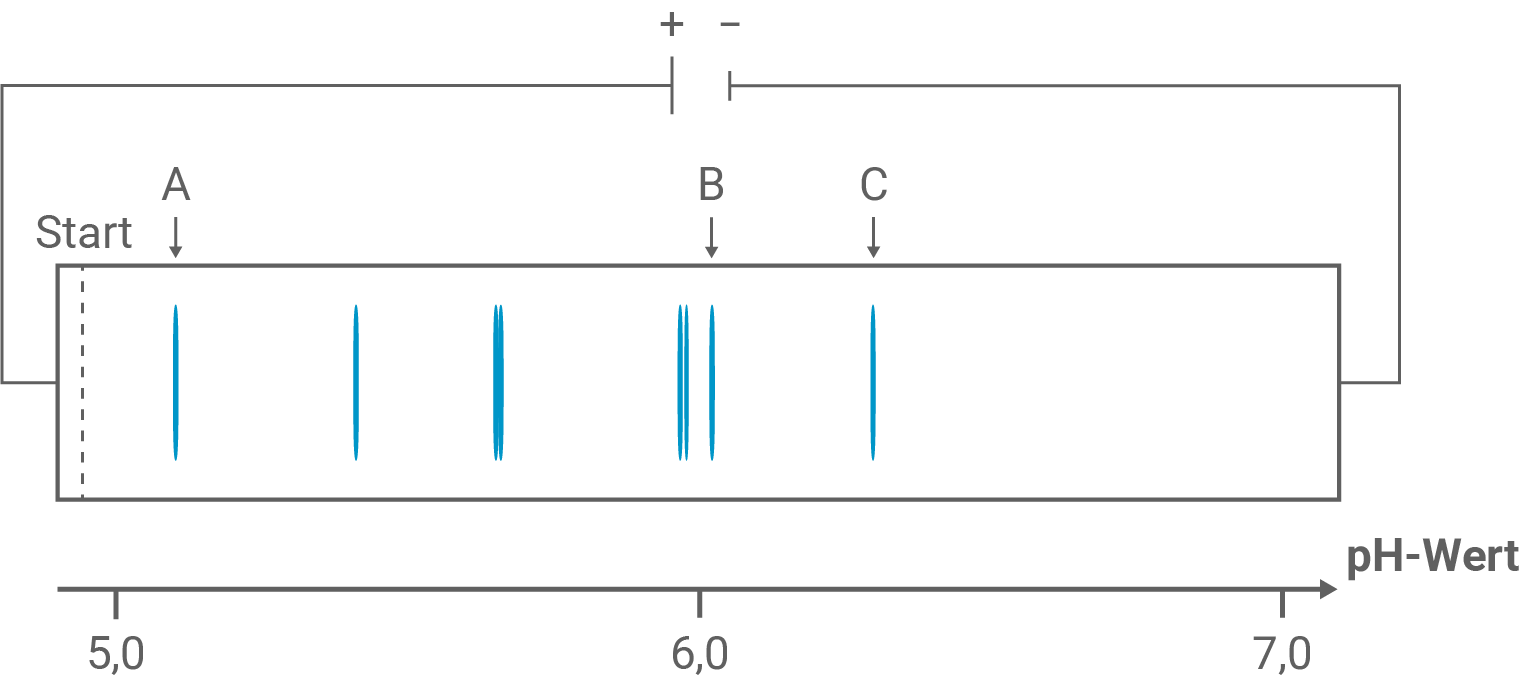
Leite mithilfe von Tabelle 1 ab, um welche Aminosäuren es sich bei A, B und C in Abbildung 2 handelt. Erkläre das Wanderungsverhalten von Aminosäure B unter Verwendung von Strukturformeln.
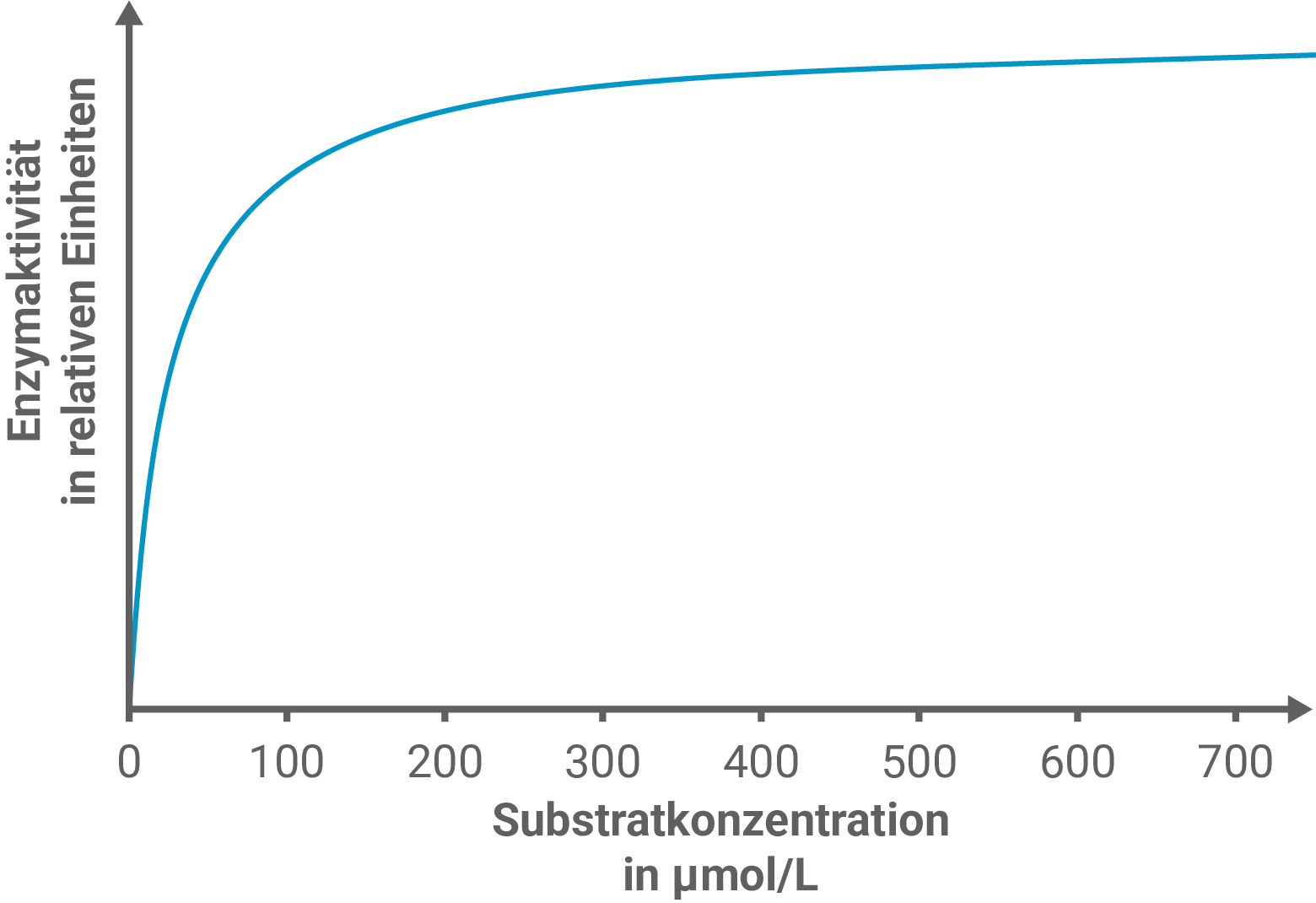
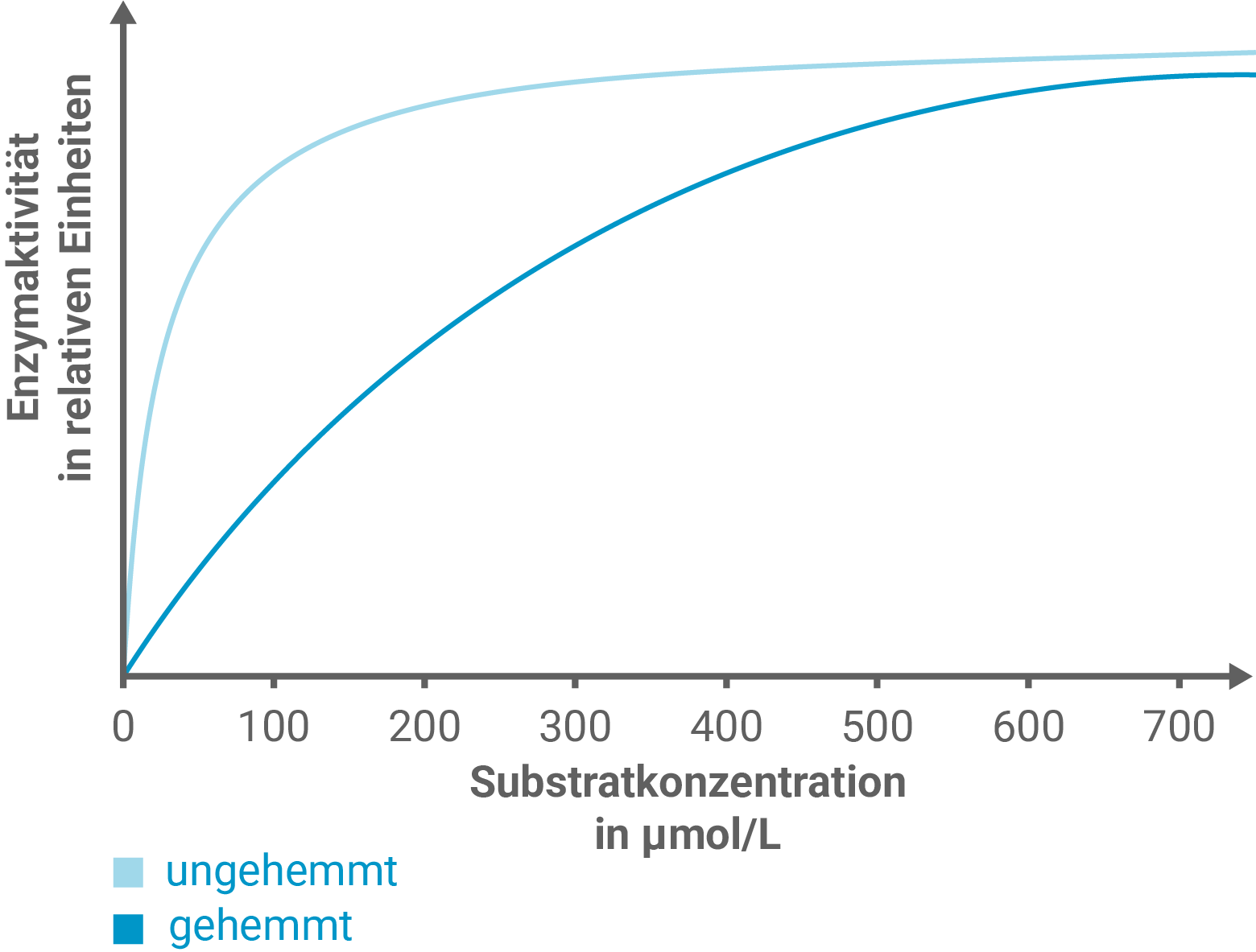
Zur Untersuchung der Oxytocinase-Aktivität wird ein Experiment mit zwei Versuchsreihen durchgeführt. In Versuchsreihe A wurde die Abhängigkeit der Aktivität der Oxytocinase von der Oxytocin-Konzentrationen untersucht. In Versuchsreihe B wurden die Versuche aus Versuchsreihe A wiederholt, jedoch wurde jedem einzelnen Versuchsansatz zusätzlich eine konstante Stoffmenge des Hemmstoffs Vasopressin zugesetzt. Abbildung 3 zeigt die Ergebnisse der Versuchsreihe A.
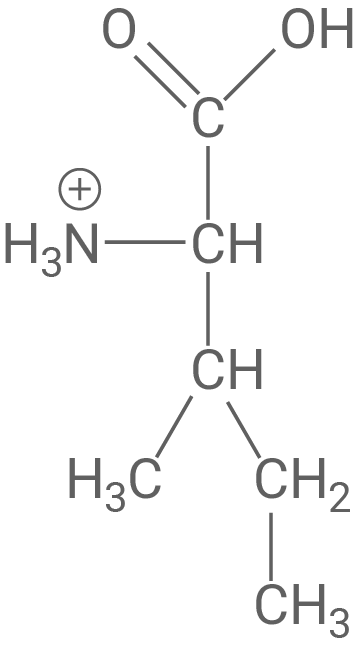
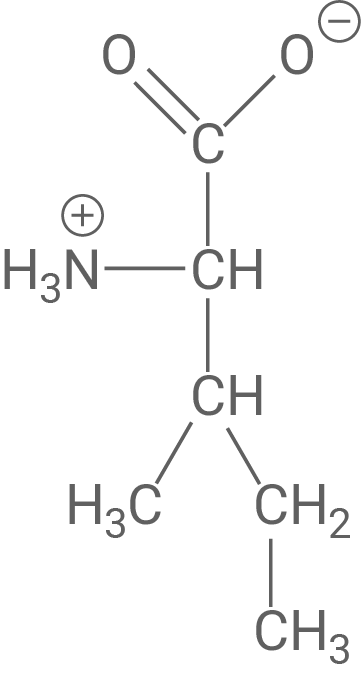
Die Moleküle von Oxytocin und Vasopressin sind in Abbildung 4 modellhaft gegenübergestellt.

Stelle mit Hilfe von Abbildung 4 eine Hypothese über die Art der Hemmung durch das Vasopressin auf und zeichne in Abbildung 3 eine dazu passende weitere Kurve ein. Erkläre den abweichenden Kurvenverlauf mit Hilfe einer Modellvorstellung.
Im Oxytocin-Hydrolyseprodukt ist unter anderem die Aminosäure Prolin enthalten (Tab. 2).
| Aminosäure | Prolin |
| Strukturformel |
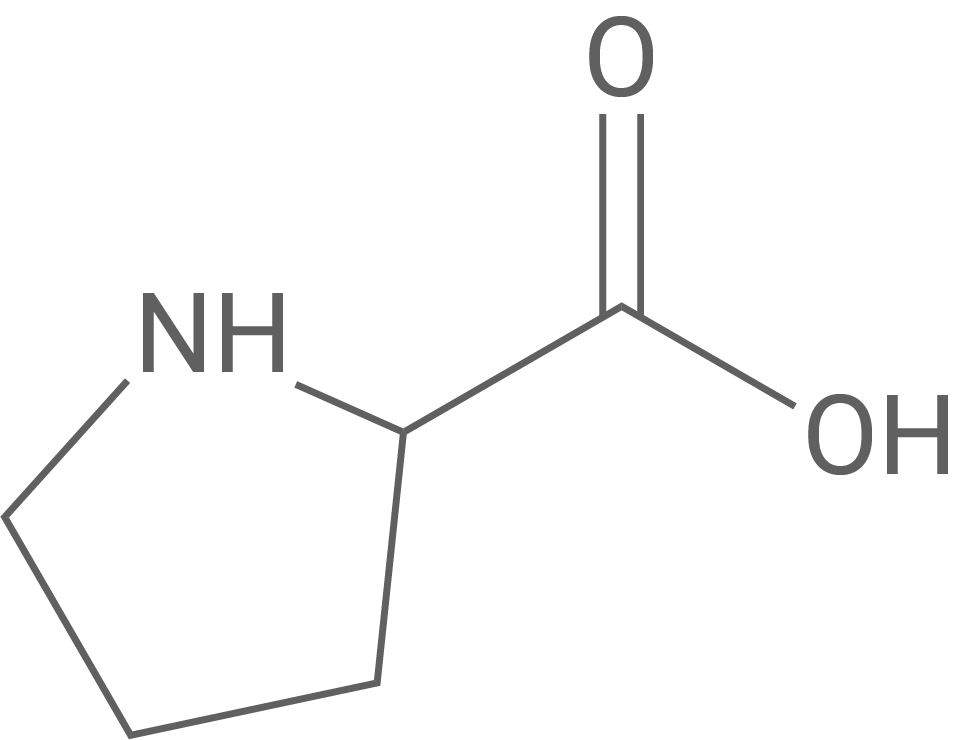
|
| Isoelektrischer Punkt (IEP) |
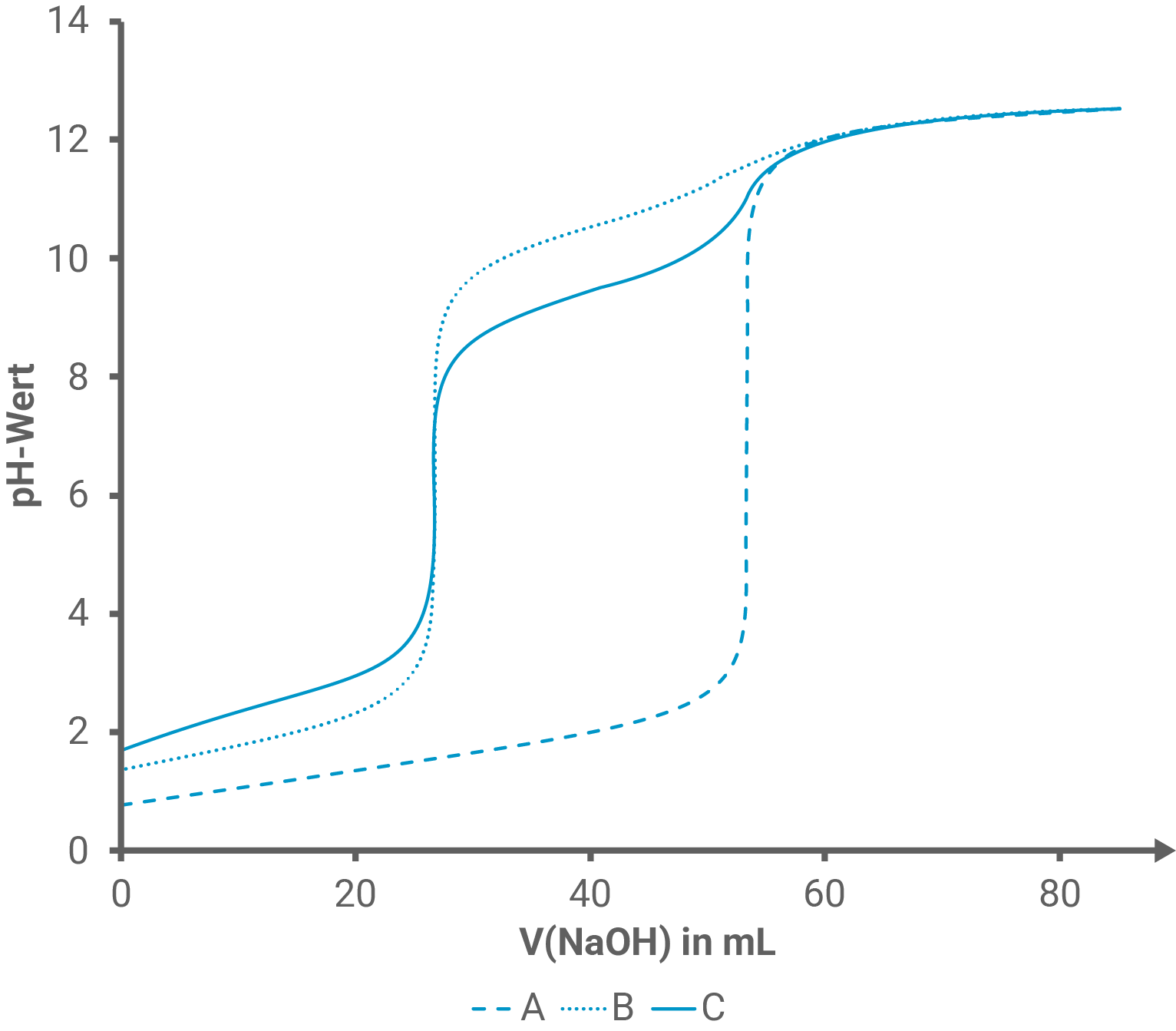
Abbildung 5 zeigt drei Titrationskurven bei Zugabe von Natronlauge zu verschiedenen Lösungen.
Ordne unter Verwendung von Tabelle 2 eine Titrationskurve anhand von drei charakteristischen Punkten eindeutig einer Prolin-Lösung zu.
Um die Haltbarkeit zu erhöhen, wird Oxytocin in Pufferlösungen mit einem -Wert von
gelagert.
Beurteile die Eignung einer Prolin-Lösung als Pufferlösung für Oxytocin.
Bei der Titration einer Prolin-Lösung mit einem Volumen von wurden bis zum Farbumschlag des Indikators
Natronlauge
verbraucht.
Berechne die Konzentration der Prolin-Lösung.
Quelle:
1 Melander, S. (1965). Plasma oxytocinase activity. European Journal of Endocrinology, 48(3), 11-94.
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Beschrifteter Strukturformelausschnitt des Oxytocin-Moleküls
Experiment zum Nachweis des Proteincharakters von Oxytocin
Um den Proteincharakter von Oxytocin nachzuweisen, kann die Biuret-Reaktion verwendet werden. Diese Methode basiert auf der Reaktion von Peptiden oder Proteinen mit Kupfer(II)-Ionen in alkalischer Lösung.
Durchführung:
- Eine Lösung von Oxytocin wird vorbereitet, indem eine kleine Menge des Hormons in destilliertem Wasser gelöst wird.
- Dann wird Biuret-Reagenz, das Kupfer(II)-sulfat und Natronlauge enthält, zu der Oxytocin-Lösung gegeben.
- Die Mischung wird vorsichtig geschwenkt, um sicherzustellen, dass sich das Reagenz gut verteilt und die Reaktion gleichmäßig verläuft.
- Die Lösung wird auf Farbveränderungen beobachtet.
Nach Durchführung der Reaktion ist eine blau-violette Färbung zu erwarten. Dies ist der Nachweis für das Vorhandensein von Peptidbindungen in Oxytocin und somit ein positiver Nachweis der Biuret-Reaktion.
Hinweis: Zur Erreichung der vollen Punktzahl können auch andere Versuche, die sich zum Nachweis von Proteinen eignen, beschrieben werden.
Zuordnung der Aminosäuren
Bande A lässt sich zu Cystein zuordnen Bande B zu Isoleucin
und Bande C zu Prolin
Erklärung des Wanderungsverhaltens
Der IEP ist eine Kenngröße von Aminosäuren (bzw. Aminosäure-Ketten) und gibt den pH-Wert an, bei dem die Aminosäure(-Kette) eine Nettoladung von besitzt. Dieser pH-Wert wird auch als pI-Wert bezeichnet.
Ist so ist die Nettoladung positiv.
Dies ist beim Startpunkt der isoelektrischen Fokussierung für alle aufgetragenen Aminosäuren der Fall (beispielhaft für Isoleucin vgl. Struktur 1). Die Wanderung der Aminosäuren auf dem Trägergel erfolgt dementsprechend zum negativ geladenen Minuspol.
Die Aminosäuren wandern so lange, bis sie auf dem Gel den pH-Wert erreichen, der mit ihrem pI-Wert übereinstimmt. Da hier die Nettoladung im Molekül beträgt, wird dieses durch die elektrische Spannung nicht mehr von der Stelle bewegt und bleibt so als eigene Bande fokussiert (beispielhaft für Isoleucin vgl. Struktur 2).
Art der Hemmung und Kurvenverlauf durch Vasopressin
Durch den Vergleich der Strukturformeln in Abbildung 4 wird klar, dass Vasopressin eine sehr ähnliche Struktur zu Oxytocin besitzt. Dies legt nahe, dass es sich bezüglich der Form der Hemmung bei dem Vasopressin-Molekül um einen kompetitiven Inhibitor handelt. Das bedeutet, dass Vasopressin mit Oxytocin um das aktive Zentrum der Oxytocinase konkurriert.
Als Modellvorstellung dient hier die Michaelis-Menten-Kinetik: Die maximale Reaktionsgeschwindigkeit bleibt unverändert, aber die halbmaximale Substratkonzentration (Michaelis-Konstante
) wird höher, da mehr Substrat benötigt wird, um die Bindung zu ermöglichen. Somit sinkt die Affinität zum Substrat, die Kurve verläuft weniger steil.
Zuordnung der Titrationskurve
Prolin besitzt am Anfang der Titration eine protonierte Aminogruppe und eine Carboxylgruppe. Daher muss es infolge der Titration mit Natronlauge zwei verschiedene Äquivalenzpunkte (ÄP) geben. Somit kann Kurve A mit nur einem ÄP als mögliche Titrationskurve für Prolin direkt ausgeschlossen werden.
B und C haben jedoch einen ähnlichen Verlauf mit je zwei Äquivalenzpunkten und für klare Zuordnung bedarf es hier einer näheren Auseinandersetzung mit den charakteristischen Punkten der gesuchten Titrationskurve.
Hierfür liefert Tabelle 2 die notwendigen Informationen mit der Angabe beider Säurekonstanten und des IEPs von Prolin.
Den ersten Punkt auf der Kurve kündigt der pKS1-Wert Prolins an; er bezieht sich auf die Carboxylgruppe, die vergleichsweise leicht ihr Proton abgeben kann. Am ersten Halbäquivalenzpunkt (HÄP), auch Pufferpunkt, entspricht der pH-Wert der Lösung nämlich dem pKS1-Wert. Dies wird auch bei Betrachtung der Henderson-Hasselbalch-Gleichung noch einmal verdeutlicht:
In diesem Fall ist die Base die deprotonierte Carboxylgruppe und die Säure die protonierte Carboxylgruppe
Am HÄP sind die Konzentrationen beider Formen gleich, womit hier gilt:
Der zweite charakteristische Punkt der ermittelbar ist, ist der erste ÄP. Hier ist die Carboxylgruppe aller Prolin-Moleküle der Lösung vollständig deprotoniert worden. Als Resultat liegen nun alle Prolin-Moleküle in Zwitterionenform vor, also mit protonierter Aminogruppe, deprotonierter Carboxylgruppe und somit einer intramolekularer Nettoladung von
Der letzte ausschlaggebende Punkt ist der zweite HÄP; hier gelten die gleichen Zusammenhänge bezüglich Henderson-Hasselbalch-Gleichung wie am ersten HÄP. Der pKS2-Wert, der die protonierte Aminogruppe beschreibt, entspricht also auch hier dem pH-Wert der titrierten Lösung. Der zweite HÄP muss also bei einem
Diese charakteristischen Punkte decken sich nicht mit Kurve C (hier liegt der erste HÄP zu hoch und der zweite HÄP zu niedrig).
Daher ist Kurve B die gesuchte Titrationskurve, die zur Prolin-Lösung passt.
Eignung einer Prolin-Lösung als Puffer
Prolin ist bei als Puffer ungeeignet. Ein gutes Puffersystem liegt vor, wenn der gewünschte pH-Wert in der Nähe des jeweiligen Halbäquivalenzpunkts (HÄP) der Dissoziationsstufe liegt. Am HÄP gilt, dass pH und pKS gleich sind und Säure- und Basenform in etwa im gleichen Verhältnis vorliegen, wodurch die Pufferkapazität maximal ist. Für Prolin liegt der erste HÄP bei ungefähr
der zweite bei ungefähr
Der Lager-
für Oxytocin von
liegt deutlich außerhalb beider HÄP-Bereiche; die Konzentrationen von Säure- und Basenform sind hier stark ungleich. Dadurch kann Prolin in diesem Bereich pH-Schwankungen nur schlecht abfangen. Eine Prolin-Lösung besitzt bei
somit keine ausreichende Pufferwirkung und ist zur Stabilisierung von Oxytocin ungeeignet.
Konzentrationsberechnung der Prolin-Lösung
Gegeben:
- Probelösung:
- Maßlösung:
Rechnung:
Zur Berechnung der gesuchten Konzentration kann folgender Zusammenhang umgeformt werden:
Hierbei entspricht und
Dieser Zusammenhang beschreibt, dass die Stoffmenge an Prolin in der Maßlösung den gleichen Wert hat wie die Stoffmenge der verbrauchten Pröbelösung Natronlauge am Umschlagspunkt, also dem ersten Äquivalenzpunkt der Titration. Zwischen beiden Teilchen liegt nämlich eine 1:1-Stöchiometrie vor.
Mit eingesetzten Werten:
Die Konzentration der Prolin-Lösung beträgt somit