C1 Phenol
Hinweis: In der Prüfung musst du von den Aufgabenblöcken A, B und C jeweils einen der beiden Vorschläge 1 oder 2 bearbeiten.
Phenol (Abb. 1) wird nicht nur zur Produktion von Kunststoffen genutzt, sondern auch für die Herstellung von Pikrinsäure, die in der chemischen Analytik eine wichtige Rolle spielt.
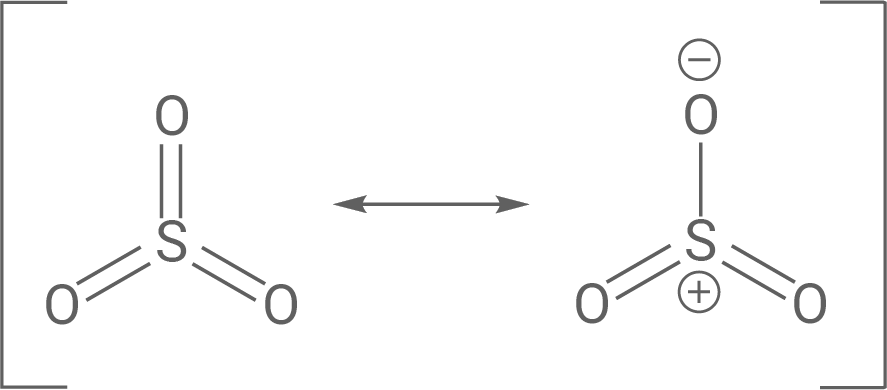
Bei der Synthese der Pikrinsäure wird Phenol in Anwesenheit von rauchender Schwefelsäure zweifach sulfoniert (Abb. 2, Schritt 1 und 2). Rauchende Schwefelsäure enthält immer einen Anteil an Schwefeltrioxid, das als Elektrophil an der insgesamt exothermen Reaktion beteiligt ist.
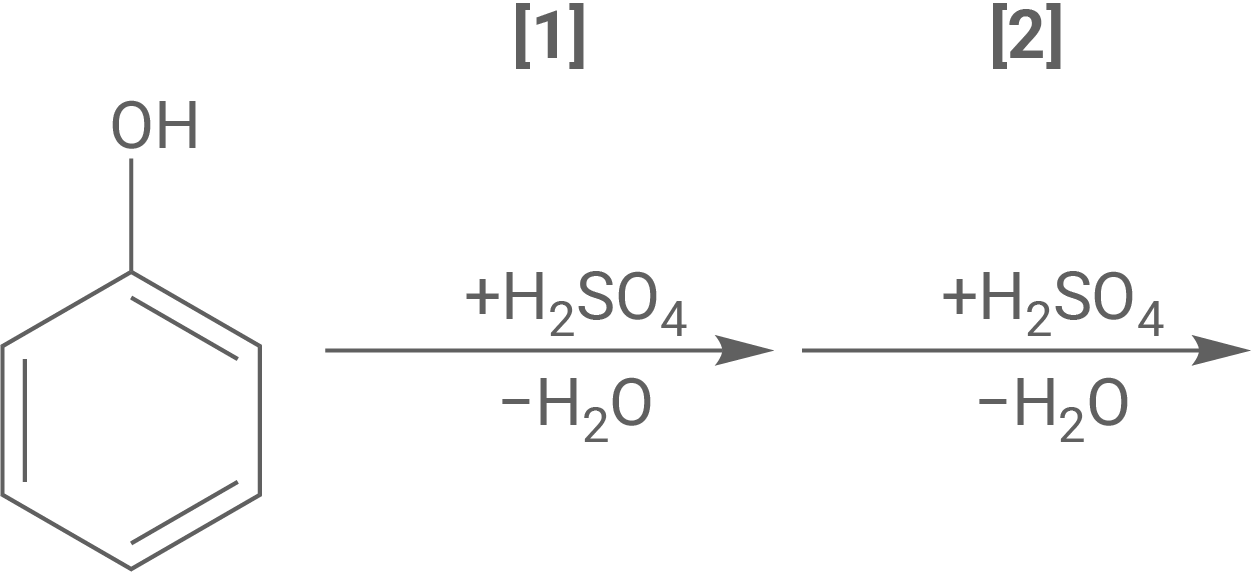
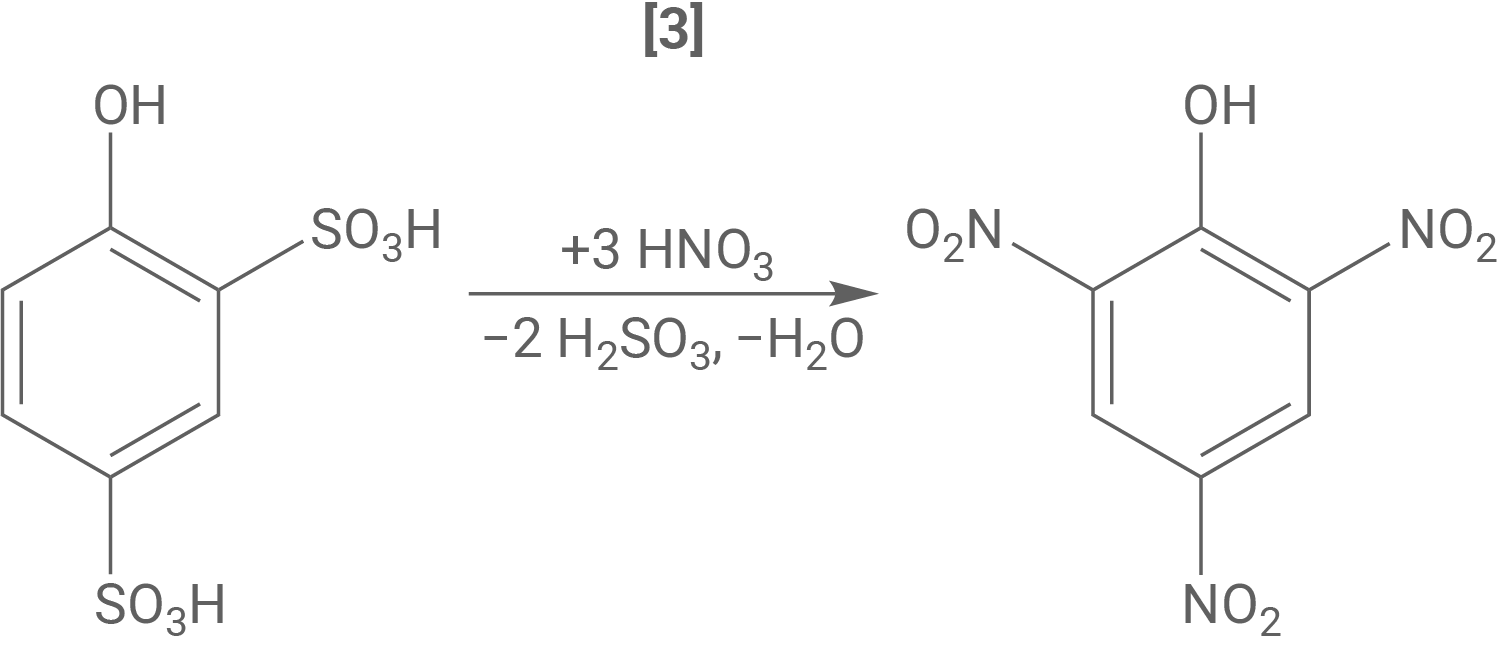

Formuliere den Reaktionsmechanismus für Schritt 1 der Synthese von Pikrinsäure. Ordne der Reaktion begründet eines der Energiediagramme aus Abbildung 3 zu.
Die für die Synthese von Pikrinsäure benötigten Stoffe Schwefelsäure und Schwefeltrioxid können großtechnisch durch das Kontaktverfahren hergestellt werden. Dafür wird in einem ersten Schritt (I) durch die Reaktion von Schwefel mit Sauerstoff Schwefeldioxid gebildet:
Das entstehende Gasgemisch enthält etwas über 10 % Schwefeldioxid. Schwefeldioxid wird anschließend (II) mithilfe von Vanadium(V)-oxid als Katalysator zu Schwefeltrioxid umgesetzt:
Schwefeltrioxid reagiert dann mit Wasser zu Schwefelsäure (III):
Erkläre mit Hilfe der Gibbs-Helmholtz-Gleichung, dass die Temperatur einen entscheidenden Einfluss auf die Freiwilligkeit von Reaktion (III) hat.
In einem Modellversuch zum Kontaktverfahren werden die Gleichgewichtskonzentrationen der an der Schwefeltrioxid-Synthese (II) beteiligten Stoffe bei ermittelt (Tab. 1).
| Stoff | Konzentration in mol/L |
| Schwefeldioxid | |
| Sauerstoff | |
| Schwefeltrioxid |
Stelle das Massenwirkungsgesetz für die Schwefeltrioxid-Synthese auf und berechne anhand von Tabelle 1 die Gleichgewichtskonstante.
In einem weiteren Modellexperiment wird der Einfluss verschiedener Reaktionsbedingungen auf die Einstellung und die Lage des Gleichgewichts bei der Schwefeltrioxid-Synthese (II) untersucht.
| Ansatz | Temperatur in °C | Katalysator | Druck in bar |
| 1 | nein | ||
| 2 | ja | ||
| 3 | nein |
Abbildung 4 zeigt die Ergebnisse dieses Modellexperiments.
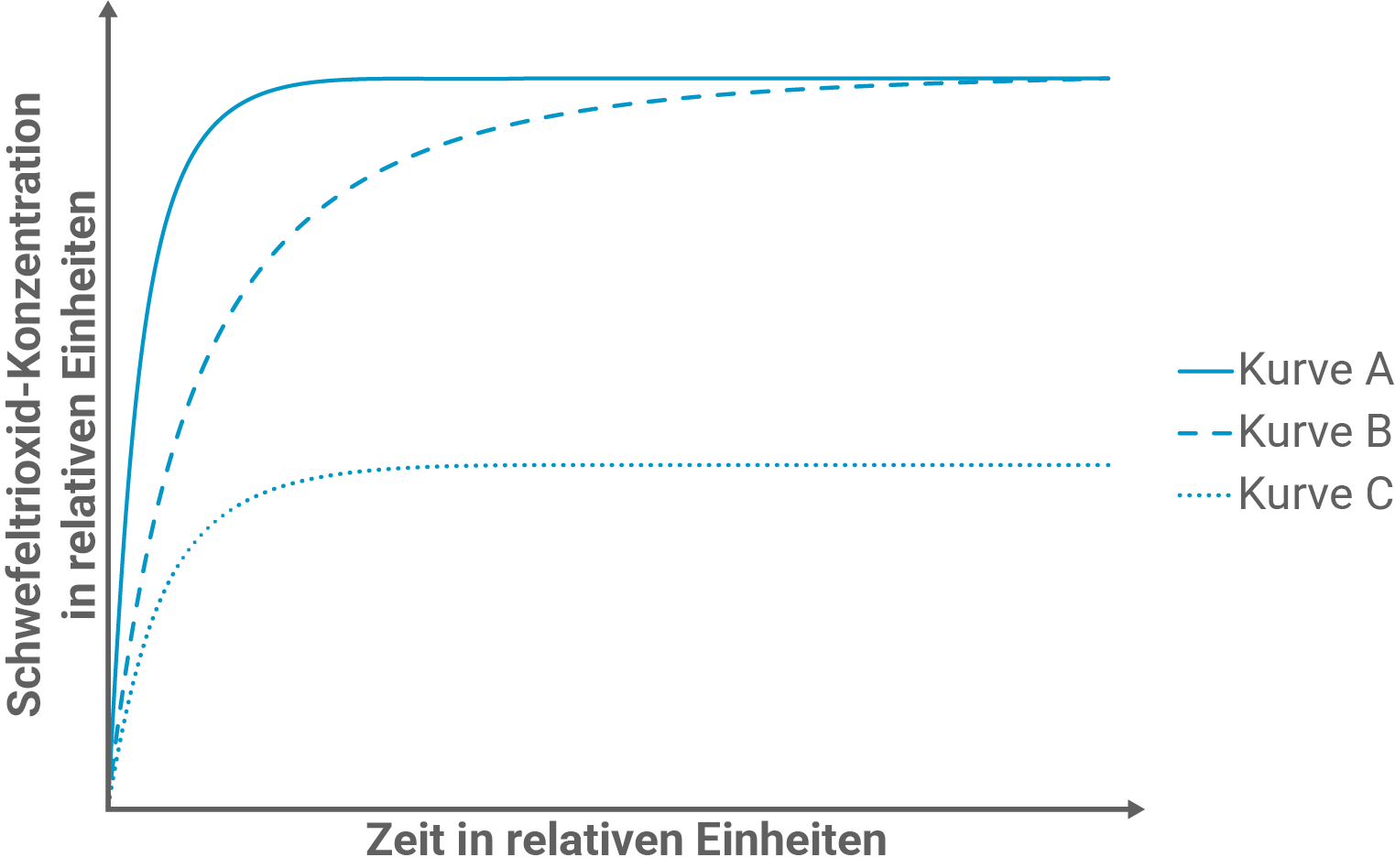
Ordne die drei Versuchsansätze den Kurven im Diagramm begründet zu. Beurteile den Einfluss einer Druckerhöhung auf die Lage des Gleichgewichts bei Ansatz 3.
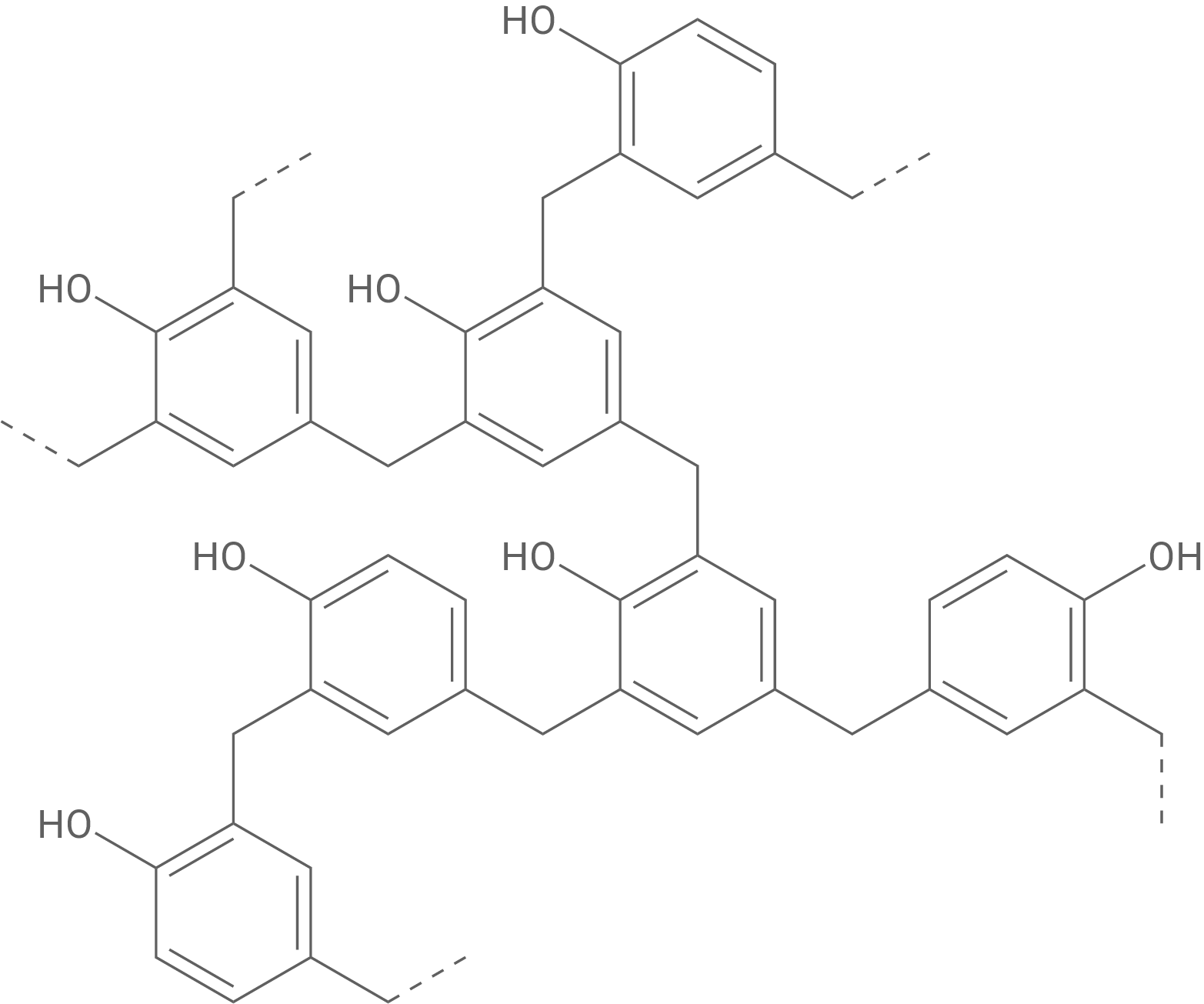
Ausgehend von Phenol können die Kunststoffe Perlon (Abb. 5) und Bakelit (Abb. 6) hergestellt werden.
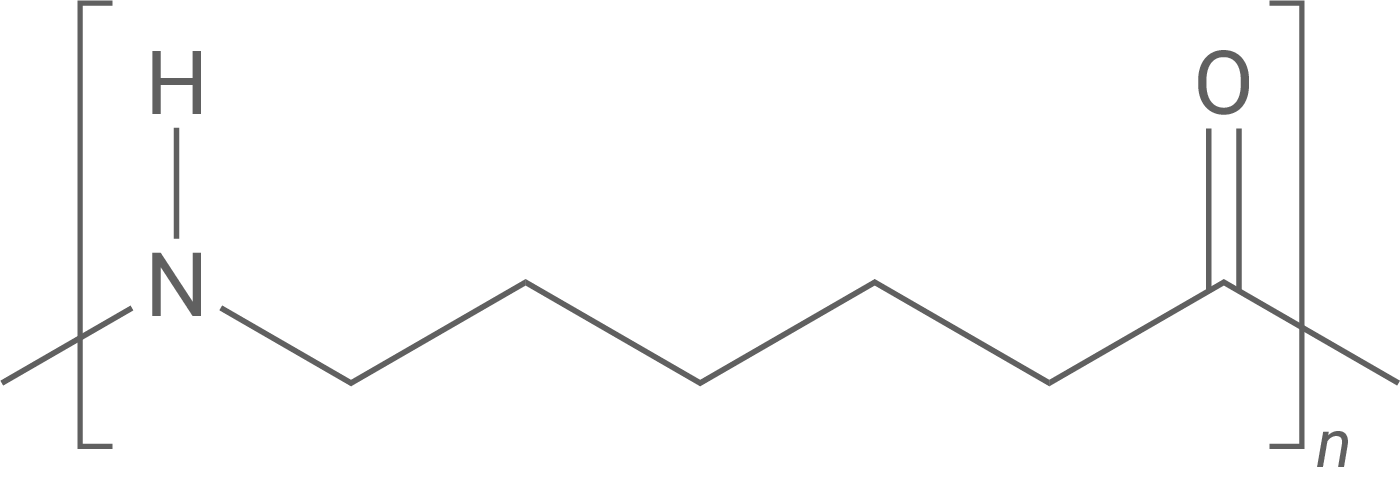
Phenol dient bei der Perlon-Synthese als Ausgangsstoff für die Herstellung des Monomers ε-Caprolactam. Im ersten Schritt der Synthese kommt es zu einer katalytischen Hydrierung von Phenol, bei der ein Gemisch aus Cyclohexanon und Cyclohexanol entsteht. Aus Cyclohexanon wird anschließend in mehreren Schritten ε-Caprolactam gebildet (Abb. 7).

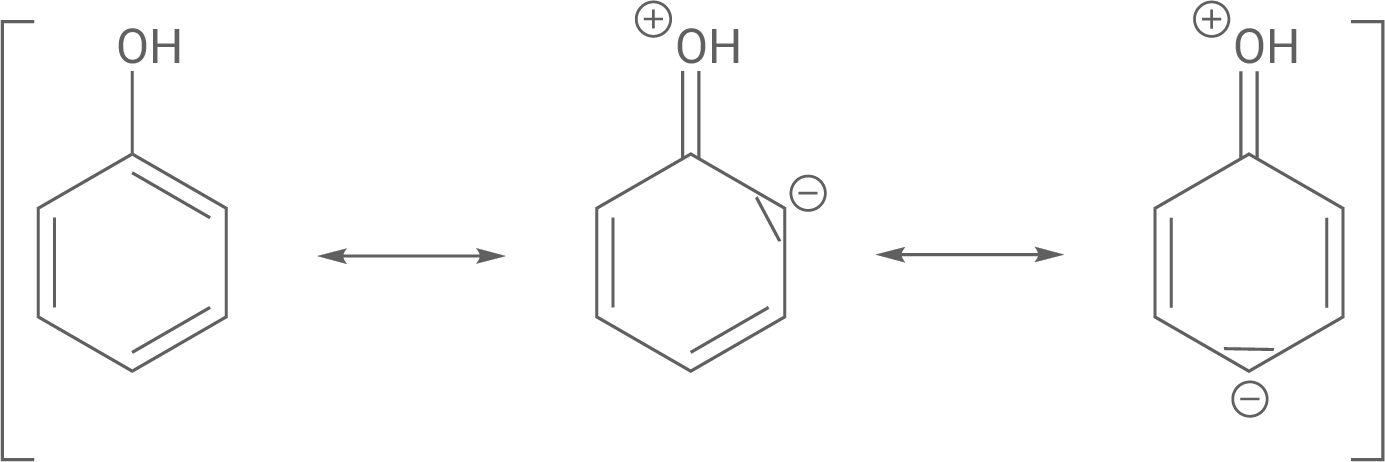
Erkläre die Aciditätsunterschiede von Phenol und Cyclohexanol
mit Hilfe von mesomeren Grenzstrukturen.
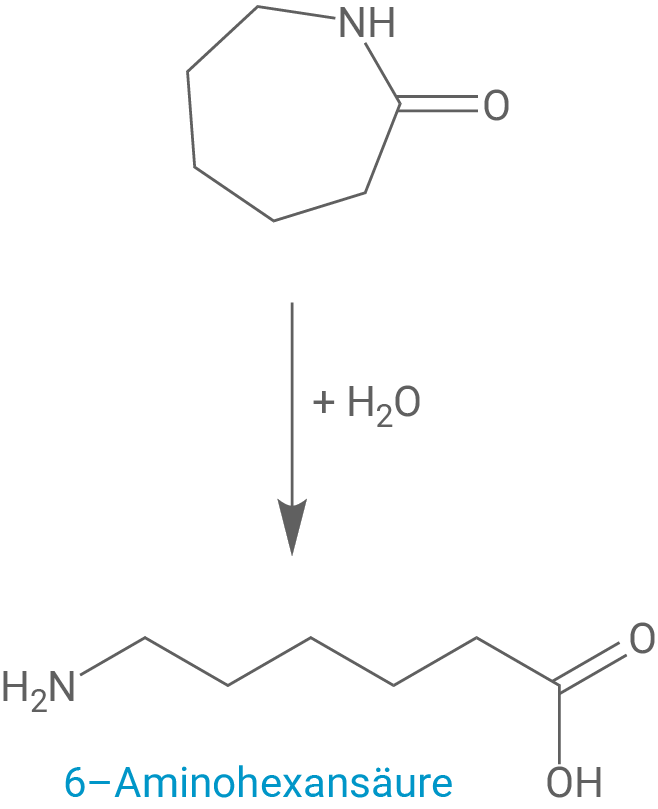
Im ersten Schritt der Perlon-Synthese wird durch Wasserzugabe ein geringer Teil des ε-Caprolactams hydrolysiert. Anschließend kommt es in einer Polyreaktion zur Perlon-Bildung.
Formuliere die Reaktionsgleichung für die Reaktion von ε-Caprolactam mit Wasser und benenne das Reaktionsprodukt.
Erkläre die Unterschiede im thermischen Verhalten der Kunststoffe Perlon und Bakelit.
Quelle:
1 Zaker, M. R. (2020). Modelling and multi-objective optimization of the sulphur
dioxide oxidation to the sulphur trioxide process (Doctoral dissertation, Université
d'Ottawa/University of Ottawa).
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Reaktionsmechanismus zu Schritt 1 der Gesamtreaktion
Bei der betrachteten Teilreaktion handelt es sich um eine elektrophile aromatische Substitution.
Schritt 1:
Als erstes greift das Elektrophil, hier Oleum, das aromatische System an und bricht es auf. Durch den +M-Effekt der Hydroxygruppe ist ein solcher Angriff besonders in ortho- und para-Stellung bevorzugt, wobei denkbar ist, dass para-Stellung zusätzlich auch sterisch günstiger ist.
Hierbei bildet sich zuerst ein Anlagerungskomplex (π-Komplex), der nach Aufbrechung der Aromatizität zu einem Wheland-Komplex (σ-Komplex) wird.
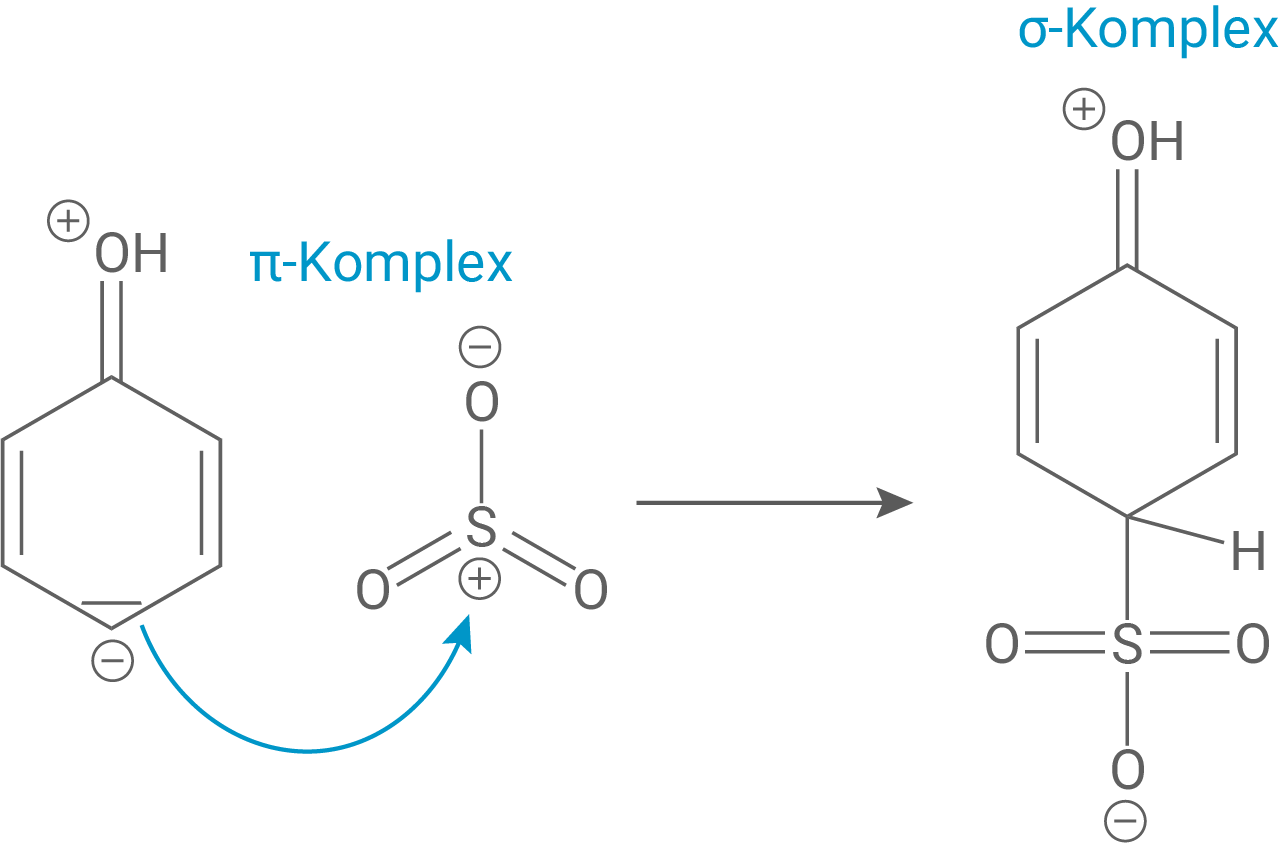
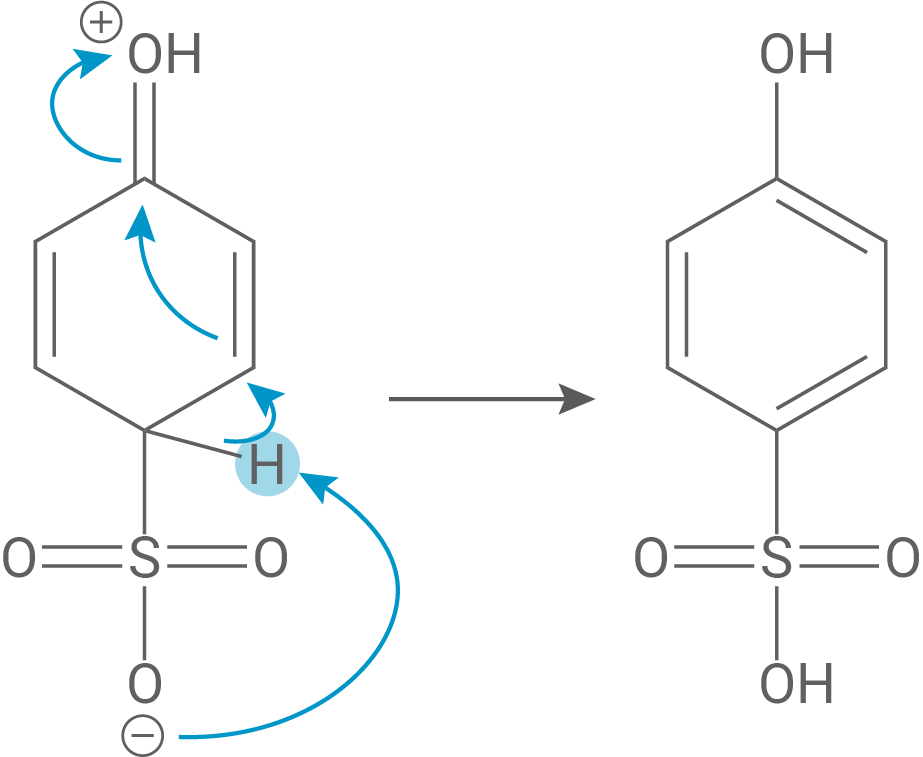
Schritt 2:
Als Letztes wandert das markierte Wasserstoffatom formal zu der Sulfonsäuregruppe und die Aromatizität wird wiederhergestellt.
Zuordnung des entsprechenden Energiediagramms
Die Reaktion lässt sich Diagramm C zuordnen. Die Reaktion hat durch das getrennte Aufbrechen der Aromatizität von der Rearomatisierung zwei Teilschritte mit jeweiligen Aktivierungsenergien. Dadurch sind Kurve B und D mit nur einem Übergangszustand direkt ausschließbar.
Die Reaktion muss zudem exotherm sein, da das para-sulfonierte Phenol als Produkt stabiler ist als die einzelnen Edukte. Es stellt nämlich eine polarere Bindung als mit dem substituierten Wasserstoffatom dar und als –M-Substituent ist das delokalisierte -Elektronensystem hierdurch zudem vergrößert.
Einfluss der Temperatur auf die Freiwilligkeit von Reaktion (III)
Die Gibbs-Helmholtz-Gleichung lautet:
Hierbei zeigt die freie Reaktionsenthalpie an, ob die betrachtete Reaktion exergonisch (freiwillig ablaufend) oder endergonisch (unfreiwillig ablaufend) ist:
Setzt man nun für Reaktion (III) die gegebenen Werte der Reaktionsenthalpie und Reaktionsentropie
in die Gibbs-Helmholtz-Gleichung ein, erhält man
und man erkennt, dass eine Erhöhung der Temperatur zu einem positiveren Ergebnis für führt. Dies bedeutet, dass eine Temperaturerhöhung die Reaktion zunehmend endergonischer macht. Je niedriger die Temperatur also, desto exergonischer bleibt die Reatkion.
Ab einer Temperatur von bzw.
verläuft die Reaktion endergonisch.
Massenwirkungsgesetz und Gleichgewichtskonstante
Zuordnung der Versuchsansätze
Ansatz 1 gehört zu Kurve B und Ansatz 2 zu Kurve A. Beide Ansätze unterscheiden sich nur in der Verwendung des Katalysators. Da alle sonstigen Reaktionsbedingungen gleich sind, ist auch die Gleichgewichtskonzentration des Schwefeltrioxids bei beiden Ansätzen die gleiche (beide Kurven führen im Laufe der Zeit zusammen). Der Katalysator in Ansatz 2 bewirkt lediglich, dass das Gleichgewicht schneller erreicht wird und daher hat Kurve A eine anfänglich steilere Steigung und erreicht schnell das Plateau des Gleichgewichtzustandes. Es ist somit nur die Kinetik und nicht die Thermodynamik der Reaktion beeinflusst.
Ansatz 3 gehört schließlich zu Kurve 3. Hier wurde die Temperatur erhöht, was nach dem Prinzip von Le-Chatelier eine Verschiebung des Gleichgewichts in Richtung des endothermen Reaktionsschritts bedeutet. Da die Hinreaktion exotherm ist (vgl. negative Reaktionsenthalpie), wird somit die Rückreaktion bevorzugt und die Schwefeltrioxid-Konzentration im Gleichgewicht ist niedriger. Nichtsdestotrotz hat Kurve C dennoch eine relativ steile Steigung zu Beginn und es kommt schnell zur Einstellung des Gleichgewichts, obwohl kein Katalysator eingesetzt wird. Eine Erklärung hierfür liefert die RGT-Regel (Reaktionsgeschwindigkeits-Temperatur-Regel), da eine Erhöhung der Temperatur gleichzeitig trotz vermehrter Eduktbildung die Kinetik der Reaktion erhöht.
Lage des Gleichgewichts von Ansatz 3 bei Druckerhöhung
Eine Druckerhöhung bei Ansatz 3 führt zu einer Verschiebung des Gleichgewichts auf Produktseite, also zugunsten einer höheren Schwefeltrioxid-Ausbeute. Nach dem Prinzip von Le-Chatelier weicht das System dem Zwang einer Druckerhöhung durch Minderung des Drucks aus. Da auf Eduktseite 3 Gasteilchen vorliegen und auf Produktseite nur 2, wird so die Bildung des Schwefeltrioxids gefördert.
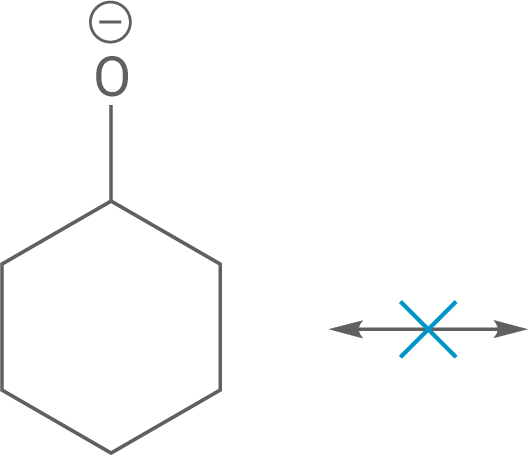
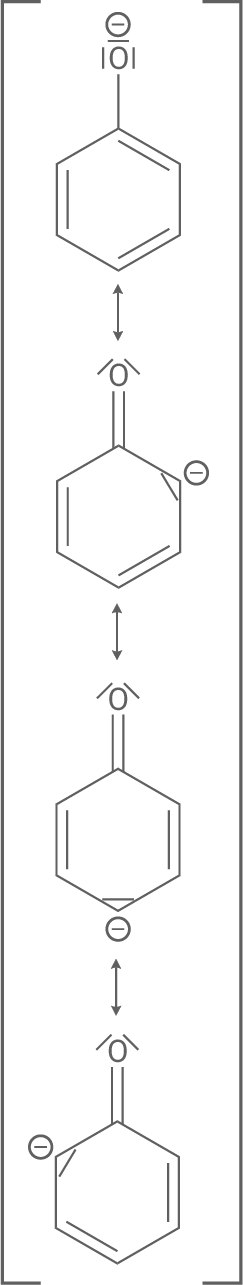
Aciditätsunterschiede von Phenol und Cyclohexanol
Phenol ist saurer, weil das Phenolat-Anion nach der Deprotonierung die negative Ladung auf dem Sauerstoffatom durch Mesomerie auf den Benzolring delokalisiert. Diese Delokalisierung stabilisiert das Anion und macht die Deprotonierung leichter.
Im Gegensatz dazu hat Cyclohexanol keine Möglichkeit zur Mesomerie, da es ein gesättigter Alkohol ist. Die negative Ladung des Cyclohexanolat-Anions bleibt lokalisiert, was das Anion weniger stabil und das Molekül weniger sauer macht.
Hydrolyse des ε-Caprolactams
Thermisches Verhalten von Perlon vs. Bakelit
Perlon ist ein Thermoplast, was bedeutet, dass es bei Erwärmung weich wird und bei Abkühlung wieder erstarrt. Dies liegt daran, dass die Polymerketten durch nicht-kovalente Bindungen (wie Wasserstoffbrücken, Dipol-Dipol-Wechselwirkungen und Van-der-Waals-Kräfte) verbunden sind, die sich beim Erhitzen leicht lösen lassen. Als Thermoplast lässt sich Perlon mehrmals erhitzen und umformen, ohne dass es seine Eigenschaften verliert.
Im Gegensatz dazu ist Bakelit ein Duroplast, was bedeutet, dass es nach der Aushärtung durch Wärme dauerhaft unverformbar wird. Während des Herstellungsprozesses verknüpfen sich die Polymerketten durch Kondensationsreaktionen zu einem engmaschig quervernetzten Netzwerk, das sehr stabil ist. Bakelit hat keinen klassischen Schmelzpunkt, sondern zersetzt sich bei zu hohen Temperaturen. Aufgrund dieser starken Vernetzung bleibt Bakelit ansonsten aber auch bei höheren Temperaturen formstabil. Bakelit lässt sich daher der Kunststoffklasse der Duromere zuordnen.