B1 Chemie der Kiwis
Hinweis: In der Prüfung musst du von den Aufgabenblöcken A, B und C jeweils einen der beiden Vorschläge 1 oder 2 bearbeiten.
Kiwis (Actinidia deliciosa) sind schmackhafte Früchte. Allerdings reagieren ein bis drei Prozent der deutschen Bevölkerung allergisch auf Actinidain, ein proteinspaltendes Enzym in Kiwis.
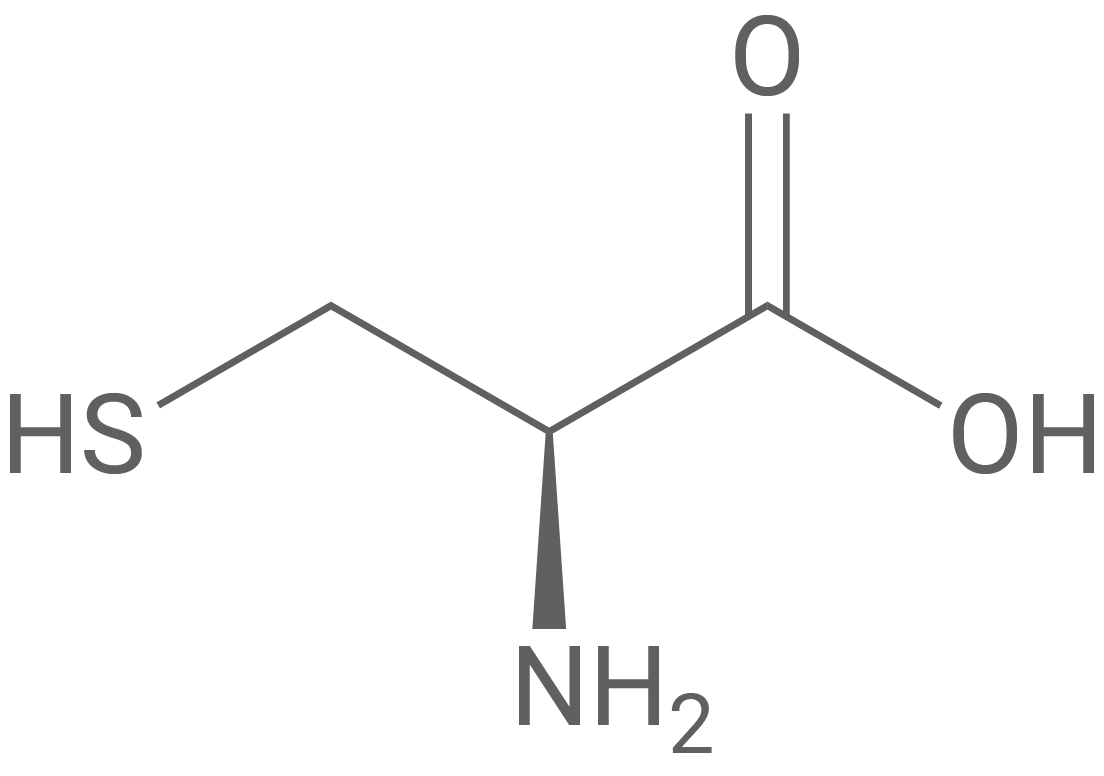
Ein Ausschnitt der Aminosäuresequenz von Actinidain ist im Einbuchstaben-Code wie folgt angegeben:
Formuliere den Strukturformelausschnitt für den in Abbildung 1 hervorgehobenen Bereich der Aminosäuresequenz mithilfe von Tabelle 1.
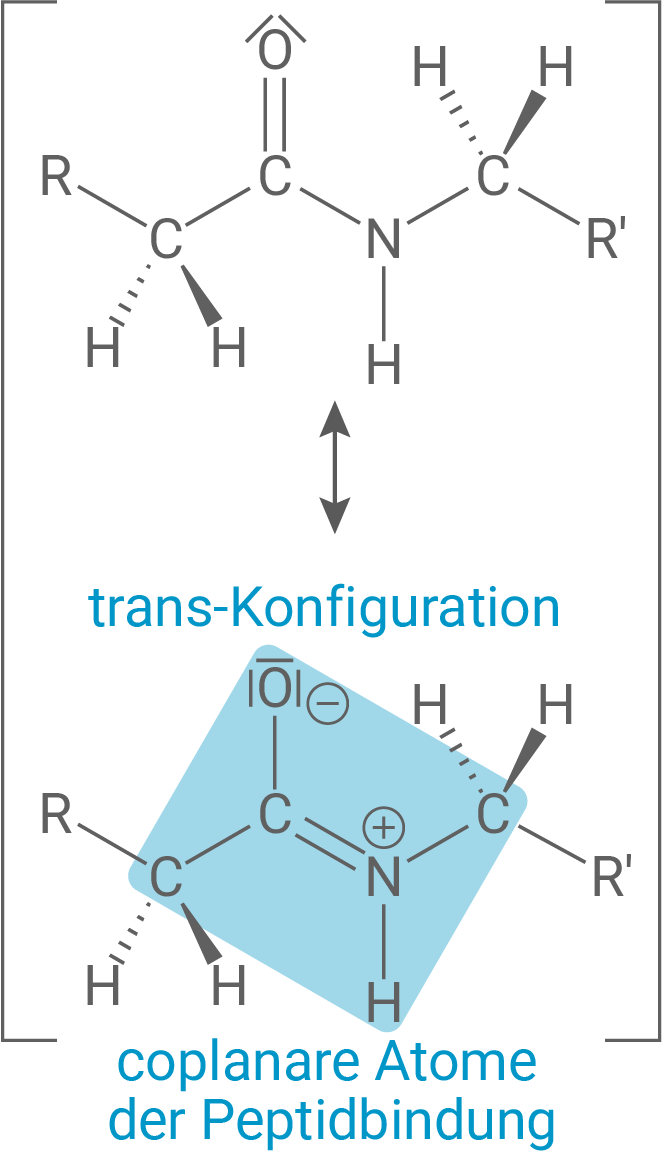
Durch die Verknüpfung von Aminosäure-Bausteinen entsteht eine neue funktionelle Gruppe. Benenne diese und erläutere deren räumlichen Bau unter Verwendung von Grenzstrukturformeln.
Bei einer allergischen Reaktion auf Actinidain in Kiwis werden durch die Freisetzung von Histamin Symptome wie Schwellungen im Mund- und Rachenbereich verursacht. Abbildung 2 zeigt zelluläre Prozesse, die zur Freisetzung von Histamin führen.
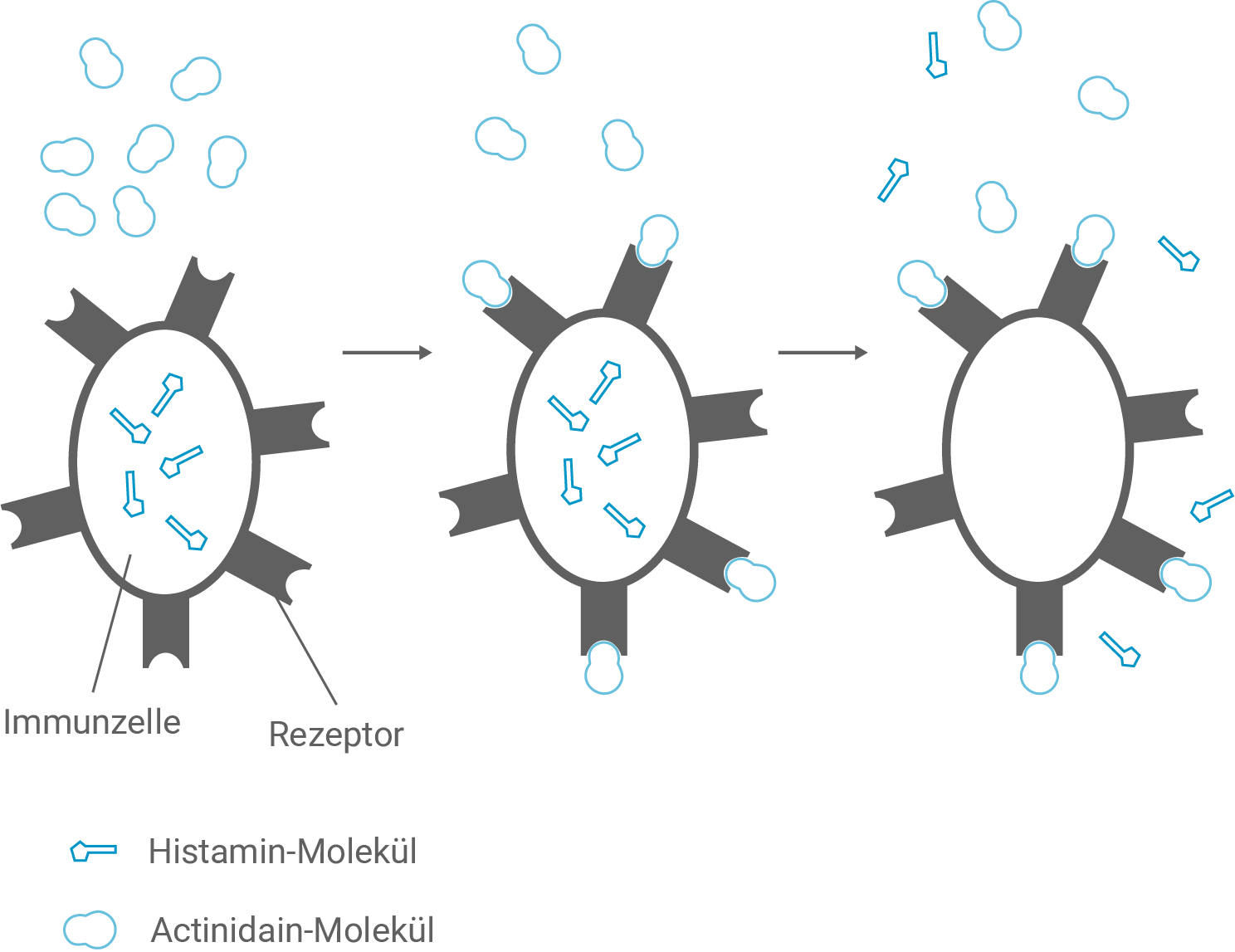
In allergologischen Studien zeigte sich, dass Personen, die nach Verzehr frischer Kiwi-Produkte allergisch reagieren, nach Verzehr von erhitzten Produkten keine Symptome zeigten.
Formuliere mithilfe von Abbildung 2 eine begründete Hypothese, die diese Beobachtung erklärt.
Fügt man Kiwis zu Joghurt hinzu, schmeckt die Mischung bitter. Der bittere Geschmack entsteht, da Actinidain das im Joghurt enthaltene Protein Casein spaltet und dabei bitter schmeckende Produkte entstehen.
In einem Experiment wurde der Abbau von Casein durch Actinidain untersucht. Die Versuchsergebnisse sind in Abbildung 3 dargestellt.
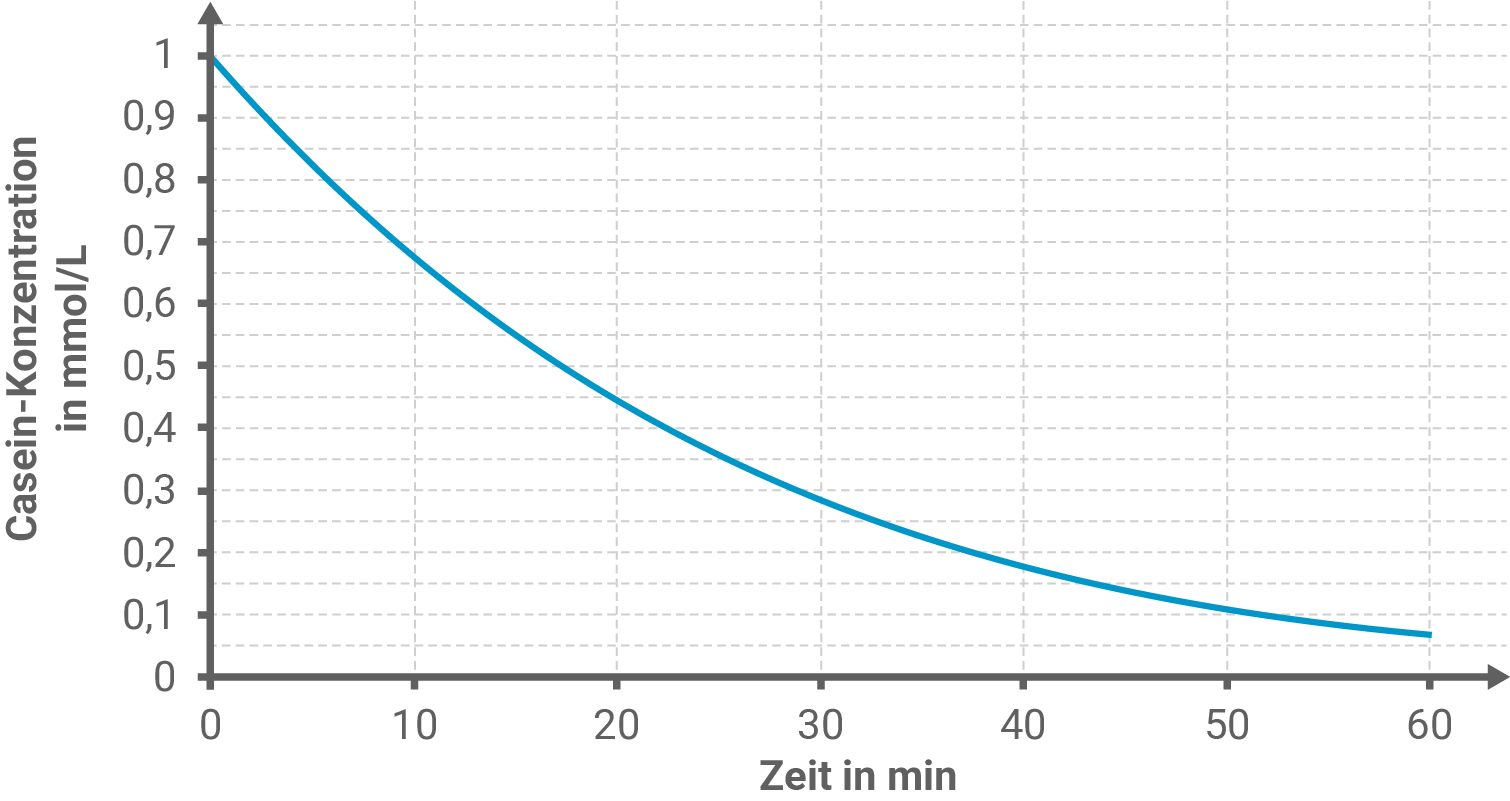
Ermittle mithilfe von Abbildung 3 die mittlere Reaktionsgeschwindigkeit im Zeitraum von bis
In einer Versuchsreihe wird die Abhängigkeit der Actinidain-Aktivität von der Substratkonzentration untersucht. Die Ergebnisse der Versuchsreihe sind in Abbildung 4 dargestellt.
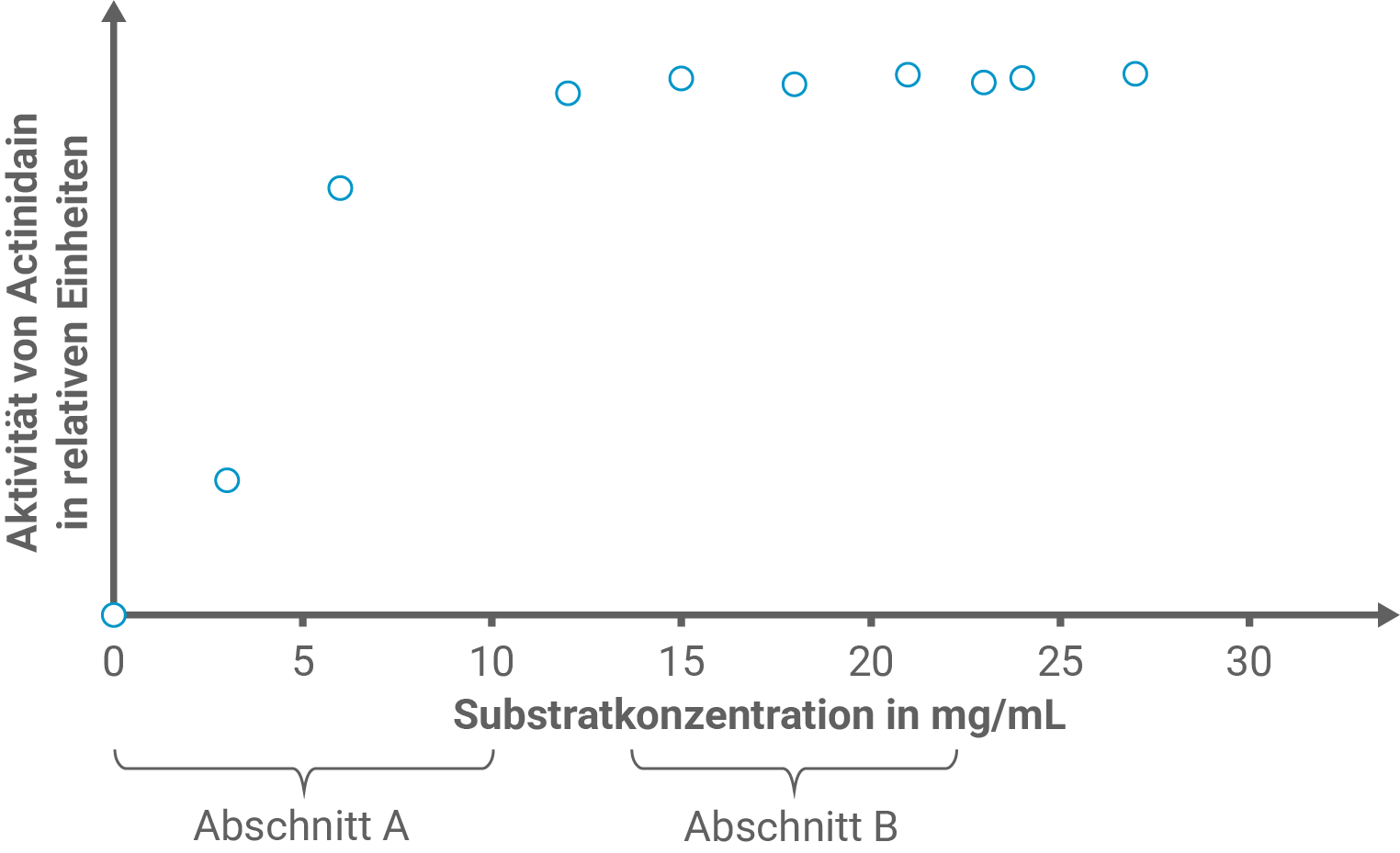
Erkläre den Verlauf der Messwerte in den Abschnitten A und B unter Verwendung einer Modellvorstellung.
Durch den Abbau von Casein werden Glycin Valin
Lysin
sowie 15 weitere Aminosäuren freigesetzt. Sie sollen mithilfe einer Elektrophorese isoliert und identifiziert werden.
Um die Eignung der Elektrophorese hierfür zu überprüfen, wird ein Vorversuch mit einem Aminosäuregemisch aus Glycin, Valin und Lysin durchgeführt. Dieses wird in der Mitte eines Filterpapiers aufgetragen. Anschließend wird für 20 Minuten eine Elektrophorese in einer Pufferlösung mit dem -Wert
durchgeführt. Um die Aminosäuren sichtbar zu machen, werden diese angefärbt.
Fertige eine beschriftete Skizze des zu erwartenden Versuchsergebnisses unter Berücksichtigung der elektrischen Pole an.
Beurteile die Eignung dieses Versuchs zur eindeutigen Auftrennung der Aminosäuren von Casein.
Für die Herstellung von der benötigten Pufferlösung stehen
einer Natriumdihydrogenphosphat-Lösung der Konzentration
und festes Natriumhydrogenphosphat
zur Verfügung.
Berechne die Masse an Natriumhydrogenphosphat, die zur Herstellung dieser Pufferlösung benötigt wird.
Die aus Actinidain isolierte Aminosäure Glycin (2-Aminoethansäure) liegt in Abhängigkeit vom pH-Wert in verschiedenen Formen vor. Das nachfolgende Diagramm (Abb. 5) zeigt die Konzentrationen der unterschiedlichen Formen in Abhängigkeit vom pH-Wert.
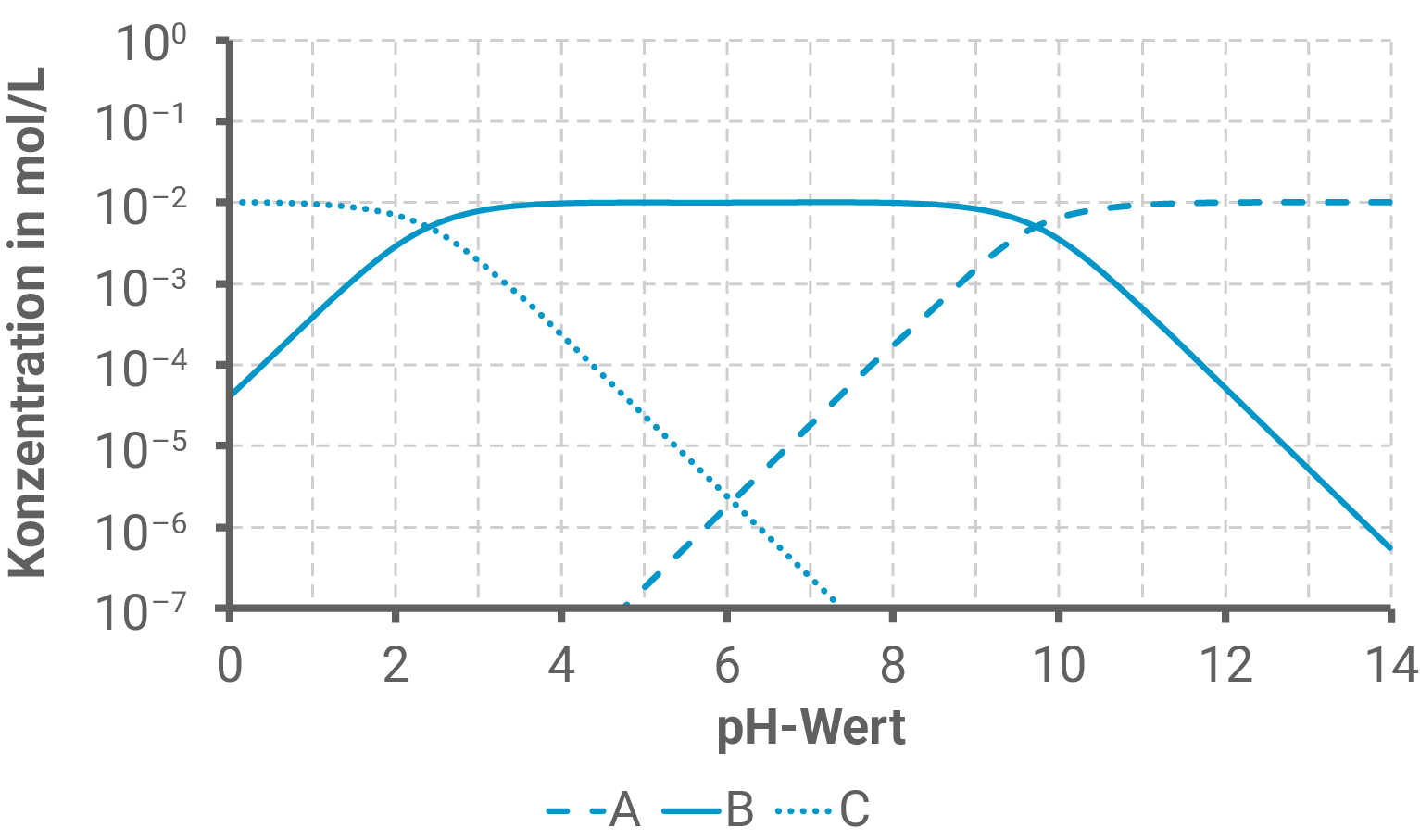
Formuliere zu den Kurven A bis C jeweils die entsprechende Strukturformel des Glycin-Moleküls und ermittle aus dem Diagramm den pKS1- Wert von Glycin.
Quellen:
1 Wang, J., Vanga, S. K., McCusker, C. & Raghavan, V. (2019). A Comprehensive Review on Kiwifruit Allergy: Pathogenesis, Diagnosis, Management, and Potential Modification of Allergens Through Processing. Comprehensive Reviews in Food Science And Food Safety, 18(2), 500–513.
2 Martin, H. (2016). Quantification of functional actinidin in whole kiwifruit extract using the selective cysteine proteinase inhibitor E-64. Journal of Food and Nutrition Research, 4(4), 243-250.
3 Dehkordi, A. M., Bari, M. R., Babaie, G. & Amiri, S. (2021). Application of actinidin as coagulants to produce Iranian white brined cheese: investigating the technological, textural, and sensorial properties. Journal Of Food Measurement & Characterization, 16.
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Ausschnitt der Aminosäuresequenz
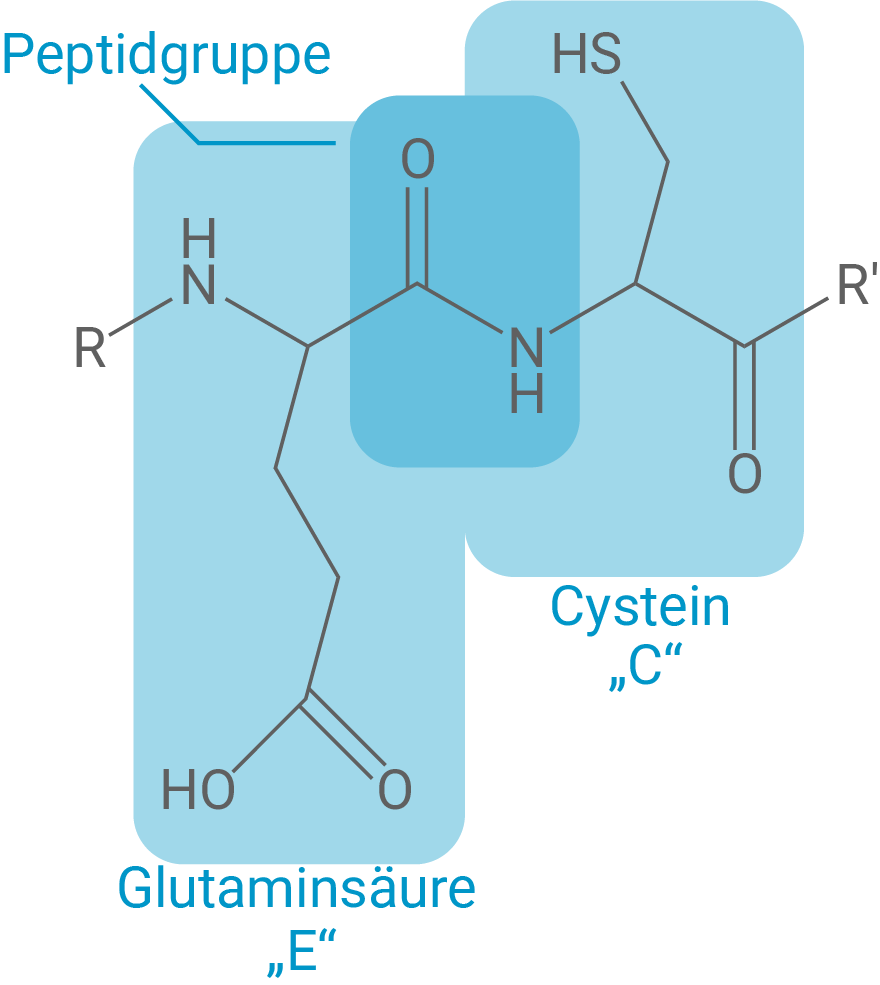
Neue funktionelle Gruppe und räumlicher Bau
Verknüpft werden die Aminosäuren über Peptidbindungen, die durch eine Kondensationsreaktion zwischen der Carboxylgruppe einer Aminosäure und der Aminogruppe der folgenden Aminosäure entstehen. Dabei bildet sich eine Amidgruppe
Diese funktionelle Gruppe weist eine besondere räumliche Struktur auf: Aufgrund der Mesomerie zwischen der Carbonylgruppe und dem Stickstoffatom besteht eine partielle Doppelbindung, wodurch die Peptidbindung planar ist und die freie Drehbarkeit eingeschränkt wird. Es liegen also zwei Grenzstrukturformeln vor, die die Elektronendelokalisierung zwischen
und
verdeutlichen. Dadurch ist die Peptidbindung stabilisiert und zeigt bevorzugt eine trans-Konfiguration der Substituenten, was für die räumliche Struktur von Proteinen entscheidend ist.
Problemloser Verzehr erhitzter Kiwi
Beim Verzehr erhitzter Kiwi-Produkte treten keine allergischen Symptome auf, weil das Allergen Actinidain durch Erhitzen denaturiert wird. Durch die Denaturierung verliert das Protein seine native Faltung, die denaturierten Actinidain-Moleküle passen nicht mehr nach Schlüssel-Schloss-Prinzip zu den Rezeptoren der histamintragenden Immunzellen. Folglich kommt es erst gar nicht zur Bindung an die Rezeptoren, was sonst die Ausschüttung von Histamin bewirken würde und eine allergische Reaktion bleibt aus (vgl. Abbildung 2).
Berechnung der mittleren Reaktionsgeschwindigkeit
Die mittlere Reaktionsgeschwindigkeit im Intervall bis
ergibt sich aus der Sekantensteigung der Konzentrations-Zeit-Kurve:
Da es sich um einen Konzentrationsabfall handelt, ist die Reaktionsgeschwindigkeit negativ. Daher wird der Betrag der Reaktionsgeschwindigkeit betrachtet:
Erklärung des Verlaufs der Messwerte
Die Abbildung lässt sich mithilfe der Modellvorstellung zur Enzymkinetik nach Michaelis und Menten beschreiben:
Enzym und Substrat
stehen im Gleichgewicht mit dem Enzym-Substrat-Komplex
Der
kann entweder zurück zu
und
zerfallen oder zusätzlich zum Produkt
reagieren, wobei
wieder freigesetzt wird.
Im Bereich A steigt die gemessene Aktivität mit der Substratkonzentration nahezu proportional an, weil nach dem Michaelis-Menten-Modell die meisten Enzymzentren noch frei sind; Die -Bildung erfolgt mit zunehmender Substratkonzentration häufiger und die Reaktion ist deshalb als Reaktion erster Ordnung substratabhängig erkennbar.
Im Bereich B nähert sich die Kurve einem Plateau, die aktiven Zentren sind weitgehend mit Substrat besetzt. Das Enzym arbeitet mit nahezu maximaler Reaktionsgeschwindigkeit und die Reaktionsgeschwindigkeit wird durch die vollständige Sättigung substratunabhängig (näherungsweise nullte Ordnung).
Diese Zusammenhänge werden qualitativ durch die Michaelis-Menten-Gleichung beschrieben:
Für die Grenzfälle in Abschnitt A und B lassen sich hierbei die besonderen Beziehungen zeigen.
Bei kleinen (Abschnitt A) gilt:
Bei großen (Abschnitt B) hingegen:
Skizze des zu erwartenden Versuchsergebnisses
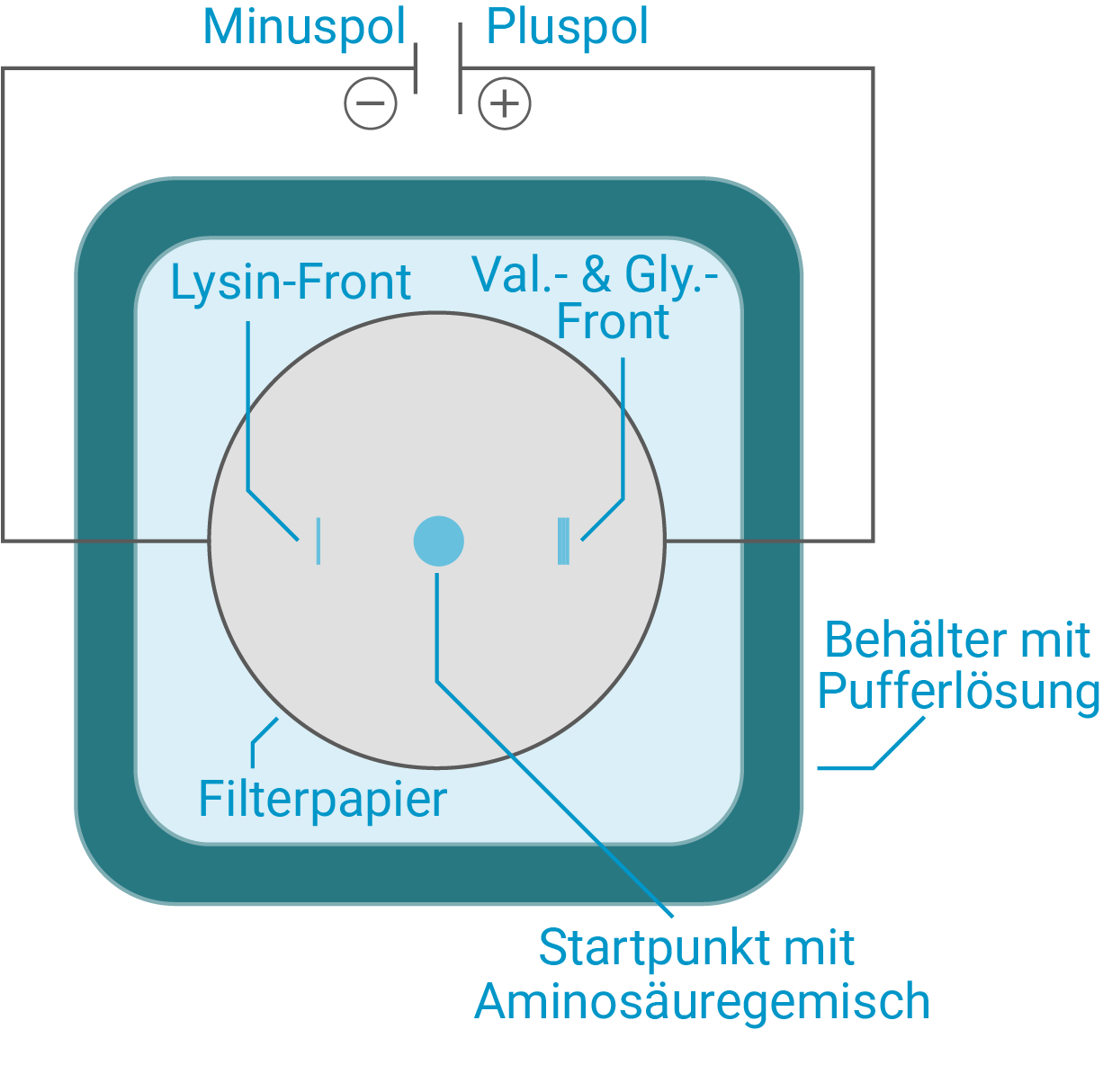
Ist
Ist
Die Wanderung der Aminosäuren in der Pufferlösungen erfolgt dementsprechend zum entgegengesetzt geladenen elektrischen Pol.
Eignung des Versuchs zur eindeutigen Auftrennung der Aminosäuren von Casein
Für eine eindeutige Auftrennung aller Aminosäuren aus Casein ist dieser einfache Papierelektrophorese-Ansatz bei nur einem pH-Wert nicht ausreichend. So sind selbst bei nur drei Aminosäuren im Probeexperiment schon lediglich zwei Fronten zu erwarten. Hierbei lässt sich Lysin klar erkennen, da es zum Minuspol wandert, während die anderen beiden Aminosäuren zum Pluspol wandern. Da das Filterpapier jedoch wenig Widerstand beim Wandern der Aminosäurefronten leistet, ist zu erwarten, dass sich Valin und Glycin nicht als eigene Banden trennen. Der IEP beider Aminosäuren ist nahezu gleich und lediglich das höhere Ladung-zu-Masse-Verhältnis beim Glycin könnte es schneller wandern und eine eigene Bande bilden lassen, doch wegen des schon genannten fehlenden Widerstands scheint auch dies unwahrscheinlich.
Zu all dem hinzu kommt, dass sich bei Casein statt nur drei, insgesamt sogar 18 Aminosäuren beim Abbau freisetzen; deren verlässliche Auftrennung durch die postulierte Methode scheint also sehr unverlässlich.
Erforderlich für eine versprechendere Trennung aller Aminosäuren wären zum Beispiel andere Puffer-pH-Werte, längere Laufzeiten, Trägermedien mit geringerer Diffusion oder eine isoelektrische Fokussierung.
Berechnung zur Herstellung der Pufferlösung
Mit der Henderson-Hasselbalch-Gleichung
gilt mit
Mit dem benötigtem Volumen lässt sich die Stoffmenge von Natriumhydrogenphosphat
und mit der Molmasse
schließlich die benötigte Masse berechnen:
Die benötigte Masse an Natriumhydrogenphosphat, die zur Herstellung dieser Pufferlösung benötigt wird, beträgt somit
Strukturformeln und pKS1-Wert des Glycin-Moleküls
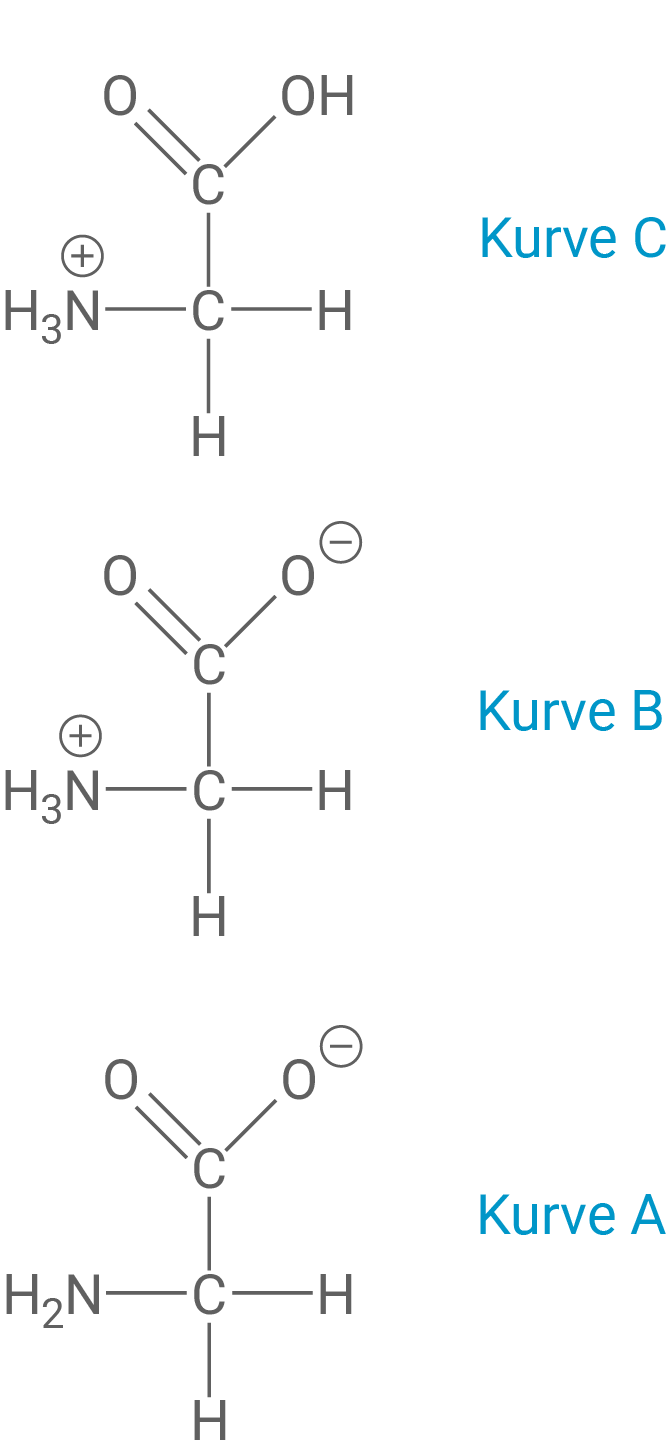
Zur Bestimmung des pKS1-Werts von Glycin kann die Henderson-Hasselbalch-Gleichung genutzt werden:
In diesem Fall ist die Base die deprotonierte Carboxylgruppe
Am Punkt, bei dem die Konzentrationen beider Formen gleich sind, lässt sich der pKS-Wert leicht bestimmen, da hier gilt:
Und somit entspricht der pKS1-Wert dem pH-Wert am Schnittpunkt von Kurven B und C, also ungefähr