Vorschlag A – Abgase von Dieselmotoren
Dieselkraftstoff besteht aus einem Gemisch verschiedener flüssiger Kohlenwasserstoff-Verbindungen und bildet den Treibstoff der Kraftfahrzeuge mit Dieselmotoren.
Um die Entzündlichkeit von verschiedenen Dieselkraftstoffen beurteilen zu können, wurde die Cetanzahl eingeführt. Dabei wird ein Dieselkraftstoff mit verschiedenen Gemischen aus leicht entzündlichem Cetan ( -Hexadecan) und zündträgem 1-Methylnapthalin verglichen.
Bei der Verbrennung von Dieselkraftstoff bilden sich ungewollt auch Stickstoffoxide. Aufgrund ihrer schädlichen Wirkung auf die Atmungsorgane sind diese Stoffe, die man oft unter dem Kürzel
-Hexadecan) und zündträgem 1-Methylnapthalin verglichen.
Bei der Verbrennung von Dieselkraftstoff bilden sich ungewollt auch Stickstoffoxide. Aufgrund ihrer schädlichen Wirkung auf die Atmungsorgane sind diese Stoffe, die man oft unter dem Kürzel  zusammenfasst, immer wieder in der umweltpolitischen Diskussion. Um ihren Ausstoß zu reduzieren, setzt man in Dieselfahrzeugen seit einigen Jahren die sogenannte SCR-Technologie ein. Dabei wird Harnstoff in den heißen Abgas-Strom eingespritzt.
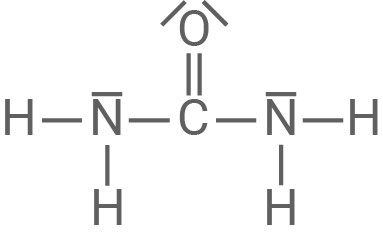
Aufgrund seines Molekülbaus kann man Harnstoff zur Stoffgruppe der sogenannten Carbonsäureamide zählen. Ein weiterer Vertreter dieser Gruppe ist Ethansäureamid.
zusammenfasst, immer wieder in der umweltpolitischen Diskussion. Um ihren Ausstoß zu reduzieren, setzt man in Dieselfahrzeugen seit einigen Jahren die sogenannte SCR-Technologie ein. Dabei wird Harnstoff in den heißen Abgas-Strom eingespritzt.
Aufgrund seines Molekülbaus kann man Harnstoff zur Stoffgruppe der sogenannten Carbonsäureamide zählen. Ein weiterer Vertreter dieser Gruppe ist Ethansäureamid.
Mögliche Konstitutionsisomere von
Von der Verbindung Hexadecan existieren 10359 Konstitutionsisomere (Strukturisomere).
Konstitutionsisomer A ist ein Konstitutionsisomer der Verbindung, das drei verschiedene Alkyl-Substituenten sowie mindestens ein asymmetrisches C-Atom enthält.
Konstitutionsisomer B ist ein Konstitutionsisomer der Verbindung, das kein asymmetrisches C-Atom enthält.
 , einer wässrigen Harnstoff-Lösung, in den Abgastrakt des Fahrzeugs eingespritzt.
Der eingespritzte Harnstoff wird nun durch Hitze zu Isocyansäure
, einer wässrigen Harnstoff-Lösung, in den Abgastrakt des Fahrzeugs eingespritzt.
Der eingespritzte Harnstoff wird nun durch Hitze zu Isocyansäure  und Ammoniak
und Ammoniak  zersetzt (Thermolyse-Reaktion). Die gebildete Isocyansäure reagiert anschließend mit Wasser zu weiterem Ammoniak und Kohlenstoffdioxid (Hydrolyse-Reaktion).
Der gebildete Ammoniak ist Ausgangsstoff für die eigentliche Reaktion im SCR-Katalysator und reagiert in Redox-Reaktionen mit den Stickstoffoxiden zu den ungiftigen Stoffen Stickstoff und Wasserdampf.
Zu den Reaktionen im SCR-Katalysator existieren je nach Abgas-Temperatur unterschiedliche Varianten, so z.B. die Standard-SCR und die Schnelle SCR:
Bei der Standard-SCR-Reaktion reagieren
zersetzt (Thermolyse-Reaktion). Die gebildete Isocyansäure reagiert anschließend mit Wasser zu weiterem Ammoniak und Kohlenstoffdioxid (Hydrolyse-Reaktion).
Der gebildete Ammoniak ist Ausgangsstoff für die eigentliche Reaktion im SCR-Katalysator und reagiert in Redox-Reaktionen mit den Stickstoffoxiden zu den ungiftigen Stoffen Stickstoff und Wasserdampf.
Zu den Reaktionen im SCR-Katalysator existieren je nach Abgas-Temperatur unterschiedliche Varianten, so z.B. die Standard-SCR und die Schnelle SCR:
Bei der Standard-SCR-Reaktion reagieren  Ammoniak mit
Ammoniak mit  Stickstoffmonooxid und
Stickstoffmonooxid und  Sauerstoff zu
Sauerstoff zu  Stickstoff und
Stickstoff und  Wasserdampf.
Bei der Schnellen SCR-Reaktion reagiert Ammoniak mit Stickstoffmonooxid und Stickstoffdioxid zu Stickstoff und Wasserdampf.
Wasserdampf.
Bei der Schnellen SCR-Reaktion reagiert Ammoniak mit Stickstoffmonooxid und Stickstoffdioxid zu Stickstoff und Wasserdampf.
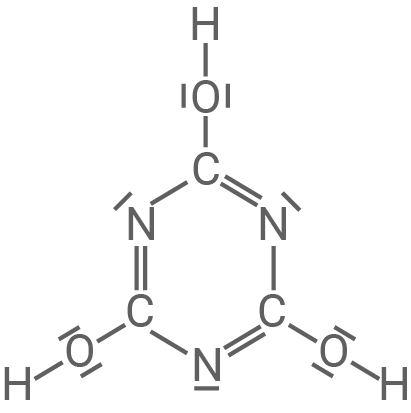 Cyanursäure ist eine sogenannte heteroaromatische Verbindung. Eine solche heteroaromatische Verbindung leitet sich in ihrem Grundgerüst formal von Benzol ab, wobei hier drei Kohlenstoff-Atome durch Stickstoff-Atome ersetzt sind. Diese Stickstoff-Atome sind
Cyanursäure ist eine sogenannte heteroaromatische Verbindung. Eine solche heteroaromatische Verbindung leitet sich in ihrem Grundgerüst formal von Benzol ab, wobei hier drei Kohlenstoff-Atome durch Stickstoff-Atome ersetzt sind. Diese Stickstoff-Atome sind  -hybridisiert.
Unter bestimmten Bedingungen kann sich Cyanursäure in einer Gleichgewichtsreaktion zur sogenannten Isocyanursäure umlagern, indem es im Molekül zu einer dreifachen intramolekularen Protonenwanderung kommt. Isocyanursäure zeigt keine aromatischen Eigenschaften.
-hybridisiert.
Unter bestimmten Bedingungen kann sich Cyanursäure in einer Gleichgewichtsreaktion zur sogenannten Isocyanursäure umlagern, indem es im Molekül zu einer dreifachen intramolekularen Protonenwanderung kommt. Isocyanursäure zeigt keine aromatischen Eigenschaften.
1.1
Cetan heißt mit wissenschaftlichem Namen  -Hexadecan. Hiervon existieren zahlreiche Konstitutionsisomere (Strukturisomere, Material 1).
Zeichne jeweils die Strukturformel für ein Beispiel von Konstitutionsisomer A sowie für ein Beispiel von Konstitutionsisomer B und beschrifte in Konstitutionsisomer A mindestens ein asymmetrisches C-Atom.
Benenne die gezeichneten Konstitutionsisomere A und B gemäß der IUPAC-Nomenklatur.
Hinweis
-Hexadecan. Hiervon existieren zahlreiche Konstitutionsisomere (Strukturisomere, Material 1).
Zeichne jeweils die Strukturformel für ein Beispiel von Konstitutionsisomer A sowie für ein Beispiel von Konstitutionsisomer B und beschrifte in Konstitutionsisomer A mindestens ein asymmetrisches C-Atom.
Benenne die gezeichneten Konstitutionsisomere A und B gemäß der IUPAC-Nomenklatur.
Hinweis
Die stereochemische Konfiguration muss im Rahmen der Benennung nicht angegeben werden.
Die stereochemische Konfiguration muss im Rahmen der Benennung nicht angegeben werden.
(6 BE)
1.2
Material 2 beschreibt die wesentlichen Vorgänge zur Abgasbehandlung in einem SCR-Katalysator.
Formuliere jeweils die Reaktionsgleichung für die Thermolyse-Reaktion von Harnstoff sowie für die Hydrolyse-Reaktion von Isocyansäure (Material 2).
Formuliere für die Standard-SCR-Reaktion die Reaktionsgleichung (Material 2) und berechne mit Hilfe von Material 3 die Standard-Reaktionsenthalpie.
Formuliere für die Schnelle SCR-Reaktion (Material 2) die Reaktionsgleichung und zeige unter Angabe der wesentlichen Oxidationszahlen und Elektronenübergänge, dass es sich um eine Redox-Reaktion handelt.
(13 BE)
1.3
Eine handelsübliche AdBlue -Lösung hat eine Dichte von
-Lösung hat eine Dichte von  und enthält einen Massenanteil von
und enthält einen Massenanteil von  Harnstoff.
Berechne die in 1 Liter AdBlue
Harnstoff.
Berechne die in 1 Liter AdBlue -Lösung enthaltene Stoffmenge an Harnstoff sowie die gesamte Stoffmenge an Ammoniak, die daraus gebildet werden kann.
Hinweis
-Lösung enthaltene Stoffmenge an Harnstoff sowie die gesamte Stoffmenge an Ammoniak, die daraus gebildet werden kann.
Hinweis
Berücksichtige die bei der Thermolyse-Reaktion und Hydrolyse-Reaktion (Material 2) entstehende Gesamtmenge an Ammoniak. Bestimme anschließend die Stoffmenge an Stickstoffmonooxid, die mit dieser Stoffmenge Harnstoff insgesamt im Standard-SCR-Verfahren (Material 2) umgesetzt werden kann.
Berücksichtige die bei der Thermolyse-Reaktion und Hydrolyse-Reaktion (Material 2) entstehende Gesamtmenge an Ammoniak. Bestimme anschließend die Stoffmenge an Stickstoffmonooxid, die mit dieser Stoffmenge Harnstoff insgesamt im Standard-SCR-Verfahren (Material 2) umgesetzt werden kann.
(7 BE)
1.4
Ammoniak hat einen  -Wert von
-Wert von  und bildet beim Einleiten in Wasser eine alkalische Lösung. Auch Methylamin (Aminomethan) bildet beim Einleiten in Wasser eine alkalische Lösung.
Beschreibe auch mit Hilfe einer Reaktionsgleichung sowie unter Verwendung des Donator-Akzeptor-Konzeptes die Bildung der alkalischen Lösung beim Einleiten von Ammoniak in Wasser.
Erläutere allgemein die Aussage des
und bildet beim Einleiten in Wasser eine alkalische Lösung. Auch Methylamin (Aminomethan) bildet beim Einleiten in Wasser eine alkalische Lösung.
Beschreibe auch mit Hilfe einer Reaktionsgleichung sowie unter Verwendung des Donator-Akzeptor-Konzeptes die Bildung der alkalischen Lösung beim Einleiten von Ammoniak in Wasser.
Erläutere allgemein die Aussage des  -Wertes und entscheide, ob Methylamin (Aminomethan) einen im Vergleich zu Ammoniak höheren oder niedrigeren
-Wertes und entscheide, ob Methylamin (Aminomethan) einen im Vergleich zu Ammoniak höheren oder niedrigeren  -Wert hat.
-Wert hat.
(10 BE)
1.5
Gelingt im Abgassystem keine vollständige Zersetzung des Harnstoffs, so können sich dort aus der Isocyansäure feste Ablagerungen aus Cyanursäure bilden.
Cyanursäure ist eine Verbindung, die sich im Labor unter bestimmten Bedingungen zu Isocyanursäure umwandeln kann (Material 4). Begründe, dass Cyanursäure ebenso wie Benzol eine aromatische Verbindung ist. Formuliere die Strukturformel von Isocyanursäure.
Cyanursäure ist eine Verbindung, die sich im Labor unter bestimmten Bedingungen zu Isocyanursäure umwandeln kann (Material 4). Begründe, dass Cyanursäure ebenso wie Benzol eine aromatische Verbindung ist. Formuliere die Strukturformel von Isocyanursäure.
(7 BE)
1.6
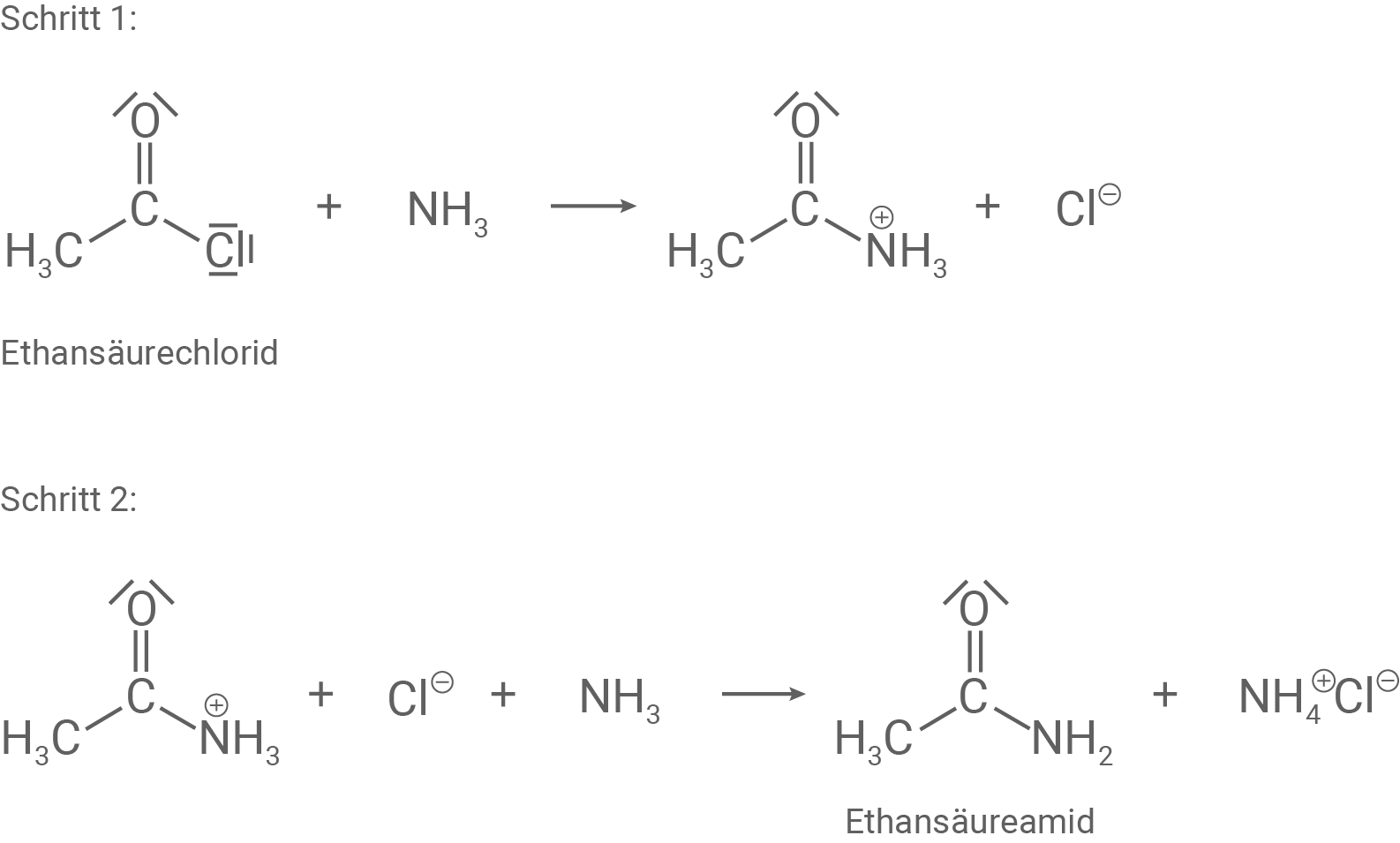
Material 5 beschreibt einen Weg zur Herstellung eines Carbonsäureamids im Labor.
Entwickle unter Verwendung von Strukturformeln mit bindenden und nicht bindenden Elektronenpaaren einen möglichen Reaktionsmechanismus für Schritt 1 der Synthese von Ethansäureamid (Material 5).
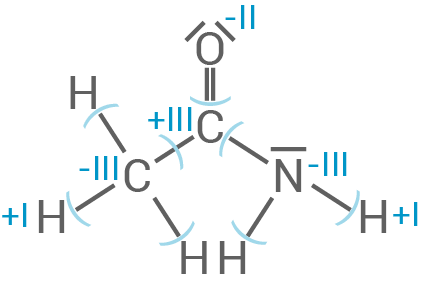
Gib für das Ethansäureamid-Molekül die Oxidationszahlen der Kohlenstoff-Atome sowie des Sauerstoff-Atoms und des Stickstoff-Atoms an.
(7 BE)
(50 BE)
Material 1
Mögliche Konstitutionsisomere von  -Hexadecan
-Hexadecan
Von der Verbindung Hexadecan existieren 10359 Konstitutionsisomere (Strukturisomere).
Konstitutionsisomer A ist ein Konstitutionsisomer der Verbindung, das drei verschiedene Alkyl-Substituenten sowie mindestens ein asymmetrisches C-Atom enthält.
Konstitutionsisomer B ist ein Konstitutionsisomer der Verbindung, das kein asymmetrisches C-Atom enthält.
Material 2
Abgasbehandlung im SCR-Katalysator
Die im Dieselmotor während des Verbrennungsprozesses entstehenden Stickstoffoxide (z.B. Stickstoffmonooxid und Stickstoffdioxid) werden im Rahmen der SCR-Technologie (Selective Catalytic Reduction oder Selektive katalytische Reduktion) zunächst über einen Sensor analysiert. Je nach Konzentration werden dann unterschiedliche Mengen an sogenanntem AdBlue
Harnstoff
Material 3
Thermodynamische Daten
| Stoff | Molare Standardbildungs- enthalpie |
|---|---|
| Ammoniak | |
| Sauerstoff | |
| Stickstoff | |
| Stickstoffmonoxid | |
| Wasser (gasförmig) |
Material 4
Cyanursäure und Isocyanursäure

Cyanursäure
Material 5
Herstellung eines Carbonsäureamids
Im Labor kann man ein Carbonsäureamid wie zum Beispiel Ethansäureamid unter anderem nach folgenden Reaktionsschritten herstellen:
1.1
Konstitutionsisomer A
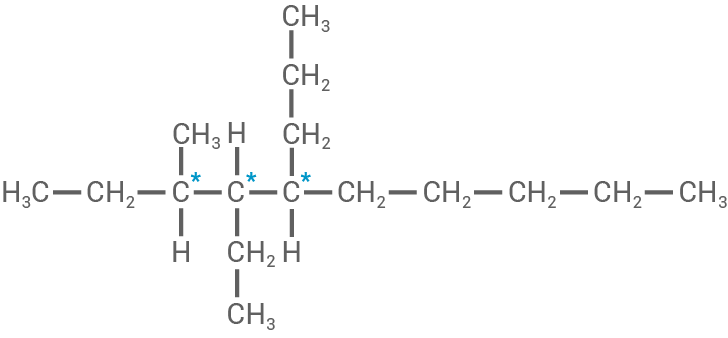 Die asymmetrischen
Die asymmetrischen  -Atome sind mit * gekennzeichnet. Diese besitzen vier verschiedene Substituenten.
Konstitutionsisomer B
-Atome sind mit * gekennzeichnet. Diese besitzen vier verschiedene Substituenten.
Konstitutionsisomer B
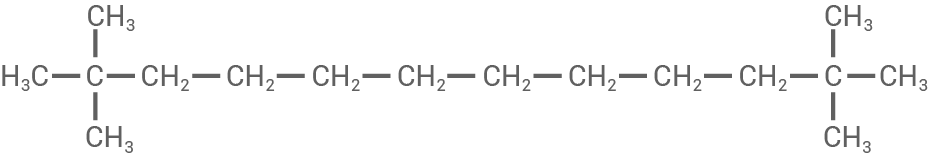

4-Ethyl-3-methyl-5-propyldecan
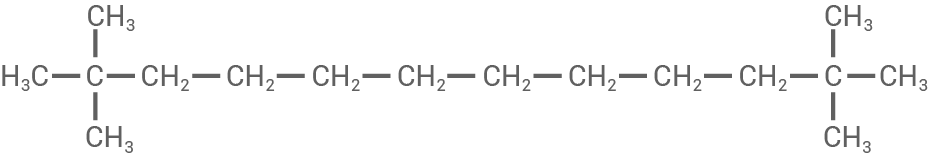
2,2,11,11-Tetramethyldodecan
1.2
Thermolyse-Reaktion


 Hydrolyse-Reaktion
Hydrolyse-Reaktion


 Standard-SCR-Reaktion
Standard-SCR-Reaktion

 Berechnung der Standard-Reaktionsenthalpie
Gegeben sind die Standard-Bildungsenthalpien
Berechnung der Standard-Reaktionsenthalpie
Gegeben sind die Standard-Bildungsenthalpien  es gilt:
es gilt:

 Daraus folgt:
Schnelle SCR-Reaktion
Daraus folgt:
Schnelle SCR-Reaktion
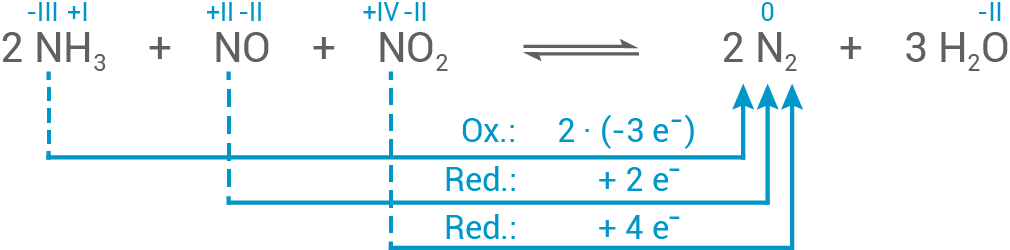

- Die Oxidationszahlen zeigen, dass insgesamt 6 Elektronen übertragen werden.
- Das Stickstoffatom von
wird oxidiert: -III
+/-0
- Das Stickstoffatom von
wird reduziert: +II
+/-0
- Das Stickstoffatom von
wird ebenfalls reduziert: +IV
+/-0
- Somit handelt es sich um eine Redoxreaktion.
Genauer gesagt findet eine Komproportionierung bzw. Synproportionierung statt, da Oxidation und Reduktion an Atomen des gleichen Elements ablaufen.
1.3
Berechnung der enthaltenen Stoffmenge  an Harnstoff
Gegeben sind
an Harnstoff
Gegeben sind 
 und ein Masseanteil von
und ein Masseanteil von  Es gilt:
Es gilt:
![\(\begin{array}[t]{rll}
m \,\text{(Harnstoff)}&=& m \,\text{(Lösung)} \cdot 32,5\,\% & \\[5pt]
&=& \dfrac{1090 \,\text g \cdot 32,5}{100} & \\[5pt]
&=& 354,25 \,\text g
\end{array}\)](https://www.schullv.de/resources/formulas/017dfdb452e8d451246dce8ff8738564f224d4534b07ef9df514ce86d733cb2e_light.svg) Mit
Mit  ergibt sich:
ergibt sich:
![\(\begin{array}[t]{rll}
n\,\text{(Harnstoff)} &=& \dfrac{m\,\text{(Harnstoff)}}{M\,\text{(Harnstoff)}}& \\[5pt]
&=& \dfrac{354,25x}{60,04 \,\text g \cdot \text{mol}^{-1}}& \\[5pt]
&\approx& 5,9 \,\text{mol}
\end{array}\)](https://www.schullv.de/resources/formulas/30243f269642bf30efd902b4072bdf3f52b14a44d60ff4940714ba6eeac21589_light.svg) Berechnung der gesamten Stoffmenge an Ammoniak
Der Reaktionsgleichung lässt sich entnehmen, dass
Berechnung der gesamten Stoffmenge an Ammoniak
Der Reaktionsgleichung lässt sich entnehmen, dass  Harnstoff zu
Harnstoff zu  Ammoniak reagieren.
Daraus ergibt sich:
Ammoniak reagieren.
Daraus ergibt sich:
![\(\begin{array}[t]{rll}
n\,\text{(Ammoniak)} &=& 2 \cdot n\,\text{(Harnstoff)} & \\[5pt]
&=& 2 \cdot 5,9 \,\text{mol} & \\[5pt]
&=& 11,8 \,\text{mol}
\end{array}\)](https://www.schullv.de/resources/formulas/ab47fb511465b144ff64016834c4b143ce37771c97e0f8528ca9f0dfaa9f2889_light.svg) Stoffmenge an Stickstoffmonooxid, die insgesamt umgesetzt werden kann
In der Standard-SCR-Reaktion reagieren
Stoffmenge an Stickstoffmonooxid, die insgesamt umgesetzt werden kann
In der Standard-SCR-Reaktion reagieren  und
und  in einem
in einem  Verhältnis (siehe Reaktionsgleichung).
Es gilt:
Verhältnis (siehe Reaktionsgleichung).
Es gilt:
 Es können also
Es können also  schädliches Stickstoffmonoxid zu Stickstoff umgesetzt werden.
schädliches Stickstoffmonoxid zu Stickstoff umgesetzt werden.
1.4
Bildung der alkalischen Lösung
Das Einleiten von Ammoniak in Wasser lässt sich mit folgender Reaktionsgleichung beschreiben:



 -Wertes
-Wertes
- Das Donator-Akzeptor-Prinzip beschreibt die Übertragung eines Protons auf einen Reaktionspartner.
- Wird Ammoniak in Wasser eingeleitet, findet eine Protolyse statt. Wasser gibt hierbei ein Proton
ab, welches vom Ammoniak aufgenommen wird.
- Somit fungiert
hier als Protonendonator und
als Protonenakzeptor.
- Es entsteht eine alkalische Lösung, weil bei dieser Reaktion Hydroxid-Ionen gebildet werden.
- Der
-Wert ist ein Maß für die Stärke einer Base.
- Je kleiner der
-Wert eines Stoffes ist, desto stärker ist die Base, also auch das Bestreben Protonen
-Ionen) aufzunehmen.
- Für Ammoniak ist ein
-Wert von
gegeben. Es handelt sich also um eine schwache Base.
- Bei Methylamin (Aminomethan) ist im Vergleich zu Ammoniak ein
-Atom durch eine Methyl-Gruppe ausgetauscht:
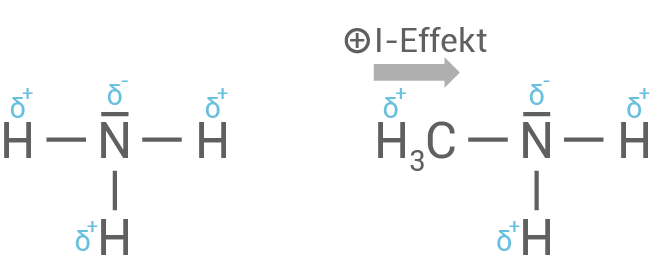
- Die Methyl-Gruppe übt einen
-Effekt auf das Stickstoff-Atom aus, der bei Ammoniak nicht vorhanden ist.
- Positive induktive Effekte wirken elektronenschiebend, wodurch die Elektronendichte am
des Methylamins erhöht ist. Die Protonenaufnahme wird damit erleichtert.
- Durch den
-Effekt ist also die Elektronendichte am Stickstoff-Atom höher, folglich auch die Affinität ein Proton zu binden, die Basizität somit stärker und damit der
-Wert niedriger.
- Ammoniak ist eine schwächere Base als Methylamin.
1.5
Begründung der aromatischen Verbindung
Hier ist Aromatizität vorhanden, da folgende Bedingungen erfüllt sind:
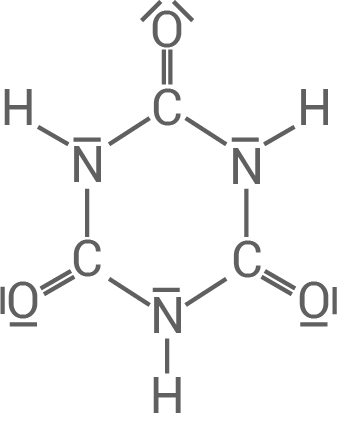
- Die Verbindung ist zyklisch.
- Sie ist planar, da alle Ringatome (also
und
des Rings)
-hybridisiert sind. D
- Die restlichen
-Orbitale stehen senkrecht zur Ringebene und wechselwirken durch Überlappung (oberhalb und unterhalb der Ringebene) in einem delokalisierten
-Elektronensystem.
- Die Verbindung besitzt
-Elektronen und mit
wird die Hückel-Regel erfüllt:
Anzahl der
-Elektronen
-Elektronen

1.6
Möglicher Reaktionsmechanismus
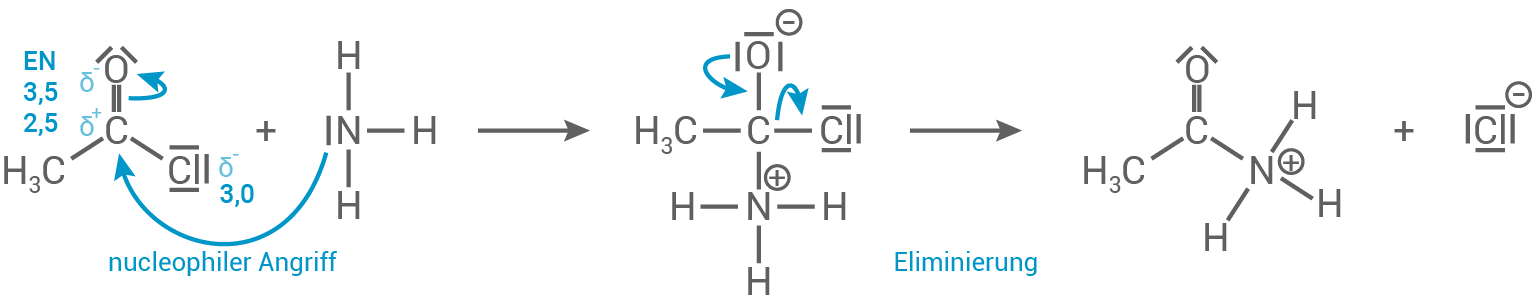

- Ammoniak greift nucleophil am positiv polarisierten
-Atom an.
- Das Chlorid-Ion ist eine gute Abgangsgruppe und spaltet sich in der zwitterionischen Zwischenstufe ab
Eliminierung.
- Es bildet sich zunächst die protonierte Form vom Ethansäureamid.

- Stickstoffatom: -III
- Sauerstoffatom: -II
- Jeweiliges Wasserstoffatom: +I
- Kohlenstoffatom der Methyl-Gruppe: -III
- Kohlenstoffatom der Carbonyl-Gruppe: +III