Vorschlag A – Rund ums Frühstück
Ein Frühstück besteht oftmals aus einem heißen Getränk, Backwaren sowie einem süßen Aufstrich oder alternativ Käse und Wurst. Wurst setzt sich aus verschiedenen Inhaltsstoffen zusammen. Ein wesentlicher Bestandteil von Wurst sind Proteine, die wiederum in ihrer Grundstruktur aus miteinander verknüpften Aminosäuren bestehen. Für das Löslichkeitsverhalten von Aminosäuren spielt ihr isoelektrischer Punkt (IEP) eine entscheidende Rolle.
Um Wurst vor einem vorzeitigen Verderben zu schützen, kann das Verfahren des Pökelns verwendet werden. Allerdings ist das Erhitzen von gepökelten Wurstwaren zu vermeiden, da die beim Pökeln verwendeten Nitrit-Ionen auch zu sogenannten Nitrosaminen umgesetzt werden können, von denen eine krebserregende Wirkung ausgehen kann.
Je nach persönlichem Geschmack wird als Heißgetränk Tee, Kaffee oder Kakao bevorzugt. Die zur Kaffee- bzw. Kakaoherstellung verwendeten Pflanzenteile werden allgemein als „Bohnen“ bezeichnet. Neben anderen wichtigen Inhaltsstoffen enthalten Kakaobohnen den Zucker Melibiose. Um ihre Aromen entfalten zu können müssen sowohl Kakaobohnen als auch Kaffeebohnen geröstet werden. Besonders wichtig für die Kaffeequalität sind die Gerbstoffe, zu denen auch organische Säuren gehören. Hier bildet die Chlorogensäure mit mehr als  den größten Anteil.
den größten Anteil.
 eingestellt. Die Lösung ist klar und farblos. In Schritt 1 des Versuchs wird so lange Salzsäure hinzugegeben, bis ein Feststoff als Niederschlag ausfällt. In Schritt 2 wird in dasselbe Reaktionsgefäß weitere Salzsäure gegeben, bis ein pH-Wert von
eingestellt. Die Lösung ist klar und farblos. In Schritt 1 des Versuchs wird so lange Salzsäure hinzugegeben, bis ein Feststoff als Niederschlag ausfällt. In Schritt 2 wird in dasselbe Reaktionsgefäß weitere Salzsäure gegeben, bis ein pH-Wert von  erreicht ist.
erreicht ist.
 -Ionen) versetzt. Insbesondere die Nitrit-Ionen hemmen die Vermehrung unerwünschter Bakterien in der Wurst und sorgen zusätzlich für eine bei manchen Wurstsorten erwünschte rötliche Farbe. Ein zu hoher Gehalt an Nitrit-Ionen in der Wurst kann beim Verzehr gesundheitliche Schäden auslösen.
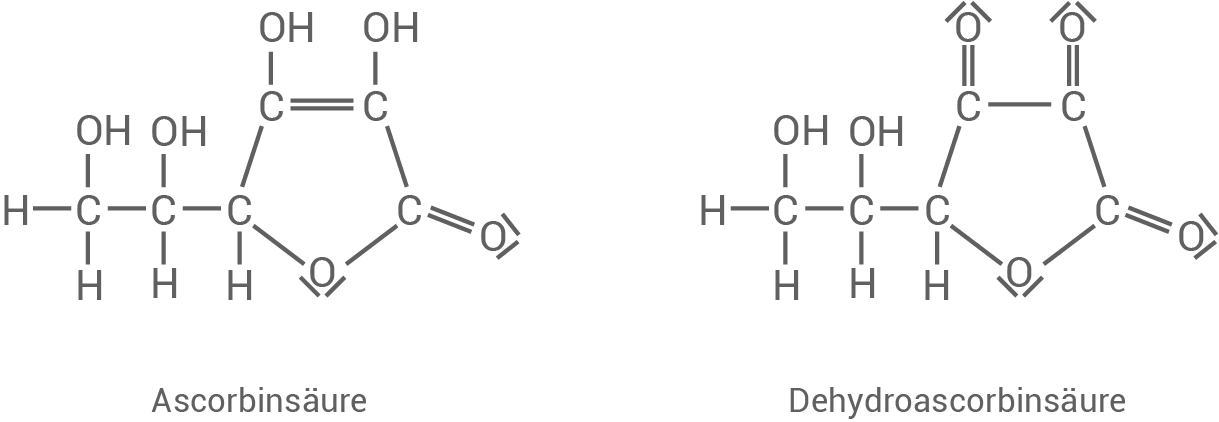
Zusätzlich werden beim Pökeln Hilfsstoffe eingesetzt, wie z.B. Ascorbinsäure.
-Ionen) versetzt. Insbesondere die Nitrit-Ionen hemmen die Vermehrung unerwünschter Bakterien in der Wurst und sorgen zusätzlich für eine bei manchen Wurstsorten erwünschte rötliche Farbe. Ein zu hoher Gehalt an Nitrit-Ionen in der Wurst kann beim Verzehr gesundheitliche Schäden auslösen.
Zusätzlich werden beim Pökeln Hilfsstoffe eingesetzt, wie z.B. Ascorbinsäure.
Nitrit-Ionen und Ascorbinsäure reagieren in saurer Lösung zu Stickstoffmonooxid Dehydroascorbinsäure und Wasser. Dadurch wird der Gehalt an Nitrit-Ionen in der Wurst verringert.
Dehydroascorbinsäure und Wasser. Dadurch wird der Gehalt an Nitrit-Ionen in der Wurst verringert.
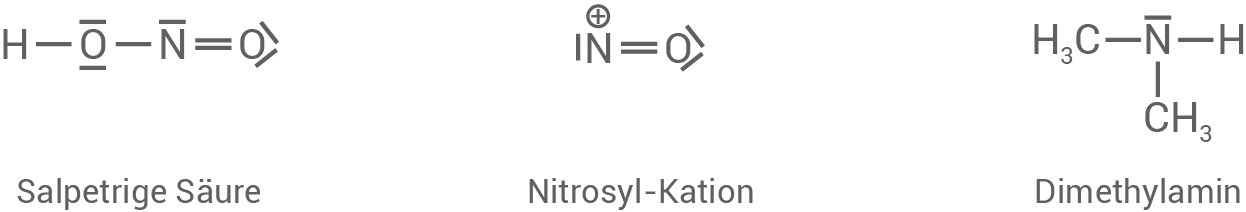
Zunächst wird das Nitrit-Ion protoniert, wobei sich salpetrige Säure bildet. Im Anschluss wird das
bildet. Im Anschluss wird das  -Molekül ebenfalls protoniert, wobei sich als Zwischenprodukt ein Kation bildet. Von diesem Kation wird Wasser abgespalten, wodurch das sogenannte Nitrosyl-Kation entsteht. Das Nitrosyl-Kation lässt sich durch zwei mesomere Grenzstrukturen darstellen; eine der beiden Grenzformeln ist unten angegeben.
Stufe 2: Bildung des N-Nitrosodimethylamin (NDMA)
-Molekül ebenfalls protoniert, wobei sich als Zwischenprodukt ein Kation bildet. Von diesem Kation wird Wasser abgespalten, wodurch das sogenannte Nitrosyl-Kation entsteht. Das Nitrosyl-Kation lässt sich durch zwei mesomere Grenzstrukturen darstellen; eine der beiden Grenzformeln ist unten angegeben.
Stufe 2: Bildung des N-Nitrosodimethylamin (NDMA)
Durch einen nucleophilen Angriff des freien Elektronenpaares des Stickstoff-Atoms des Dimethylamin-Moleküls am Stickstoff-Atom des Nitrosyl-Kations entsteht ein weiteres Kation als Zwischenprodukt. Daraus bildet sich durch eine Deprotonierung das N-Nitrosodimethylamin-Molekül.
1.1
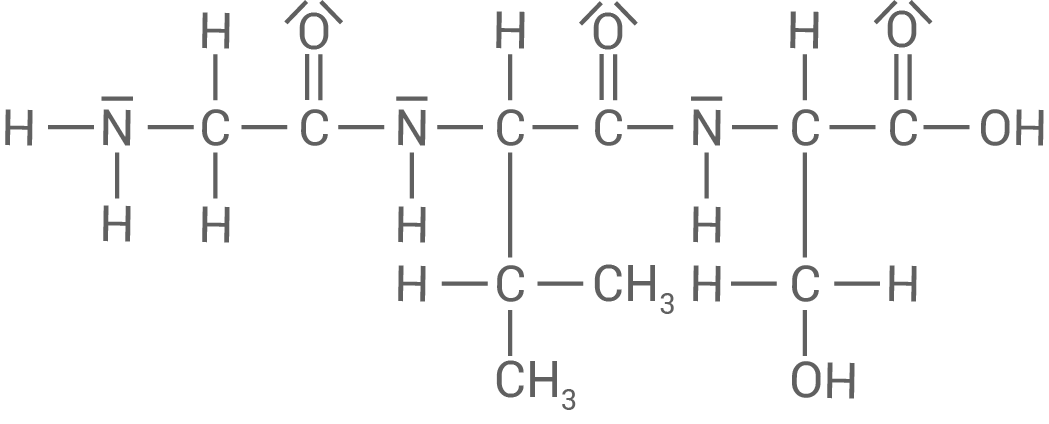
Formuliere für das Tripeptid (Gly-Val-Ser) aus den Aminosäuren Glycin (Aminoethansäure), Valin (L-2-Amino-3-methylbutansäure) und Serin (L-2-Amino-3-hydroxypropansäure) die Strukturformel.
Formuliere für Schritt 1 und Schritt 2 des in Material 1 beschriebenen Versuchs jeweils die Reaktionsgleichung.
Erläutere die Bildung des Feststoffs in Schritt 1 sowie die zu erwartende Beobachtung in Schritt 2.
(10 BE)
1.2
Formuliere für die Reaktion von Nitrit-Ionen mit Ascorbinsäure in saurer Lösung (Material 2) die Reaktionsgleichung und zeige anhand der wesentlichen Oxidationszahlen und der Elektronenübergänge, dass es sich um eine Redoxreaktion handelt.
Erläutere mithilfe des Orbitalmodells die Bindungsverhältnisse in einer  -Gruppe des Dehydroascorbinsäure-Moleküls.
Hinweis
-Gruppe des Dehydroascorbinsäure-Moleküls.
Hinweis
Auf den jeweiligen Hybridisierungszustand der zum Kohlenstoff-Atom der -Gruppe benachbarten Atome soll nicht eingegangen werden.
-Gruppe benachbarten Atome soll nicht eingegangen werden.
Auf den jeweiligen Hybridisierungszustand der zum Kohlenstoff-Atom der
(10 BE)
1.3
Zur Stoffklasse Nitrosamine, die beim Erhitzen gepökelter Wurst entstehen können, gehört auch das N-Nitrosodimethylamin (NDMA).
Formuliere basierend auf Material 3 den Reaktionsmechanismus zur Stufe 1 (Bildung des Nitrosyl-Kations) einschließlich einer weiteren mesomeren Grenzstruktur des Nitrosyl-Kations.
Formuliere den Reaktionsmechanismus zur Stufe 2 (Bildung von N-Nitrosodimethylamin, NDMA).
(6 BE)
1.4
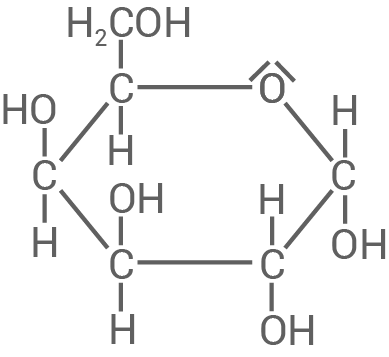
Der in der Kakaobohne enthaltene Zucker Melibiose ist ein Disaccharid, in dem das  -Atom der D-Galactose (Material 4) über eine
-Atom der D-Galactose (Material 4) über eine  -1,6-glycosidische Bindung mit D-Glucose verknüpft ist. Melibiose zeigt eine positive Reaktion bei der Fehling-Probe.
Formuliere ausgehend von Material 4 die Strukturformel von D-Galactose in der Fischer-Projektion sowie die Strukturformel des Disaccharids
-1,6-glycosidische Bindung mit D-Glucose verknüpft ist. Melibiose zeigt eine positive Reaktion bei der Fehling-Probe.
Formuliere ausgehend von Material 4 die Strukturformel von D-Galactose in der Fischer-Projektion sowie die Strukturformel des Disaccharids  -Melibiose in der Haworth-Struktur.
Beschreibe allgemein die Durchführung einer Fehling-Probe sowie die Beobachtungen bei ihrem positiven Verlauf. Erkläre den positiven Verlauf der Fehling-Probe bei
-Melibiose in der Haworth-Struktur.
Beschreibe allgemein die Durchführung einer Fehling-Probe sowie die Beobachtungen bei ihrem positiven Verlauf. Erkläre den positiven Verlauf der Fehling-Probe bei  -Melibiose.
-Melibiose.
(8 BE)
1.5
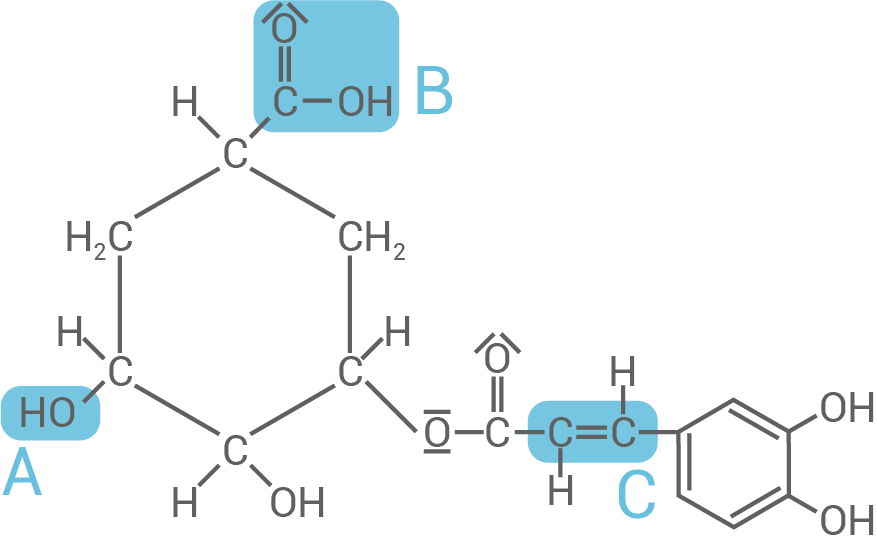
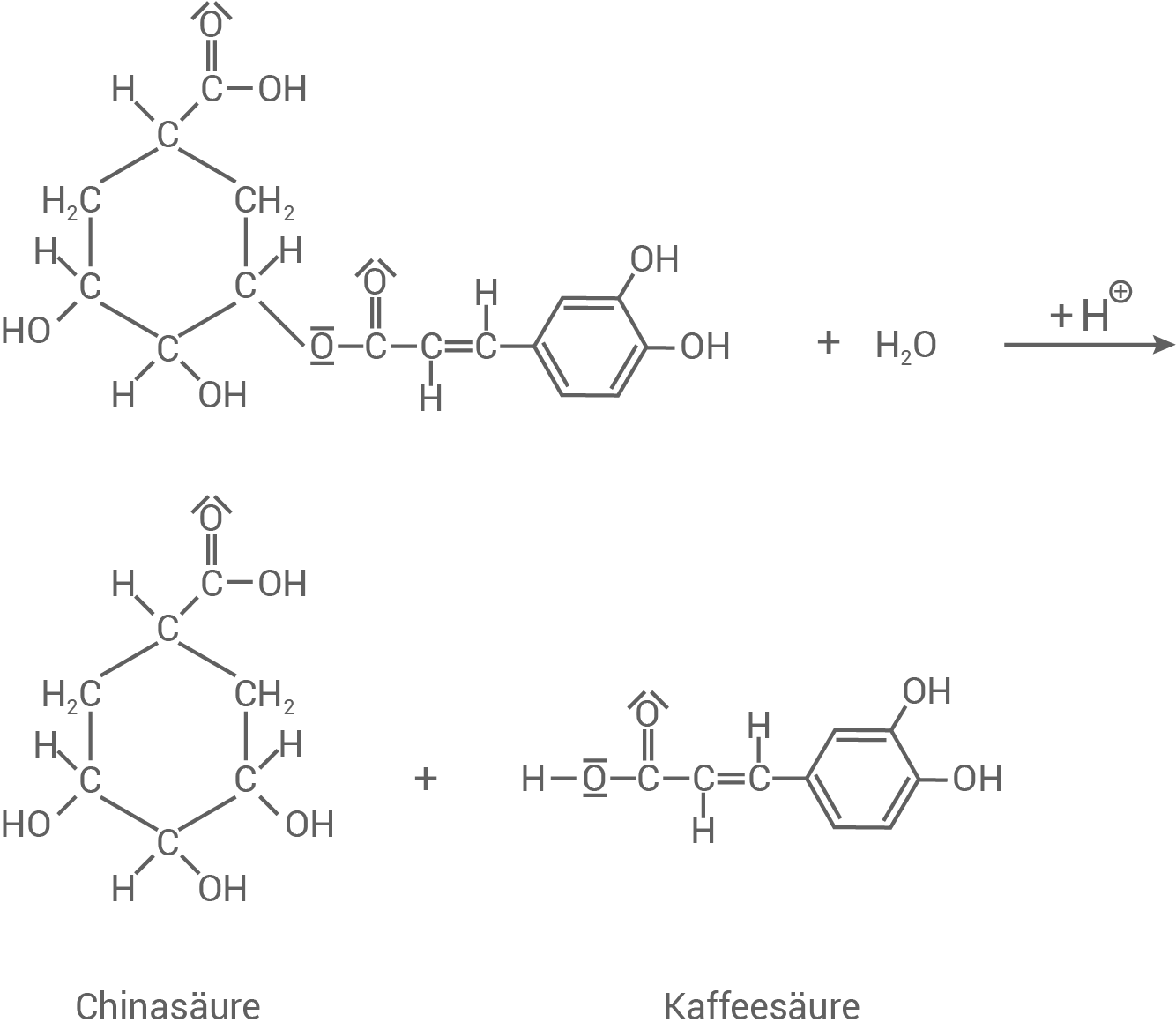
Unter bestimmten Bedingungen kann Chlorogensäure (Material 5) zu Kaffeesäure und Chinasäure hydrolysiert werden. Chinasäure ist im Gegensatz zu Kaffeesäure optisch aktiv. Chlorogensäure ist ein Molekül, das unterschiedliche funktionelle Gruppen aufweist. Allgemein zeigen diese funktionellen Gruppen für sie jeweils typische Reaktionen, die zu neuen Stoffklassen führen.
Benenne die in Material 5 mit A und B gekennzeichneten funktionellen Gruppen sowie die weitere im Chlorogensäure-Molekül noch nicht gekennzeichnete funktionelle Gruppe.
Benenne für die funktionelle Gruppe A zwei sowie für die funktionellen Gruppen B und C jeweils eine typische Reaktion und geben Sie die dabei jeweils entstehende Stoffklasse an.
Formuliere unter Verwendung von Strukturformeln die Reaktionsgleichung für die Hydrolyse von Chlorogensäure und begründe, bei welchem der Reaktionsprodukte es sich um die Chinasäure handelt.
(10 BE)
1.6
Kaffee, der durch eine Kaffeemaschine zubereitetet wurde, hat aufgrund der enthaltenen pflanzlichen Säuren einen pH-Wert von etwa  Steht der Kaffee drei Stunden in einer Kaffeekanne, so nimmt der Gehalt an Säuren im Getränk zu und der pH-Wert sinkt auf etwa
Steht der Kaffee drei Stunden in einer Kaffeekanne, so nimmt der Gehalt an Säuren im Getränk zu und der pH-Wert sinkt auf etwa  Unter anderem ist hierfür die Freisetzung von Kaffeesäure durch die hydrolytische Spaltung der Chlorogensäure verantwortlich.
Berechne die Stoffmenge an Oxonium-Ionen, die durch das Stehenlassen von Kaffee mit dem Volumen
Unter anderem ist hierfür die Freisetzung von Kaffeesäure durch die hydrolytische Spaltung der Chlorogensäure verantwortlich.
Berechne die Stoffmenge an Oxonium-Ionen, die durch das Stehenlassen von Kaffee mit dem Volumen  hinzugekommen sind.
Berechne die Stoffmengenkonzentration an reiner Kaffeesäure, durch die ebenfalls ein pH-Wert von
hinzugekommen sind.
Berechne die Stoffmengenkonzentration an reiner Kaffeesäure, durch die ebenfalls ein pH-Wert von  erreicht wird.
Hinweis
erreicht wird.
Hinweis
Die Carboxy-Gruppe der Kaffeesäure hat einen -Wert von
-Wert von  Gehe davon aus, dass es sich bei Kaffeesäure um eine schwache Säure handelt.
Gehe davon aus, dass es sich bei Kaffeesäure um eine schwache Säure handelt.
Die Carboxy-Gruppe der Kaffeesäure hat einen
(6 BE)
(50 BE)
Material 1
Valin in wässriger Lösung
Eine wässrige Valin-Lösung wird auf einen pH-Wert vonMaterial 2
Pökeln
Beim Pökeln wird die Wurst mit Kochsalz, Salzen der Salpetersäure sowie der Salpetrigen Säure (enthalten Nitrit-Ionen,Nitrit-Ionen und Ascorbinsäure reagieren in saurer Lösung zu Stickstoffmonooxid

Material 3
Bildung von N-Nitrosodimeethylamin (NDMA)
Stufe 1: Bildung des Nitrosyl-KationsZunächst wird das Nitrit-Ion protoniert, wobei sich salpetrige Säure
Durch einen nucleophilen Angriff des freien Elektronenpaares des Stickstoff-Atoms des Dimethylamin-Moleküls am Stickstoff-Atom des Nitrosyl-Kations entsteht ein weiteres Kation als Zwischenprodukt. Daraus bildet sich durch eine Deprotonierung das N-Nitrosodimethylamin-Molekül.

Material 4
 -D-Galactose
-D-Galactose

Material 5
Chlorogensäure

Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Strukturformel für ein Tripeptid (Gly-Val-Ser)
 Reaktionsgleichungen des beschriebenen Versuchs
Schritt 1:
Reaktionsgleichungen des beschriebenen Versuchs
Schritt 1:
D-Valin liegt überwiegend in anionischer Form vor, da herrscht.
herrscht.
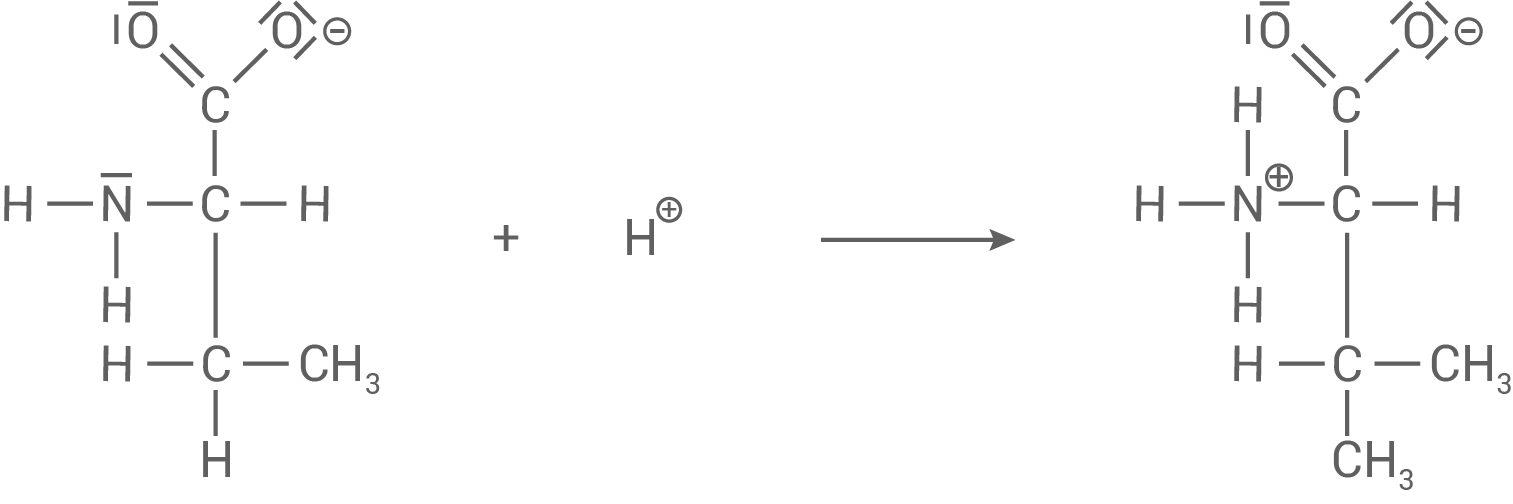 Schritt 2:
Schritt 2:
Die weitere Zugabe von Salzsäure bewirkt die anschließende Protonierung der Carboxylat-Gruppe.
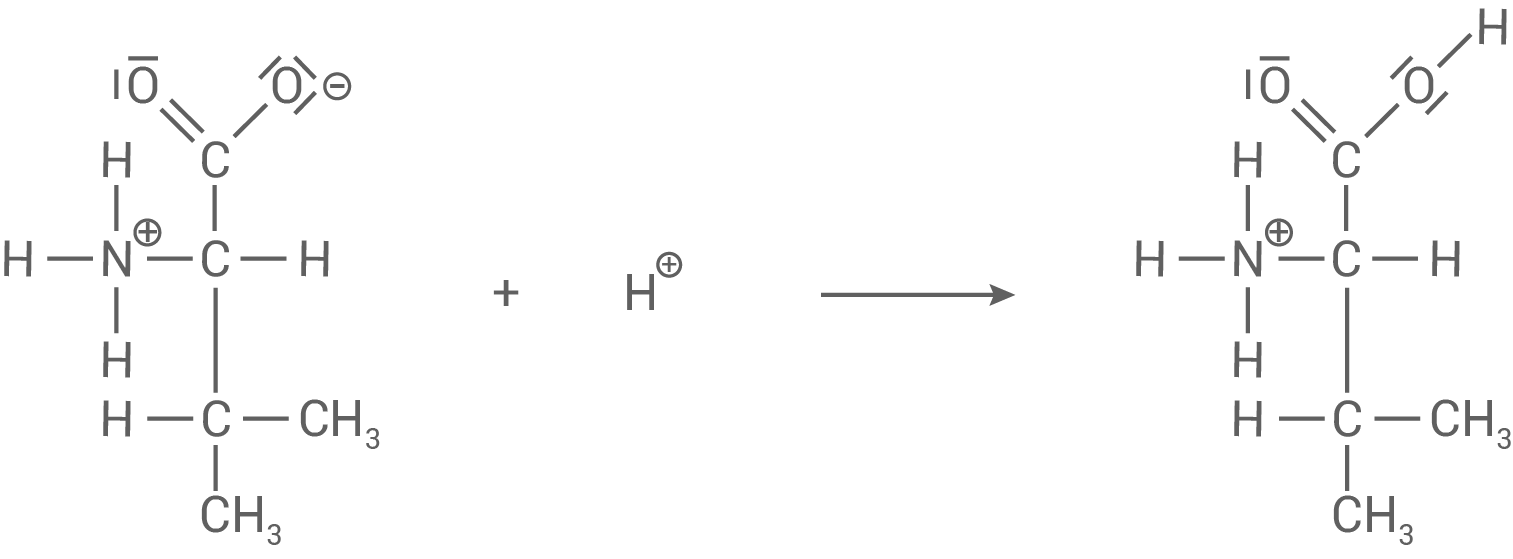 Erläuterung der Bildung des Feststoffs in Schritt 1
Erläuterung der Bildung des Feststoffs in Schritt 1

D-Valin liegt überwiegend in anionischer Form vor, da

Die weitere Zugabe von Salzsäure bewirkt die anschließende Protonierung der Carboxylat-Gruppe.

- Es entsteht durch die Zugabe der Salzsäure ein Zwitterion, wodurch die Löslichkeit des Valins stark abnimmt.
- Die Lösung wird trüb und es bildet sich eine Suspension, was auf die Bildung eines Niederschlags hinführt.
- Grund dafür ist, dass die Zwitterionen die Ausbildung von ionischen Wechselwirkungen zu anderen zwitterionischen Aminosäuren bewirken.
- Folglich nimmt die Wasserlöslichkeit ab.
- Der isoelektronische Punkt von Valin liegt bei
deshalb liegt Valin zu Beginn des Experiments in der anionischen Form vor.
- Sowohl die Carboxyl- als auch die Amino-Gruppe liegen im Alkalischen deprotoniert vor.
- Valin liegt durch die Hydratisierung der polaren Wasser-Moleküle überwiegend gelöst vor.
Beobachtung: keine Trübung, klare Lösung
- Da im ersten Schritt die basische Amino-Gruppe durch die Salzsäure protoniert wird, kommt es zur Ausbildung der zwitterionischen Form.
- Wird weiterhin Salzsäure hinzugegeben, kommt es zur Protonierung der Carboxyl-Gruppe.
- Valin liegt vollständig protoniert, in seiner kationischen Form vor.
- Aufgrund der Hydratisierung der polaren Wasser-Moleküle ist diese Form der Aminosäure wieder besser in Wasser löslich.
Beobachtung: Trübung verschwindet, die Lösung wird klar
1.2
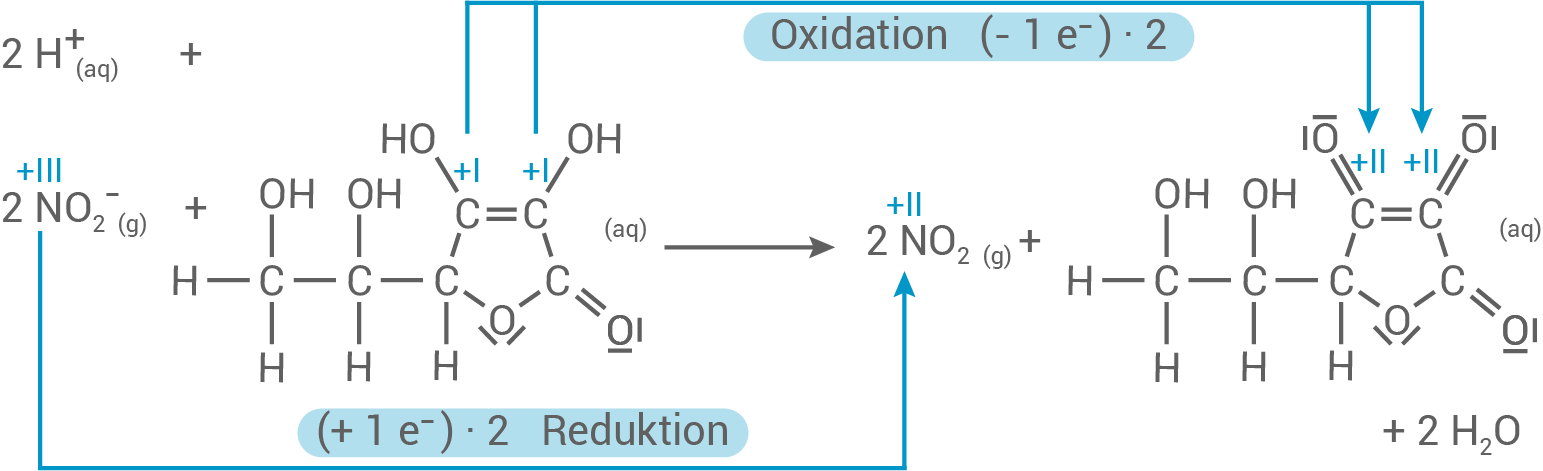
Reaktionsgleichung: Nitrit-Ionen mit Ascorbinsäure in saurer Lösung
 Erläuterung der Redoxreaktion
Erläuterung der Redoxreaktion
Doppelbindungen bestehen aus einer - und einer
- und einer  -Bindung, weswegen sich folgende Bindungsverhältnisse ergeben:
-Bindung, weswegen sich folgende Bindungsverhältnisse ergeben:

- Die Oxidationszahlen der Kohlenstoff-Atome der Ascorbinsäure steigen von + I auf + II. Damit findet eine Oxidation statt.
- Die Oxidationszahl des Stickstoffs sinkt von + III auf + II. Die Nitrit-Ionen nehmen die vom Kohlenstoff abgegebenen Elektronen auf und es findet eine Reduktion statt.
- Damit handelt es sich hier um eine Redoxreaktion.
Doppelbindungen bestehen aus einer
und
sind
-hybridisiert.
- Die
-Bindung ist auf die Überlappung von je einem
-Hybridorbital beider Atome zurückzuführen.
- Die
-Bindung entsteht durch die Überlappung der beiden unhybridisierten
-Orbitale, welche ober- und unterhalb der Kern-Kern-Bindungsachse stattfindet. Dabei sind nur die
-Orbitale mit gleicher Symmetrie und Raumrichtung beteiligt.
- Die beiden verbleibenden
-Hybridorbitale vom
fungieren als Aufenthaltsort für die zwei freien (ungebundenen) Elektronenpaare.
- Die beiden verbleibenden
-Hybridorbitale vom
bilden je eine weitere
-Bindung zu den benachbarten
-Atomen aus.
1.3
Formulierung des Reaktionsmechanismus
Stufe 1:
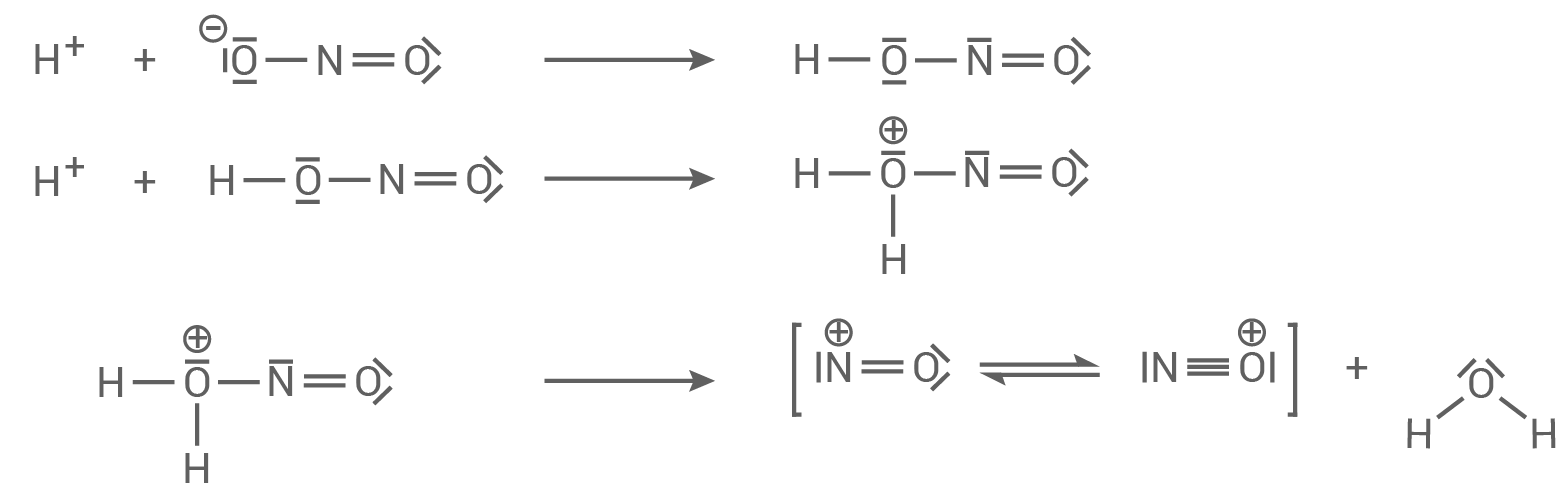 Stufe 2:
Stufe 2:



1.4
Formulierung der Strukturformeln
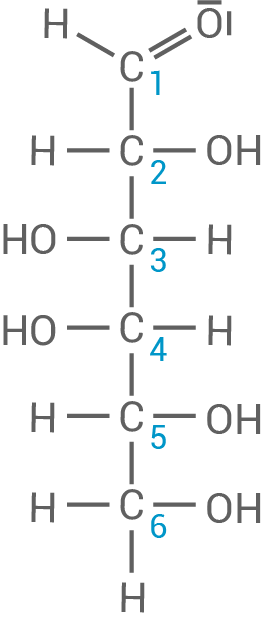

 -Melibiose in HAWORTH-Darstellung
Durchführung einer Fehling-Probe
-Melibiose in HAWORTH-Darstellung
Durchführung einer Fehling-Probe
 -Melibiose
-Melibiose

D-Galactose in FISCHER-Projektion

- Die durch die Kupfer
-Ionen hellblaue FEHLING-
-Lösung wird mit einer farblosen FEHLING-
-Lösung gemischt.
- Das FEHLING-Gemisch weist die charakteristische tiefblaue Farbe auf.
- Die Probelösung wird hinzugegeben und das Reaktionsgemisch anschließend erwärmt.
- Bei einem positiven Verlauf läuft eine Redoxreaktion ab. Es entstehen Kupfer
-Ionen, die einen roten Niederschlag bilden.
- Bei
-Melibiose handelt es sich um einen Disaccharid. Der Glucose-Baustein liegt hier also in halbacetalischer Form vor.
- In wässriger Lösung ist die Ringöffnung möglich, wodurch die leicht oxidierbare Aldehyd-Gruppe vorliegt.
- Mit der FEHLING-Probe wird diese Aldehyd-Gruppe nachgewiesen und fällt daher bei
-Melibiose positiv aus.
1.5
Benennung der funktionellen Gruppen
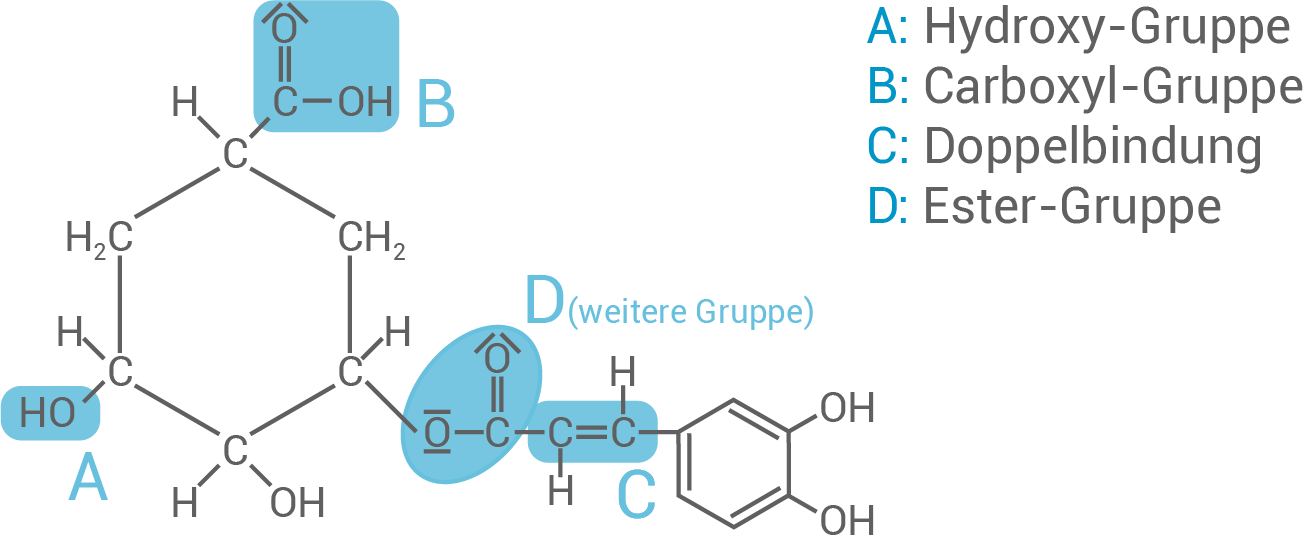 Typische Reaktionen für die funktionellen Gruppen
Hydroxy-Gruppe (A):
Typische Reaktionen für die funktionellen Gruppen
Hydroxy-Gruppe (A):

- Handelt es sich um einen sekundären Alkohol, d.h. die Hydroxy-Gruppe befindet sich an einem sekundären Kohlenstoff-Atom, kann dieser zu einem Alkanon bzw. Keton oxidiert werden. Hierbei findet eine Redoxreaktion statt.
- In saurer Lösung kann die Hydroxy-Gruppe mit einer Carboxyl-Gruppe zu einem Ester reagieren. Hierbei handelt es sich um eine Veresterung oder Kondensation.
- In saurer Lösung reagiert die Carboxyl-Gruppe mit einer Hydroxy-Gruppe. Hier findet eine Veresterung oder Kondensation statt, wobei ein Ester entsteht.
- Die
-Doppelbindung reagiert mit Halogenen oder Halogenwasserstoffsäuren. Diese sogenannten Additionsreaktionen verlaufen unter dem Mechanismus einer elektrophilen Addition und es entstehen Halogenalkane.

- Die Chinasäure ist optisch aktiv und besitzt daher mind. ein asymmetrisches Kohlenstoff-Atom (vier verschiedene Substituenten.
- Diese sind in der Lage, linear polarisiertes Licht zu drehen, was nur beim linken Reaktionsprodukt der Fall ist.
1.6
Berechnung der Stoffmenge an Oxonium-Ionen
Schritt 1: Berechnung der Stoffmengen anhand der pH-Werte
Es gilt:
 und
und  Damit ergibt sich:
Schritt 2: Berechnung der Stoffmengendifferenz
Es sind ungefähr
Damit ergibt sich:
Schritt 2: Berechnung der Stoffmengendifferenz
Es sind ungefähr  Oxonium-Ionen entstanden.
Berechnung der Stoffmengenkonzentration reiner Kaffeesäure
Mit der Näherung
Oxonium-Ionen entstanden.
Berechnung der Stoffmengenkonzentration reiner Kaffeesäure
Mit der Näherung  schwache Säure gilt:
Die Stoffmengenkonzentration reiner Kaffeesäure mit
schwache Säure gilt:
Die Stoffmengenkonzentration reiner Kaffeesäure mit  beträgt ca.
beträgt ca. 