Vorschlag C – Salpetersäure und Stickstoffwasserstoffsäure
Zu Beginn des 20. Jahrhunderts entwickelten die norwegischen Wissenschaftler Birkeland und Eyden ein Verfahren zur Herstellung von Salpetersäure. Dieses Verfahren wurde wegen des hohen Energiebedarfs später durch andere Verfahren abgelöst.
Salpetersäure wird bei verschiedenen Herstellungsprozessen als Edukt eingesetzt. Reagiert sie mit Hydrazin, so bilden sich unter anderem Stickstoffwasserstoffsäure und Distickstoffmonooxid. Die Salze der Stickstoffwasserstoffsäure nennt man Azide. Im Labor können diese Salze als Edukte eingesetzt werden. Natriumazid reagiert durch Wärme oder einen elektrischen Impuls schlagartig. Da dabei auch Stickstoff-Gas entsteht, wurde Natriumazid unter anderem in Auto-Airbags verwendet.
Bei der Reaktion von Salpetersäure mit Alkoholen (Alkanolen) bilden sich sogenannte Salpetersäure-Ester, zu denen auch Pentaerythrittrinitrat gehört. mit dem in der Luft enthaltenen Sauerstoff zu Stickstoffmonooxid umgesetzt.
Schritt 2: Beim Abkühlen reagiert Stickstoffmonooxid mit Luftsauerstoff weiter zu Stickstoffdioxid.
Schritt 3: Stickstoffdioxid wird in Wasser eingeleitet und reagiert zu einem Gemisch aus Salpetersäure
mit dem in der Luft enthaltenen Sauerstoff zu Stickstoffmonooxid umgesetzt.
Schritt 2: Beim Abkühlen reagiert Stickstoffmonooxid mit Luftsauerstoff weiter zu Stickstoffdioxid.
Schritt 3: Stickstoffdioxid wird in Wasser eingeleitet und reagiert zu einem Gemisch aus Salpetersäure  und Salpetriger Säure
und Salpetriger Säure  Schritt 4: Salpetrige Säure zerfällt ohne weitere Reaktionspartner in Wasser, Salpetersäure und Stickstoffmonooxid.
Schritt 4: Salpetrige Säure zerfällt ohne weitere Reaktionspartner in Wasser, Salpetersäure und Stickstoffmonooxid.
 und Distickstoffmonooxid
und Distickstoffmonooxid  sind jeweils beide Stickstoff-Atome aneinander gebunden.
An Stickstoff-Atomen kann – ebenso wie an Sauerstoff-Atomen – sowohl eine positive als auch eine negative Formalladung vorliegen. Bei Hydrazin sind jeweils zwei Wasserstoff-Atome an ein Stickstoff-Atom gebunden. Keine der Strukturen ist ringförmig.
sind jeweils beide Stickstoff-Atome aneinander gebunden.
An Stickstoff-Atomen kann – ebenso wie an Sauerstoff-Atomen – sowohl eine positive als auch eine negative Formalladung vorliegen. Bei Hydrazin sind jeweils zwei Wasserstoff-Atome an ein Stickstoff-Atom gebunden. Keine der Strukturen ist ringförmig.
Bei der Reaktion von Salpetersäure mit Alkoholen (Alkanolen) bilden sich sogenannte Salpetersäure-Ester, zu denen auch Pentaerythrittrinitrat gehört.
3.1
Formuliere für die vier Schritte zur Herstellung von Salpetersäure (Material 1) jeweils die Reaktionsgleichung.
Berechne für den zweiten Schritt des Birkeland-Eyden-Verfahrens mithilfe von Material 2, bezogen auf die zuvor formulierte Reaktionsgleichung, die molare Standardreaktionsenthalpie  Ordne der Salpetersäure
Ordne der Salpetersäure  und der Salpetrigen Säure
und der Salpetrigen Säure  jeweils begründet einen der in Material 3 genannten
jeweils begründet einen der in Material 3 genannten  -Werte zu.
-Werte zu.
(11 BE)
3.2
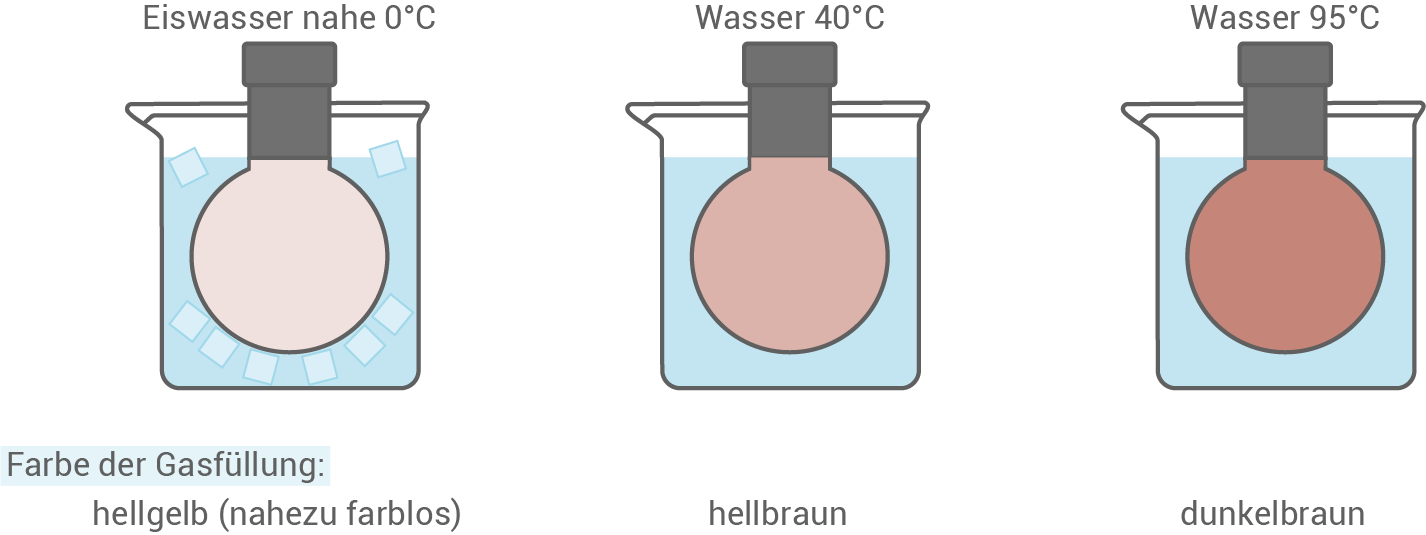
Distickstofftetraoxid (farbloses Gas) und Stickstoffdioxid (braunes Gas) wandeln sich in einer Gleichgewichtsreaktion ineinander um.
Formuliere ausgehend von Distickstofftetraoxid die Reaktionsgleichung für die oben genannte Gleichgewichtsreaktion sowie das zugehörige Massenwirkungsgesetz.
Erkläre, wie sich eine Druckerhöhung auf die Lage des Gleichgewichts auswirkt.
Erkläre anhand von Material 4, ob die Bildung von Distickstofftetraoxid oder die Bildung von Stickstoffdioxid endotherm verläuft.
(9 BE)
3.3
Formuliere mithilfe der Angaben in Material 5 für die an der Reaktion beteiligten Stoffe Hydrazin  und Distickstoffmonooxid
und Distickstoffmonooxid  jeweils die Strukturformel.
Leite jeweils mithilfe der entsprechenden Strukturformel für Hydrazin und Distickstoffmonooxid für jedes einzelne Stickstoff-Atom die Oxidationszahl her.
Gib für die Stickstoff-Atome folgender an der Reaktion (Material 5) beteiligter Teilchen jeweils die Oxidationszahl an:
jeweils die Strukturformel.
Leite jeweils mithilfe der entsprechenden Strukturformel für Hydrazin und Distickstoffmonooxid für jedes einzelne Stickstoff-Atom die Oxidationszahl her.
Gib für die Stickstoff-Atome folgender an der Reaktion (Material 5) beteiligter Teilchen jeweils die Oxidationszahl an: 

 und
und  Formuliere für Distickstoffmonooxid eine weitere mesomere Grenzstruktur.
Formuliere für Distickstoffmonooxid eine weitere mesomere Grenzstruktur.
(10 BE)
3.4
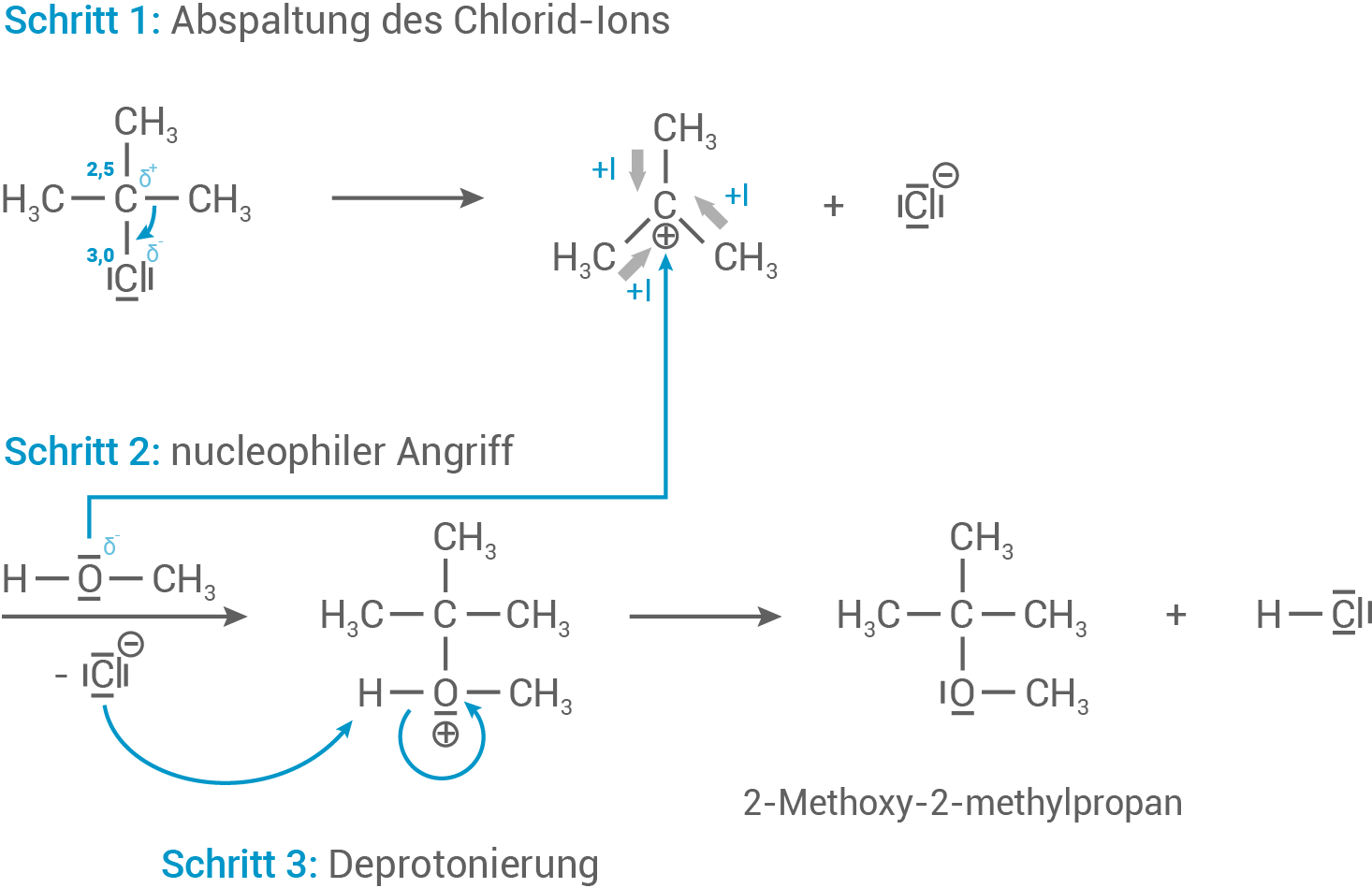
2-Chlor-2-methylpropan reagiert in einer Substitutionsreaktion  mit Methanol, wobei ein organisches Produkt entsteht, in dessen Struktur zwei der Kohlenstoff-Atome über ein Sauerstoff-Atom miteinander verbunden sind. Außerdem entstehen Ionen.
mit Methanol, wobei ein organisches Produkt entsteht, in dessen Struktur zwei der Kohlenstoff-Atome über ein Sauerstoff-Atom miteinander verbunden sind. Außerdem entstehen Ionen.
Auch Azid-Ionen -Ionen
-Ionen können in einer Substitutionsreaktion mit 2-Chlor-2-methylpropan reagieren.
Entwickle den Reaktionsmechanismus für die Umsetzung von 2-Chlor-2-methylpropan mit Methanol.
Formuliere die Reaktionsgleichung für die Reaktion von Azid-Ionen mit 2-Chlor-2-methylpropan unter Verwendung von Summen- bzw. Halbstrukturformeln für die entsprechenden Teilchen.
können in einer Substitutionsreaktion mit 2-Chlor-2-methylpropan reagieren.
Entwickle den Reaktionsmechanismus für die Umsetzung von 2-Chlor-2-methylpropan mit Methanol.
Formuliere die Reaktionsgleichung für die Reaktion von Azid-Ionen mit 2-Chlor-2-methylpropan unter Verwendung von Summen- bzw. Halbstrukturformeln für die entsprechenden Teilchen.
Auch Azid-Ionen
(8 BE)
3.5
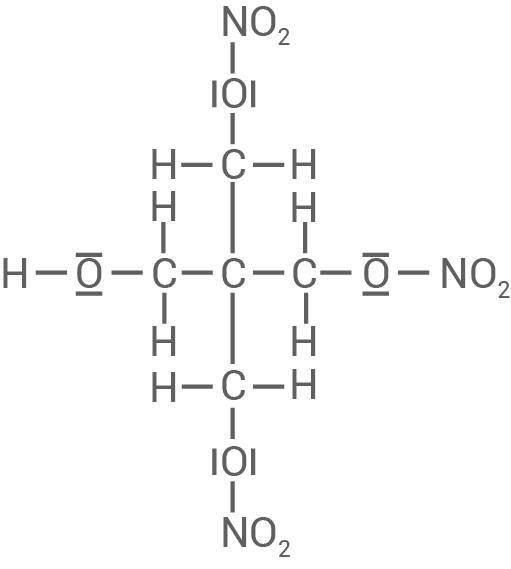
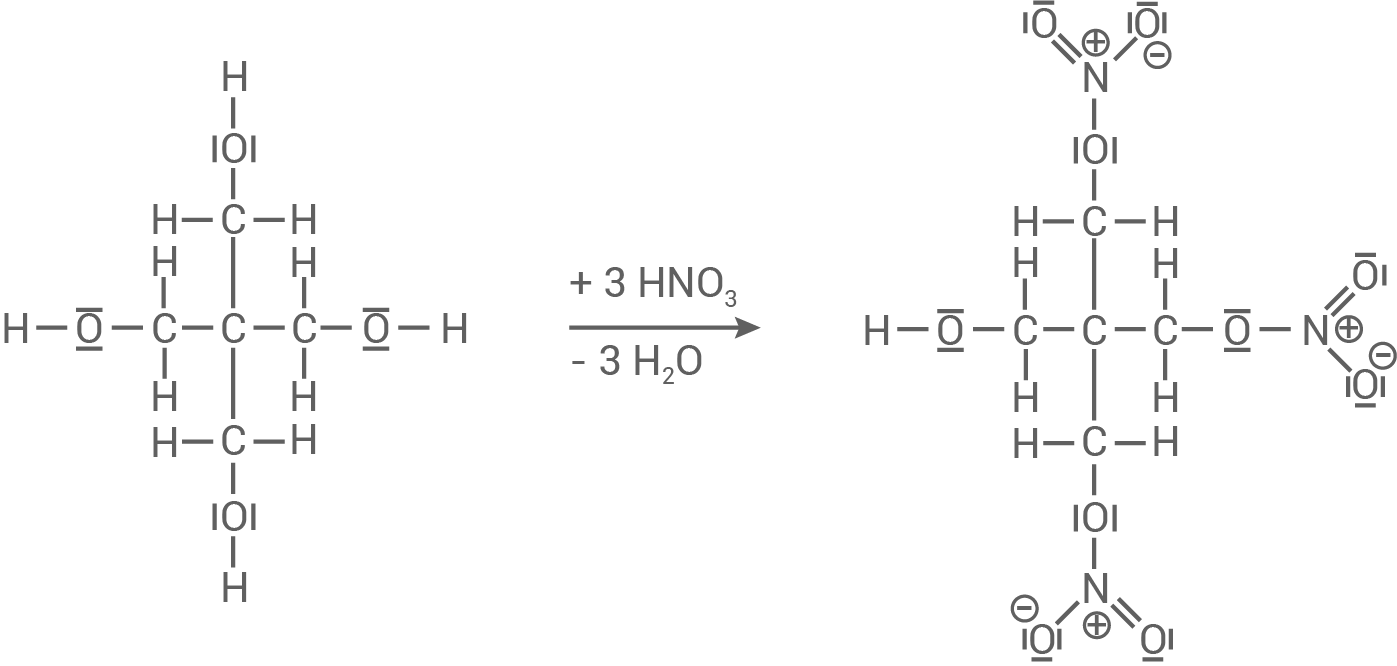
Formuliere für die Reaktion von Salpetersäure mit dem entsprechenden mehrwertigen Alkohol (die Molekülstruktur dieses Alkohols beinhaltet mehrere Hydroxy-Gruppen) zum Reaktionsprodukt Pentaerythrittrinitrat (Material 6) die Reaktionsgleichung unter Verwendung von Strukturformeln mit allen bindenden und nicht bindenden Elektronenpaaren für die organischen Moleküle.
Benenne alle zwischenmolekularen Wechselwirkungen, die zwischen den Molekülen des Pentaerythrittrinitrats vorliegen, und beschreibe, durch welche funktionelle Gruppe die stärkste dieser Wechselwirkungen zustande kommt.
Hinweis
In der Strukturformel der Nitro-Gruppe liegt an einzelnen Atomen eine Formalladung vor.
In der Strukturformel der Nitro-Gruppe liegt an einzelnen Atomen eine Formalladung vor.
(6 BE)
3.6
Festes Natriumazid  reagiert bei Standardbedingungen vollständig zu elementarem Natrium und gasförmigem Stickstoff.
Formuliere die Reaktionsgleichung für diese Umsetzung.
Berechne das Volumen an Stickstoff, das entsteht, wenn bei Standardbedingungen
reagiert bei Standardbedingungen vollständig zu elementarem Natrium und gasförmigem Stickstoff.
Formuliere die Reaktionsgleichung für diese Umsetzung.
Berechne das Volumen an Stickstoff, das entsteht, wenn bei Standardbedingungen  Natriumazid vollständig zu Natrium und Stickstoff reagieren.
Hinweis
Natriumazid vollständig zu Natrium und Stickstoff reagieren.
Hinweis
Bei Standardbedingungen beträgt das molare Volumen für Gase
Bei Standardbedingungen beträgt das molare Volumen für Gase
(6 BE)
(50 BE)
Material 1
Verfahren zur Herstellung von Salpetersäure
Schritt 1: Beim Birkeland-Eyden-Verfahren wird der in der Luft enthaltene Stickstoff bei Temperaturen von bis zuMaterial 2
Molare Standardbildungsenthalpien
| Name des Stoffes | molare Standardbildungs- enthalpie |
|---|---|
| Stickstoffdioxid |
|
| Stickstoffmonoxid |
Material 3
 -Werte von Salpetersäure und Salpetriger Säure
-Werte von Salpetersäure und Salpetriger Säure
Material 4
Gleichgewichtsreaktion zwischen Distickstofftetraoxid und Stickstoffdioxid

Material 5
Reaktionsgleichung für die Umsetzung von Salpetersäure mit Hydrazin
In den Stoffen HydrazinMaterial 6
Formel von Pentaerythrittrinitrat

Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
3.1
Reaktionsgleichungen für die Herstellung von Salpetersäure nach BIRKELAND und EYDEN
Berechnung der molaren Standardreaktionsenthalpie für den 2. Schritt
Für die molare Standardreaktionsenthalpie gilt:
![\(\begin{array}[t]{rll}
\Delta_RH^0 &=& \Delta_RH_m^0 \cdot n & \\[10pt]
\Delta_RH_m^0 &=& \dfrac{\Delta_RH^0 }{n} & \\[5pt]
&=& \dfrac{-114\,\text{kJ}}{1\,\text{mol} } & \\[5pt]
&=& -114 \,\text{kJ}\cdot \text{mol}^{-1}
\end{array}\)](https://www.schullv.de/resources/formulas/46d10f141bf3bc907a7124a5f714a64636fc47338d56eb80a2223adc398d6036_light.svg) Somit beträgt die molare Standardreaktionsenthalpie für den 2. Schritt des BIRKELAND-EYDEN-Verfahren
Somit beträgt die molare Standardreaktionsenthalpie für den 2. Schritt des BIRKELAND-EYDEN-Verfahren  Zuordnung der
Zuordnung der  -Werte
Allgemein gilt: je kleiner der
-Werte
Allgemein gilt: je kleiner der  -Wert einer Säure, desto saurer/acider die Säure.
-Wert einer Säure, desto saurer/acider die Säure.
 -Bindung die Deprotonierung und damit die Acidität.
-Bindung die Deprotonierung und damit die Acidität.
Schritt 1: 
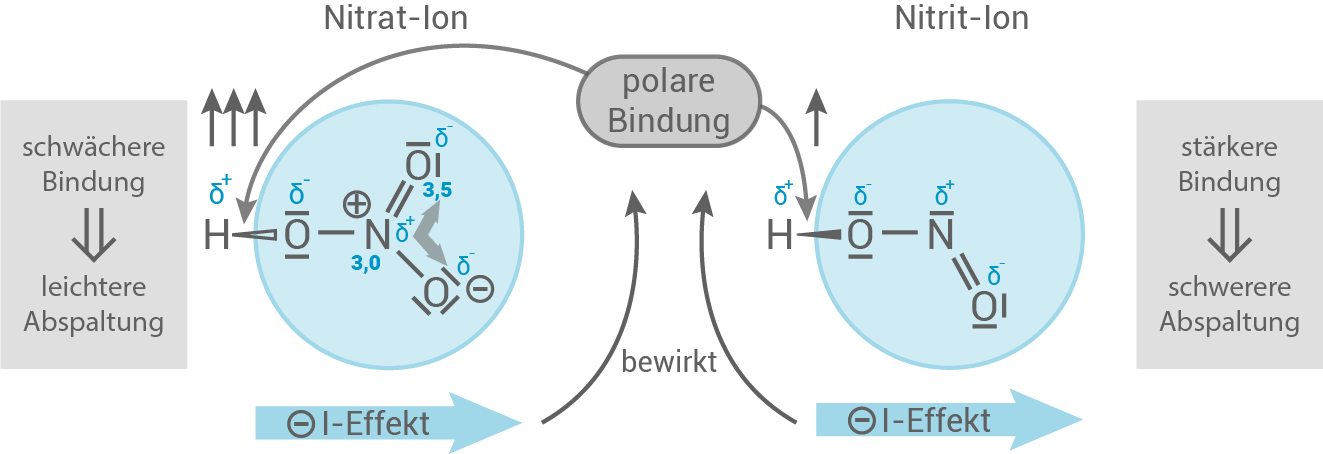
- Bei der Salpetersäure handelt es sich um die deutlich stärkere Säure. Ihr ist der
-Wert von
zuzuordnen. Bei der Deprotonierung entsteht ein sehr gut mesomeriestabilisiertes Säurerest-Ion. Das Nitrat-Ion der
besitzt mehr mesomere Grenzformeln als das Nitrit-Ion
der Salpetrigen Säure. Das Gleichgewicht liegt daher auf der Produktseite und die Protolyse der Salpetersäure läuft praktisch vollständig ab.
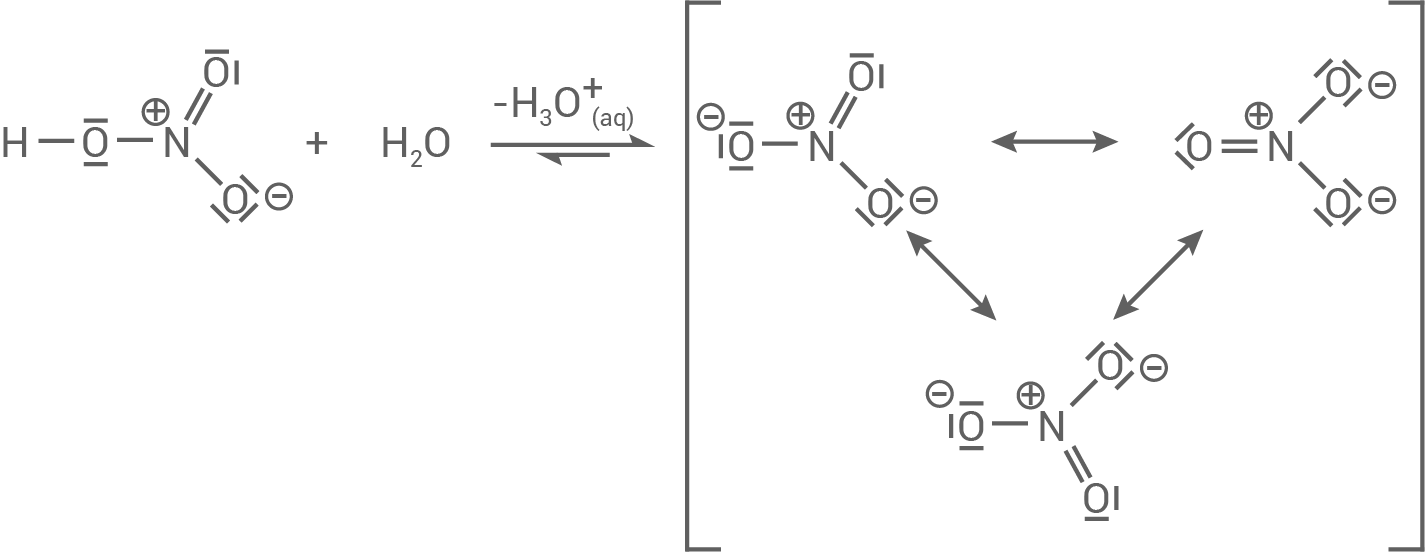
- Der Salpetrigen Säure ist der
-Wert von
zuzuordnen, da sie die schwächere Säure ist. Die Protolyse für die Salpetrige Säure läuft im Vergleich zu Salpetersäure weniger gut ab, da das Nitrit-Ion weniger mesomeriestabilisert ist.
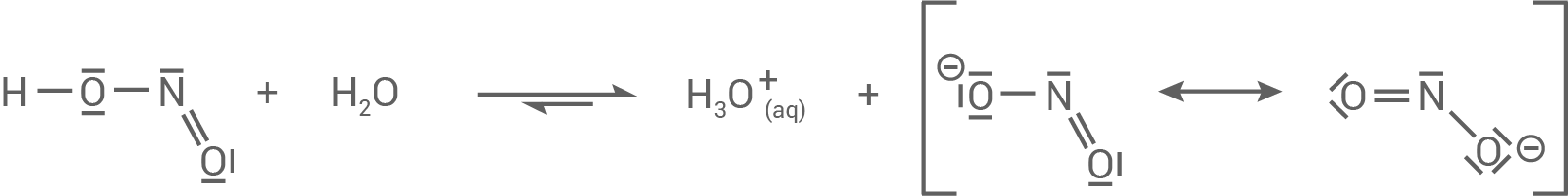
- Die Elektronegativitätsdifferenz von Sauerstoff
und Wasserstoff
führt zu einer negativen Partialladung beim Sauerstoff und einer positiven beim Wasserstoff. Die Elektronen werden vom Sauerstoff stärker angezogen, somit ist das Wasserstoff-Atom in beiden Molekülen nicht sehr stark gebunden und in beiden Fällen ist eine Protolyse möglich.
- Das abzuspaltende Wasserstoff-Atom der Salpetersäure ist an drei
-Atome und ein
-Atom gebunden. Diese wirken "elektronenziehend" und üben den sogenannten
-Effekt aus.
- Bei der Salpetersäure ist diese
-Bindung geschwächter als bei der Salpetrigen Säure und das Wasserstoff-Atom kann deutlich leichter abgespalten werden.
- Daraus ergibt sich eine höhere Acidität und folglich der
-Wert von

3.2
Formulierung der Reaktionsgleichung
 Formulierung des zugehörigen Massenwirkungsgesetzes
Formulierung des zugehörigen Massenwirkungsgesetzes
 Auswirkung einer Druckerhöhung auf das Gleichgewicht
Auswirkung einer Druckerhöhung auf das Gleichgewicht

- Nach dem Prinzip des kleinsten Zwangs von LE CHATELIER und BRAUN weicht ein System bei einer Druckerhöhung auf die Seite mit den wenigeren Gasteilchen aus.
- Die Reaktionsgleichung zeigt auf der Eduktseite 1 Gasteilchen und auf der Produktseite 2.
- Folglich verschiebt sich das Gleichgewicht auf die Seite der Edukte.
- Wird der Druck erhöht, läuft die Rückreaktion also verstärkt ab, um diesen von außen einwirkenden Zwang zu vermindern.
- Das Gleichgewicht stellt sich neu ein.
- Dem Material 4 lässt sich entnehmen, dass die zu Beginn im Eiswasser vorliegende Gasmischung hellgelb/farblos ist. Mit steigender Temperatur wird die Farbe intensiver und ist zuletzt dunkelbraun.
- Da Stickstoffdioxid braun ist, lässt sich schließen, dass sich dieses bei einer Temperaturerhöhung bildet.
- Nach dem Prinzip von LE CHATELIER und BRAUN wird bei einer Temperaturerhöhung die endotherme Reaktion begünstigt.
- Folglich ist die Hinreaktion endotherm und die Rückreaktion exotherm.
3.3
Formulierung der Strukturformeln mit den Oxidationszahlen
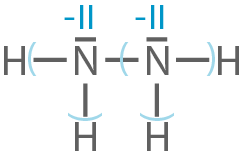
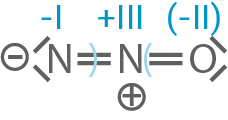 Oxidationszahlen der anderen beteiligten Teilchen
Oxidationszahlen der anderen beteiligten Teilchen
 Weitere mesomere Grenzstruktur für Distickstoffmonooxid
Weitere mesomere Grenzstruktur für Distickstoffmonooxid
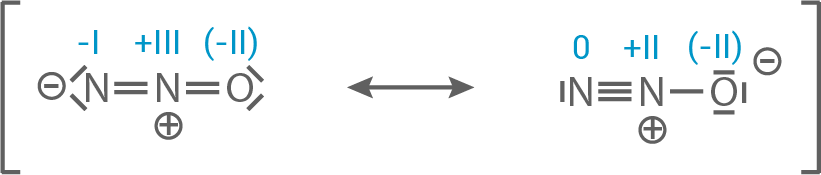

Hydrazin
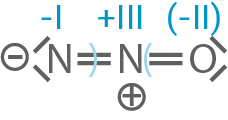
Distickstoffmonooxid


3.4
Reaktionsmechanismus für die nucleophile Substitution von 2-Chlor-2-methylpropan und Methanol
 Reaktionsgleichung für die Reaktion von Azid-Ionen mit 2-Chlor-2-methylpropan
Reaktionsgleichung für die Reaktion von Azid-Ionen mit 2-Chlor-2-methylpropan



3.5
Reaktionsgleichung mit allen bindenden und nicht bindenden Elektronenpaaren
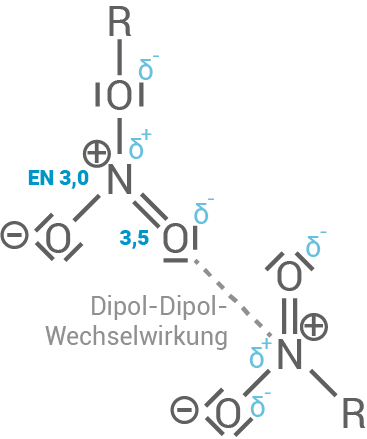
 Benennung und Beschreibung der zwischenmolekularen Wechselwirkungen
Benennung und Beschreibung der zwischenmolekularen Wechselwirkungen

Reaktion von Salpetersäure mit dem mehrwertigen Alkohol zu Pentaerythrittrinitrat
- Zwischen den Pentaerythrittrinitrat-Molekülen wirken intermolekulare Wechselwirkungen, also zwischenmolekulare Kräfte von benachbarten Molekülen.
- Durch die unpolaren Alkylteile werden VAN-DER-WAALS-Kräfte ausgebildet.
- Weiterhin bilden sich durch die Nitrat-Reste starke Wasserstoffbrücken, was auf die Nitrat-Reste zurückzuführen ist. Grund hierfür sind starke Dipol-Dipol-Wechselwirkungen zwischen den negativ polarisierten
-Atomen und den positiv polarisierten
-Atomen.
- Die stärksten intermolekularen Kräfte sind die Wasserstoffbrückenbindungen. Diese treten zwischen den stark polarisierten Hydroxy-Gruppen der Pentaerythrittrinitrat-Moleküle auf.
3.6
Reaktionsgleichung für die Umsetzung von festem Natriumazid


 Festes Natriumazid
Festes Natriumazid  reagiert bei Standardbedingungen vollständig zu elementarem Natrium und gasförmigem Stickstoff.
Berechnung des Stickstoffvolumens
Die Reaktionsgleichung zeigt das Verhältnis der Teilchen zueinander, weswegen gilt:
reagiert bei Standardbedingungen vollständig zu elementarem Natrium und gasförmigem Stickstoff.
Berechnung des Stickstoffvolumens
Die Reaktionsgleichung zeigt das Verhältnis der Teilchen zueinander, weswegen gilt:
 mit
mit ![\(n \,\text{[mol]} = \dfrac{n \,\text{[g]}}{M \,\text{[g}\cdot \text{mol}^{-1} \text{]}}\)](https://www.schullv.de/resources/formulas/42acf5eca3600adc39100f9940ff915cbf3c0ef77ad827132c33b4018814090d_light.svg) Daraus folgt:
Daraus folgt:
![\(\begin{array}[t]{rll}
n (NaN_3) &=&\dfrac{225\,\text{g}}{65 \,\text{g} \cdot \text{mol}^{-1}} &\ \\[5pt]
&\approx& 3,46 \,\text{mol} \\[15pt]
n (N_2) &=& n (NaN_3) \cdot \dfrac{3}{2} & \\[5pt]
&\approx& 5,19 \,\text{mol} & \\[15pt]
V (N_2) &=& 24 \,\text{L} \cdot \text{mol}^{-1} \cdot 5,19 \,\text{mol} & \\[5pt]
&\approx& 124,56 \,\text{L}
\end{array}\)](https://www.schullv.de/resources/formulas/a772e5216aeae5e5a0c9d4866e7b22af68976e6de797ad3bc7527244fc967ec2_light.svg) Bei Standardbedingungen entwickeln sich also aus den
Bei Standardbedingungen entwickeln sich also aus den  ungefähr
ungefähr  Stickstoff.
Stickstoff.