Vorschlag C – Muconsäure
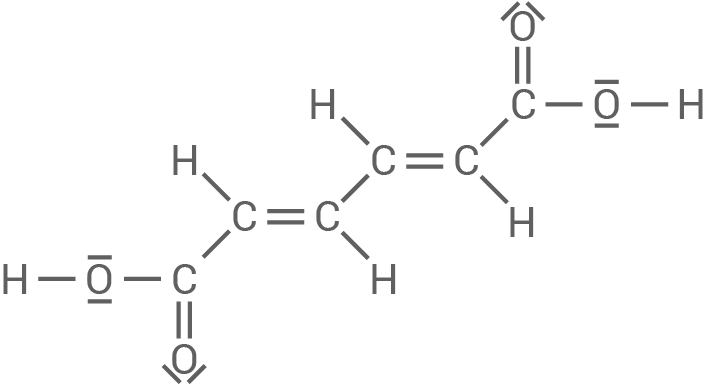
Muconsäure (Material 1) ist eine ungesättigte Dicarbonsäure, die zwei Doppelbindungen im Molekül aufweist und von der drei Stereoisomere existieren. Ihre Synthese erfolgt in mehreren Reaktionsschritten aus der entsprechenden gesättigten Dicarbonsäure (Material 2).
Aufgrund ihres Molekülbaus ist Muconsäure ein wertvoller Ausgangsstoff für Kunststoffsynthesen, da sie sowohl zu Polymeren verarbeitet als auch als Ausgangsstoff zur Synthese weiterer Stoffe verwendet werden kann.
Ein Stereoisomer der Muconsäure ist ein Stoffwechselprodukt des Benzols (Benzens) und wird bei Menschen über den Urin ausgeschieden. Bei arbeitsmedizinischen Untersuchungen wird daher bei Personen, die möglicherweise Benzol (Benzen) ausgesetzt waren, der Muconsäuregehalt im Urin bestimmt.
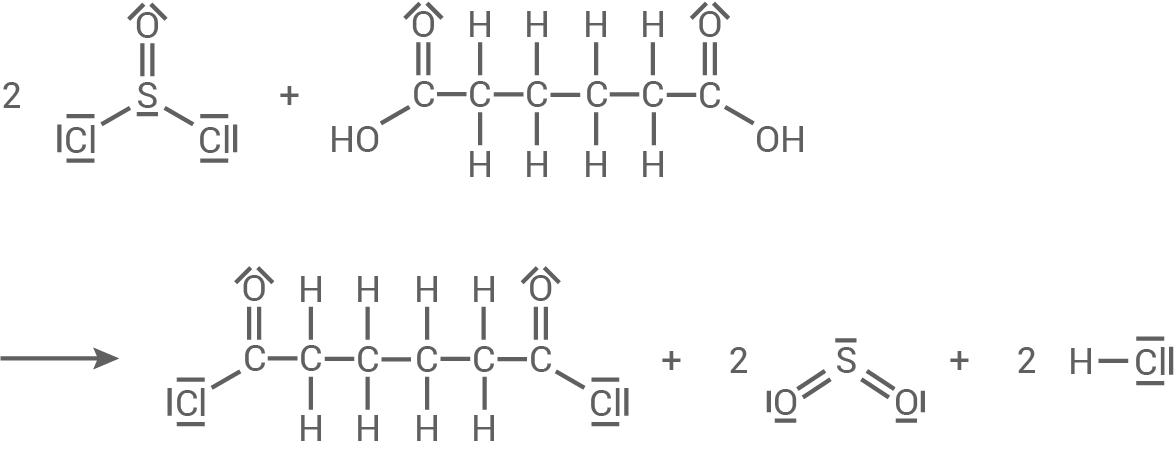
Adipinsäure (Hexan-1,6-disäure) reagiert mit Thionylchlorid zu Adipinsäuredichlorid, Schwefeldioxid und einem weiteren Stoff, der eine Rotfärbung auf einem angefeuchteten Universalindikator-Papier hervorruft.
Schritt 2:
Adipinsäuredichlorid reagiert mit elementarem Brom zu 2,5-Dibromadipinsäuredichlorid. Schritt 3:
 Für die Reaktion von 2,5-Dibromadipinsäuredichlorid mit Ethanol zu 2,5-Dibromadipinsäurediethylester lässt sich der Reaktionsmechanismus vereinfacht beispielsweise folgendermaßen beschreiben:
Das Ethanol-Molekül greift nucleophil am Carbonyl-Kohlenstoff-Atom des 2,5-Dibromadipinsäuredichlorids an. Dabei entsteht ein tetraedrisches Zwitterion. Deprotonierung und Abspaltung eines Chlorid-Ions führen zur Entstehung des 2,5-Dibromadipinsäurediethylesters.
Schritt 4:
Für die Reaktion von 2,5-Dibromadipinsäuredichlorid mit Ethanol zu 2,5-Dibromadipinsäurediethylester lässt sich der Reaktionsmechanismus vereinfacht beispielsweise folgendermaßen beschreiben:
Das Ethanol-Molekül greift nucleophil am Carbonyl-Kohlenstoff-Atom des 2,5-Dibromadipinsäuredichlorids an. Dabei entsteht ein tetraedrisches Zwitterion. Deprotonierung und Abspaltung eines Chlorid-Ions führen zur Entstehung des 2,5-Dibromadipinsäurediethylesters.
Schritt 4:
2,5-Dibromadipinsäurediethylester wird in zwei Reaktionsschritten zu trans-trans-Muconsäure umgesetzt.
Aufgrund ihres Molekülbaus ist Muconsäure ein wertvoller Ausgangsstoff für Kunststoffsynthesen, da sie sowohl zu Polymeren verarbeitet als auch als Ausgangsstoff zur Synthese weiterer Stoffe verwendet werden kann.
Ein Stereoisomer der Muconsäure ist ein Stoffwechselprodukt des Benzols (Benzens) und wird bei Menschen über den Urin ausgeschieden. Bei arbeitsmedizinischen Untersuchungen wird daher bei Personen, die möglicherweise Benzol (Benzen) ausgesetzt waren, der Muconsäuregehalt im Urin bestimmt.
3.1
Von Muconsäure existieren je nach Anordnung an den Kohlenstoff-Kohlenstoff-Doppelbindungen mehrere Stereoisomere. Material 1 zeigt die Strukturformel der trans-trans-Muconsäure.
Zeichne jeweils die Strukturformel der trans-cis-Muconsäure und der cis-cis-Muconsäure und entscheide unter Angabe einer Begründung, ob es eine cis-trans-Muconsäure gibt.
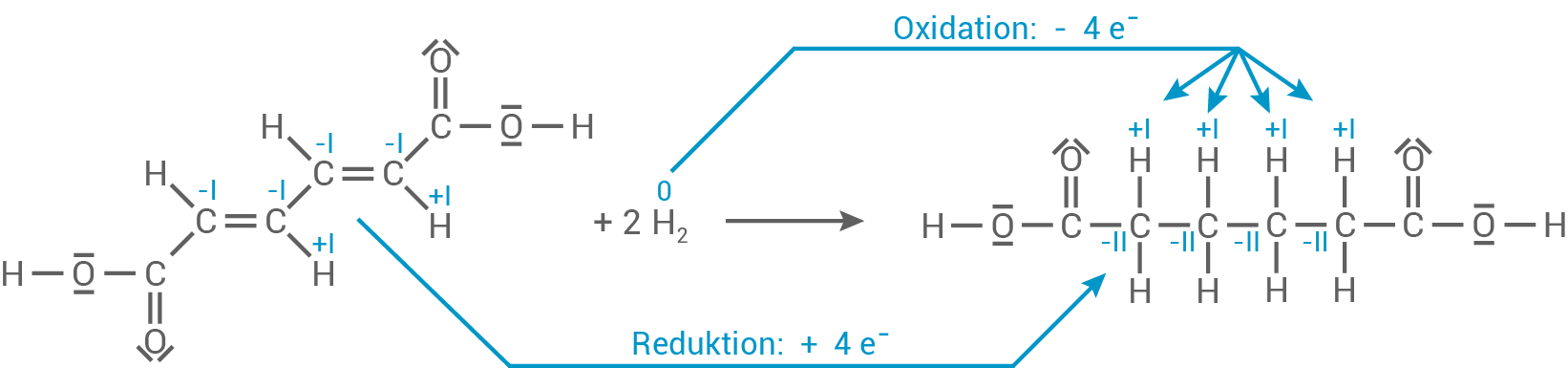
Formuliere die Reaktionsgleichung für die Reaktion von Muconsäure mit elementarem Wasserstoff zu Adipinsäure (Hexan-1,6-disäure) und zeige anhand der wesentlichen Oxidationszahlen und der Elektronenübergänge, dass es sich um eine Redoxreaktion handelt.
(11 BE)
3.2
Gib für jedes Kohlenstoff-Atom der Muconsäure die Hybridisierung an und beschreibe die Bindungsverhältnisse in einer der Carboxy-Gruppen sowie des direkt daran gebundenen Kohlenstoff-Atoms auf der Grundlage des Orbitalmodells.
(7 BE)
3.3
Material 2 beschreibt eine Herstellungsvariante für trans-trans-Muconsäure aus Adipinsäure (Hexan-1,6-disäure).
Formuliere für Schritt 1 die Reaktionsgleichung unter Verwendung von Strukturformeln für die organischen Verbindungen.
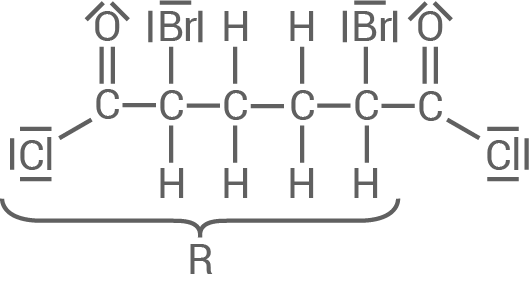
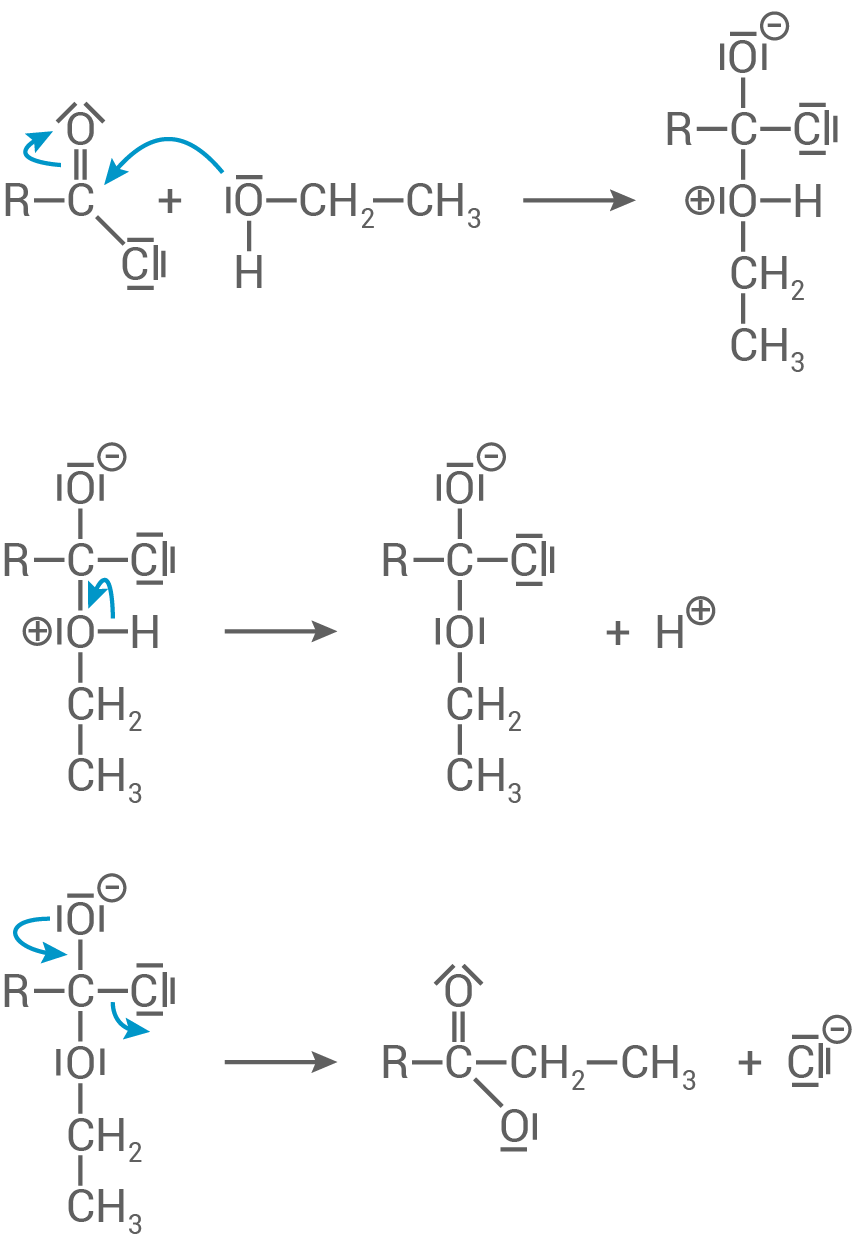
Entwickle für Schritt 3 mithilfe des Materials 2 den Reaktionsmechanismus exemplarisch an einer Säurechlorid-Gruppe.
Hinweis
Der nicht relevante Molekülteil kann wie im Material 2 vorgegeben mit abgekürzt werden.
Beschreibe auch unter Angabe einer Reaktionsgleichung eine Nachweisreaktion für die in Schritt 3 entstandenen Chlorid-Ionen.
Benenne für die erforderlichen Reaktionsschritte zur Bildung von trans-trans-Muconsäure aus 2,5-Dibromadipinsäurediethylester im Schritt 4 jeweils den Reaktionstyp.
abgekürzt werden.
Beschreibe auch unter Angabe einer Reaktionsgleichung eine Nachweisreaktion für die in Schritt 3 entstandenen Chlorid-Ionen.
Benenne für die erforderlichen Reaktionsschritte zur Bildung von trans-trans-Muconsäure aus 2,5-Dibromadipinsäurediethylester im Schritt 4 jeweils den Reaktionstyp.
Hinweis
Der nicht relevante Molekülteil kann wie im Material 2 vorgegeben mit
(12 BE)
3.4
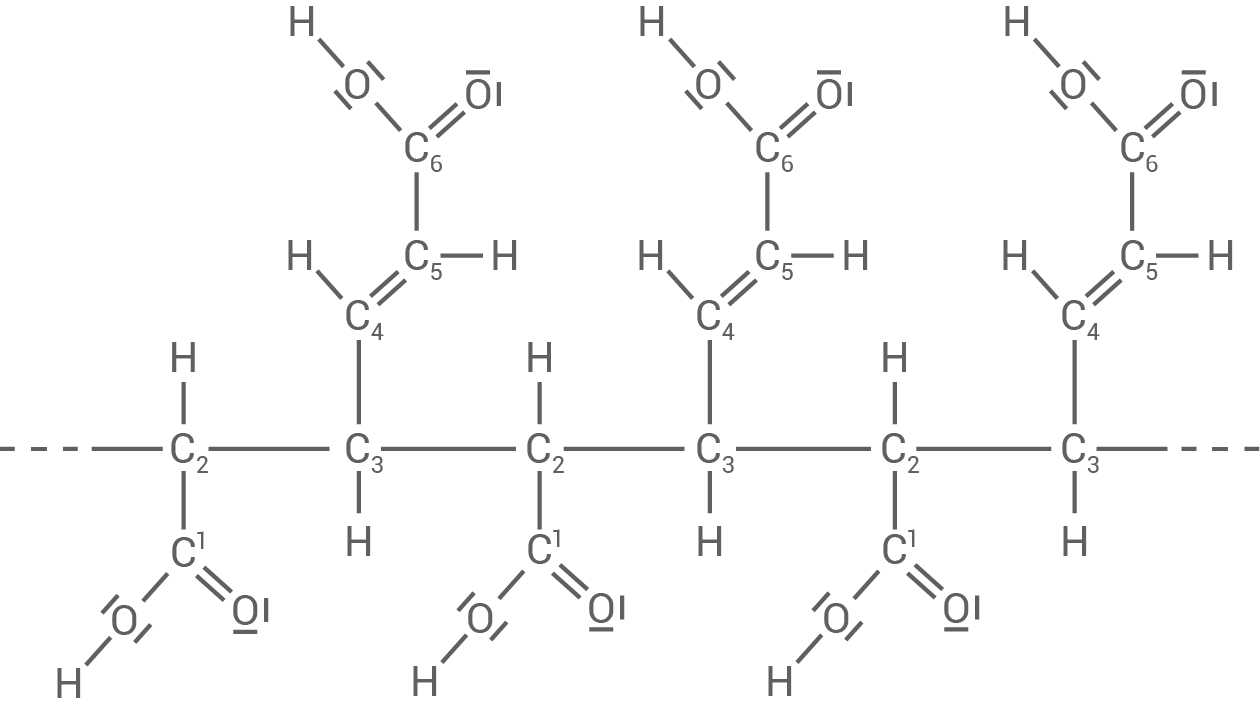
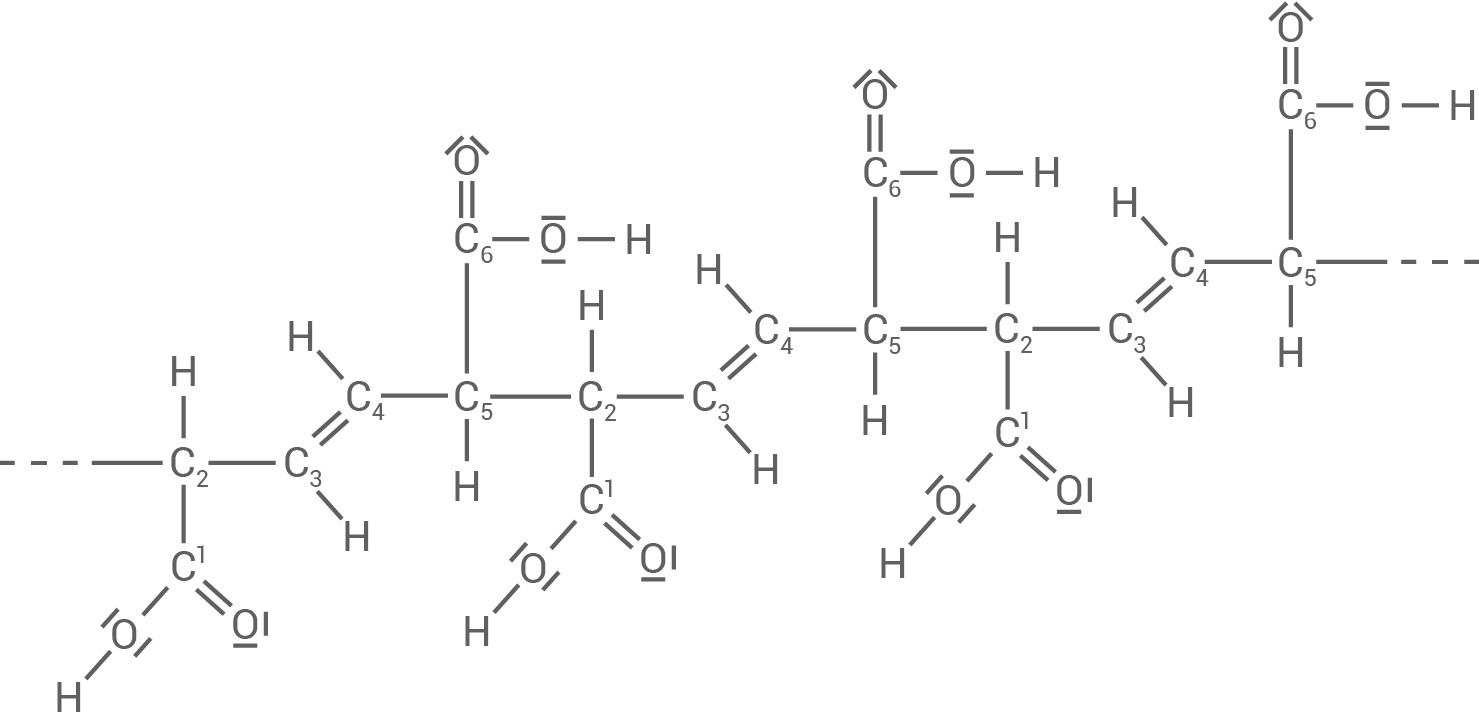
Die Polymerisation von trans-trans-Muconsäure kann zu unterschiedlichen Polymeren führen (Material 3).
Formuliere für die Synthese von Polymer A den Reaktionsmechanismus.
Hinweis
Verwende als Radikalstarter ein Peroxid beschränke dich auf eine Verknüpfung von zwei Monomeren in vollständiger Strukturformeldarstellung und verzichte auf die Darstellung der Abbruchreaktionen.
Entwickle eine mesomere Grenzformel für das erste beim Mechanismus auftretende trans-trans-Muconsäure-Radikal und erkläre das Entstehen von Polymer B.
beschränke dich auf eine Verknüpfung von zwei Monomeren in vollständiger Strukturformeldarstellung und verzichte auf die Darstellung der Abbruchreaktionen.
Entwickle eine mesomere Grenzformel für das erste beim Mechanismus auftretende trans-trans-Muconsäure-Radikal und erkläre das Entstehen von Polymer B.
Hinweis
Verwende als Radikalstarter ein Peroxid
(9 BE)
3.5
Beschreibe und begründe das Verhalten von Polymer A (Material 3) beim Erwärmen und ordne dieses Polymer diesbezüglich einer Klasse von Kunststoffen zu.
Erläutere den Sachverhalt, dass die Umsetzung von Polymer B mit Styrol (Material 4) zu einem weiteren Kunststoff mit veränderten Eigenschaften beim Erwärmen führt.
(6 BE)
3.6
In einem Raum mit einem Volumen von  lag eine erhöhte Belastung an Benzol (Benzen) von
lag eine erhöhte Belastung an Benzol (Benzen) von  Raumluft vor. Die Dichte von reinem, flüssigem Benzol (Benzen) beträgt
Raumluft vor. Die Dichte von reinem, flüssigem Benzol (Benzen) beträgt  Von einem Mitarbeiter, der sich längere Zeit in dem Raum aufhielt, wird eine Urinprobe mit dem Volumen
Von einem Mitarbeiter, der sich längere Zeit in dem Raum aufhielt, wird eine Urinprobe mit dem Volumen  untersucht. Die Urinprobe enthielt eine trans-trans-Muconsäure-Konzentration von
untersucht. Die Urinprobe enthielt eine trans-trans-Muconsäure-Konzentration von  Berechne das Volumen der Stoffportion an reinem, flüssigem Benzol, die sich im betroffenen
Berechne das Volumen der Stoffportion an reinem, flüssigem Benzol, die sich im betroffenen  großen Raum ausgebreitet hatte.
Berechne die Masse an trans-trans-Muconsäure, die sich in der untersuchten Urinprobe befand.
großen Raum ausgebreitet hatte.
Berechne die Masse an trans-trans-Muconsäure, die sich in der untersuchten Urinprobe befand.
(5 BE)
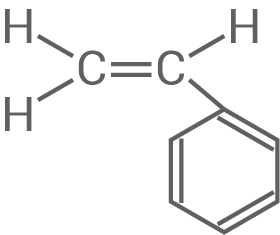
Material 1
trans-trans-Muconsäure

Material 2
Herstellung von trans-trans-Muconsäure durch Dehydrohalogenierung
Die Herstellung verläuft in vier Schritten: Schritt 1:Adipinsäure (Hexan-1,6-disäure) reagiert mit Thionylchlorid zu Adipinsäuredichlorid, Schwefeldioxid und einem weiteren Stoff, der eine Rotfärbung auf einem angefeuchteten Universalindikator-Papier hervorruft.
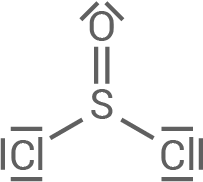
Thionylchlorid
|
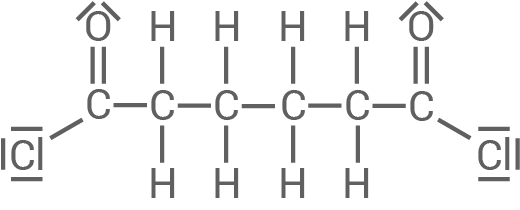
Adipinsäuredichlorid
|
Adipinsäuredichlorid reagiert mit elementarem Brom zu 2,5-Dibromadipinsäuredichlorid. Schritt 3:

2,5-Dibromadipinsäuredichlorid
2,5-Dibromadipinsäurediethylester wird in zwei Reaktionsschritten zu trans-trans-Muconsäure umgesetzt.
Material 3
Polymere der trans-trans-Muconsäure

POLYMER A

POLYMER B
Material 4
Styrol

Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
3.1
Strukturformeln
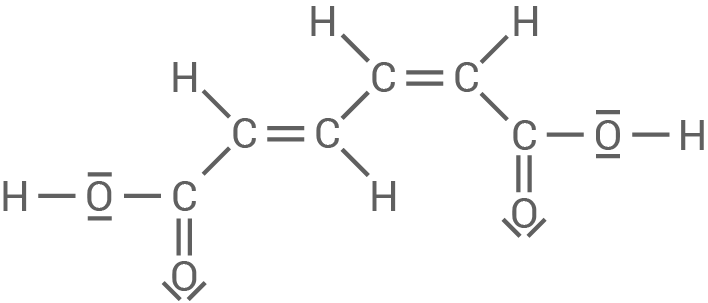
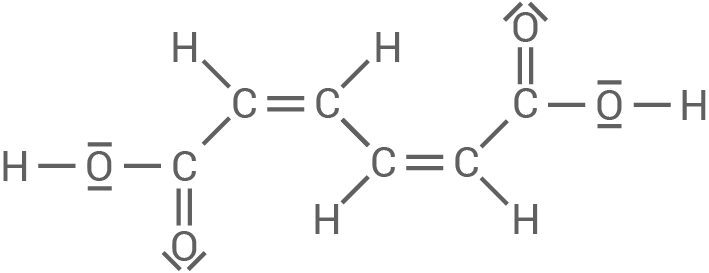 Es gibt eine cis-trans-Muconsäure, jedoch ist deren Struktur identisch zur trans-cis-Muconsäure.
Reaktionsgleichung für die Reaktion von Muconsäure mit elementarem Wasserstoff
Es gibt eine cis-trans-Muconsäure, jedoch ist deren Struktur identisch zur trans-cis-Muconsäure.
Reaktionsgleichung für die Reaktion von Muconsäure mit elementarem Wasserstoff

trans-cis-Muconsäure

cis-cis-Muconsäure

- Oxidation: Die vier Wasserstoffatome (zwei Wasserstoffmoleküle) geben insgesamt vier Elektronen ab und werden oxidiert
0+I
- Reduktion: Die Kohlenstoffatome
nehmen jeweils ein Elektron auf und werden reduziert
-I-II
3.2
Hybridisierung der Kohlenstoffatome
- Alle Kohlenstoffatome sind
-hybridisiert, da sich zwischen
nur Doppelbindungen bilden und das Sauerstoffatom in der Carboxylgruppe ebenfalls über eine Doppelbindung gebunden ist.
- In der Carboxylgruppe ist das Sauerstoffatom auch
-hybridisiert.
- Das andere Sauerstoffatom der Carboxygruppe (welches mit Wasserstoff verbunden ist) ist hingegen
-hybridisiert.
- Doppelbindungen bestehen aus
- und
-Bindungen.
-Bindung: Überlappung je eines der
-Hybridorbitale zweier
-Atome
-Bindung: Die beiden unhybridisierten p-Orbitale überlappen sich zusätzlich (mit gleicher Symmetrie und Raumrichtung ober- und unterhalb der Kern-Kern-Bindungsachse)
- Das
-Hybridorbitale des
-Atoms überlappt sich jeweils mit einem der
-Hybridorbitale des benachbarten
-Atoms, einem der
-Hybridorbitale des doppelt gebundenen
-Atoms und einem der
-Hybridorbitale des
-Atoms der Hydroxygruppe.
- Durch Überlappung des p-Orbitals des
-hybridisierten
-Atoms mit dem p-Orbitals des doppelt gebundenen
-Atoms oberhalb- bzw. unterhalb der Kern-Kern-Bindungsachse entsteht die
-Bindung.
- Durch Überlappung eines
-Hybridorbitals des entsprechenden Sauerstoffatoms mit dem s-Orbital eines Wasserstoffatoms entsteht eine weitere
-Bindung.
- Es bleiben zwei
-Hybridorbitale des
-Atoms übrig, die als Aufenthaltsort für die beiden freien Elektronenpaare (vom Sauerstoff) dienen.
- Die verbleibenden
-Hybridorbitale vom Kohlenstoff führen zu je einer weiteren
-Bindung zu den benachbarten
-Atomen.
3.3
Reaktionsgleichung für Schritt 1
 Reaktionsmechanismus für Schritt 3
Die Reaktion basiert auf einer nukleophilen Substitution:
Reaktionsmechanismus für Schritt 3
Die Reaktion basiert auf einer nukleophilen Substitution:
 Nachweisreaktion für die entstandenen Chlorid-Ionen
Ein üblicher Nachweis für Chlorid-Ionen in einer Lösung ist die Silbernitrat-Reaktion. Bei Zugabe von Silbernitrat
Nachweisreaktion für die entstandenen Chlorid-Ionen
Ein üblicher Nachweis für Chlorid-Ionen in einer Lösung ist die Silbernitrat-Reaktion. Bei Zugabe von Silbernitrat  zu einer Lösung, die Chlorid-Ionen enthält, entsteht ein weißer Niederschlag von Silberchlorid
zu einer Lösung, die Chlorid-Ionen enthält, entsteht ein weißer Niederschlag von Silberchlorid  da Silberchlorid in Wasser schwer löslich ist.
Die Reaktionsgleichung für die Nachweisreaktion lautet:
da Silberchlorid in Wasser schwer löslich ist.
Die Reaktionsgleichung für die Nachweisreaktion lautet:


 Benennung der Reaktionstypen in Schritt 4
Benennung der Reaktionstypen in Schritt 4

(Es findet keine Redoxreaktion statt, da die Oxidationszahlen gleich bleiben)

- 1. Reaktionsschritt: Hydrolyse (Verseifung) Im ersten Schritt erfolgt die Umwandlung von 2,5-Dibromadipinsäurediethylester durch Verseifung, bei der der Ester in die entsprechende Säure und den zugehörigen Alkohol gespalten wird.
- 2. Reaktionsschritt: Eliminierung Im zweiten Schritt entsteht trans-trans-Muconsäure aus dem Ergebnis des ersten Schritts durch Dehydratisierung. Hierbei wird Wasser entfernt, um die Doppelbindungen im Molekül zu erzeugen. Dies ist eine Eliminierungsreaktion.
3.4
Reaktionsmechanismus für die Synthese von Polymer A
Es handelt sich um eine radikalische Polymerisation:
Startreaktion
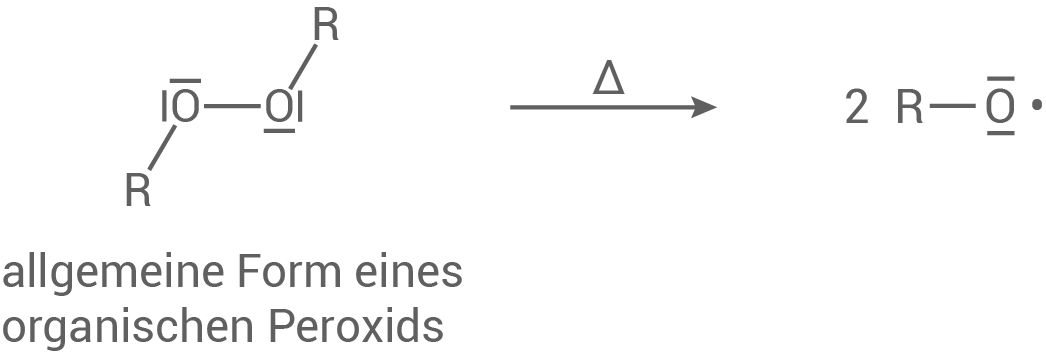 In der Startreaktion wird das organische Peroxid durch eine thermische oder chemische Aktivierung in Radikale gespalten. Die gebildeten Radikale sind hochreaktive Spezies mit einem ungepaarten Elektron.
Radikalische Polymerisation
In der Startreaktion wird das organische Peroxid durch eine thermische oder chemische Aktivierung in Radikale gespalten. Die gebildeten Radikale sind hochreaktive Spezies mit einem ungepaarten Elektron.
Radikalische Polymerisation
(Wachstumsreaktion/Kettenreaktion)
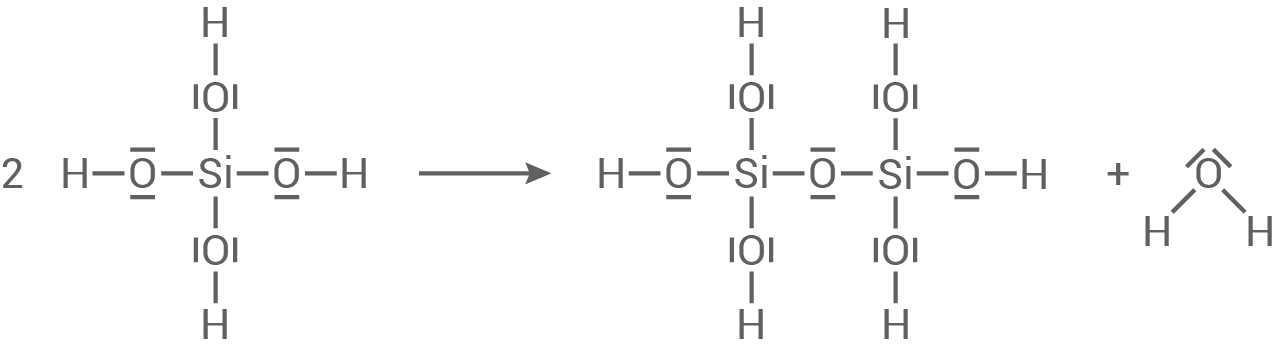 Entwicklung einer mesomeren Grenzformel
Entwicklung einer mesomeren Grenzformel
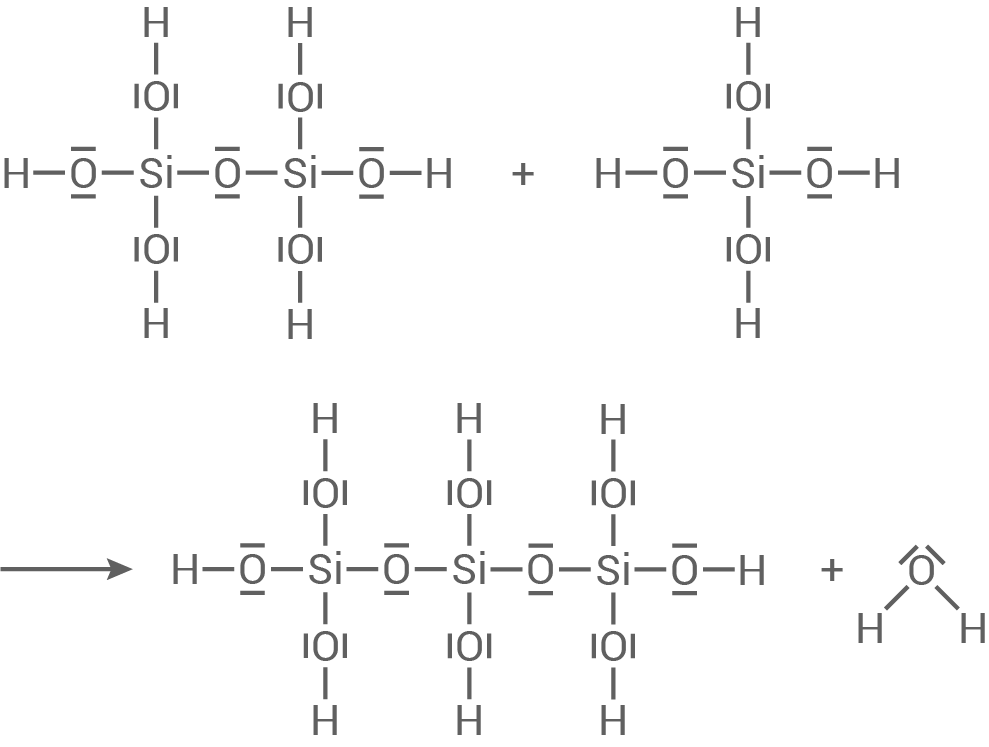 Erklärung des Entstehens von Polymer B
Die mesomere Grenzformel zeigt, dass die Kette auch an
Erklärung des Entstehens von Polymer B
Die mesomere Grenzformel zeigt, dass die Kette auch an  erfolgen kann. Durch diese Kettenfortpflanzung kann Polymer B entstehen.
erfolgen kann. Durch diese Kettenfortpflanzung kann Polymer B entstehen.

(Wachstumsreaktion/Kettenreaktion)


3.5
Verhalten von Polymer A beim Erwärmen und Zuordnung der Klasse
Die Struktur von Polymer A zeigt eine lineare und regelmäßig strukturierte Molekülkette. Diese ist typisch für einen Thermoplasten.
Es wirken intramolekulare VAN-DER-WAALS-Kräfte, Dipol-Dipol-Kräfte und Wasserstoffbrückenbindungen. Diese werden bei Erwärmung in Bewegung gesetzt, bis diese Kräfte schließlich überwunden werden. Dabei gleiten die Molekülketten aneinander vorbei, wodurch der Kunststoff erweicht und verformbar wird, bis er schließlich anfängt zu schmelzen. Charakteristisch ist, dass das Polymer beim Abkühlen erhärtet und die 'aktuelle' Form bei Raumtemperatur stabil bleibt.
Erklärung des Sachverhalts
Polymer B zeigt innerhalb der Makromolekülkette Doppelbindungen. Wird das Polymer mit Styrol umgesetzt, werden Quervernetzungen gebildet, welche ein aneinander vorbeigleiten beim Erwärmen verhindern – bei hohen Temperaturen erweicht der Kunststoff also nicht. Es handelt sich um einen Duroplasten, welcher sich bei entsprechend hohen Temperaturen zersetzt.
3.6
Berechnung des Volumens an reinem, flüssigen Benzol
Zunächst kann die Masse an Benzol in dem Raum über die Dichte berechnet werden:
![\(\begin{array}[t]{rll}
m\,\text{(Benzol)}&=& \rho \cdot V & \\[5pt]
&=& 2\,\text{mg} \cdot\text{m}^{-3} \cdot 300\,\text{m}^3 & \\[5pt]
&=& 600 \,\text{mg} & \\[5pt]
\end{array}\)](https://www.schullv.de/resources/formulas/da8cd60eff51799039edfd03cebb8463a5dffd2b33ea354cc0b0073d7ce20f22_light.svg) Daraus kann nun das Volumen von reinem, flüssigem Benzol berechnet werden:
Daraus kann nun das Volumen von reinem, flüssigem Benzol berechnet werden:
![\(\begin{array}[t]{rll}
V\,\text{(Benzol)} &=&\dfrac{m}{V} & \\[5pt]
&=& \dfrac{ 600 \,\text{mg}}{874\,\text{mg} \cdot \text{mL}^{-1}} & \\[5pt]
&\approx& 0,687\,\text{mL }
\end{array}\)](https://www.schullv.de/resources/formulas/e172f239ca9c60e6da4a1431565af862d3fe637d9aa9d6d9c25126bf1a56d4b3_light.svg) Berechnung der Masse an trans-trans-Muconsäure
Mit der gegebenen Konzentration und dem Volumen der Urinprobe kann zunächst die Stoffmenge berechnet werden:
Berechnung der Masse an trans-trans-Muconsäure
Mit der gegebenen Konzentration und dem Volumen der Urinprobe kann zunächst die Stoffmenge berechnet werden:
![\(\begin{array}[t]{rll}
n&=& c \cdot V & \\[5pt]
&=& 1,123 \cdot 10^{–5}\,\text{mol}\cdot \text{L}^{-1} \cdot 0,05\,\text{L} & \\[5pt]
&=& 5,615 \cdot 10^{–7} \,\text{mol}
\end{array}\)](https://www.schullv.de/resources/formulas/96f83f65a3dd24055957ff71df3b23635291bc0f2716a9adbac6afb1ebbd05bb_light.svg) Daraus folgt die Berechnung der Masse:
Daraus folgt die Berechnung der Masse:
![\(\begin{array}[t]{rll}
m &=& n \cdot M & \\[5pt]
&=& 5,615 \cdot 10^{–7} \,\text{mol} \cdot 142 \,\text{g} \cdot \text{mol}^{-1} & \\[5pt]
&=& 79,733 \,\text{mg} \approx 80\,\text{mg}
\end{array}\)](https://www.schullv.de/resources/formulas/0839907dc3776d6cd3d285198c9aa956dc0646d887bb662401d2021e97fdb5b7_light.svg)