Vorschlag B – Styrol und Polystyrol
Styrol (Phenylethen) wurde im Jahr 1835 zum ersten Mal aus dem Destillat des orientalischen Amberbaums gewonnen. Styrol dient heute zur Herstellung von Kunststoffen und wird im großtechnischen Maßstab hergestellt (Material 1).
Der wichtigste aus Styrol hergestellte Kunststoff ist Polystyrol, wobei die Synthese nicht nur radikalisch (Material 2), sondern auch anionisch erfolgen kann (Material 5).
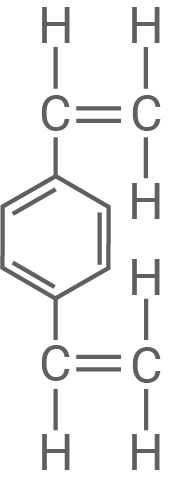
Werden während des Polymerisationsprozesses von Styrol zu Polystyrol geeignete andere Verbindungen, wie zum Beispiel 1,4-Divinylbenzol (Material 6), zugegeben, entstehen andere Kunststoffe.
Die Verbindung 1,2,5,6,9,10-Hexabromcyclododecan befindet sich zum Beispiel in Polystyrol-Hartschaum, der in Gebäuden verbaut ist. Dieser Stoff dient als Flammschutzmittel und soll zur Gebäudesicherheit beitragen.
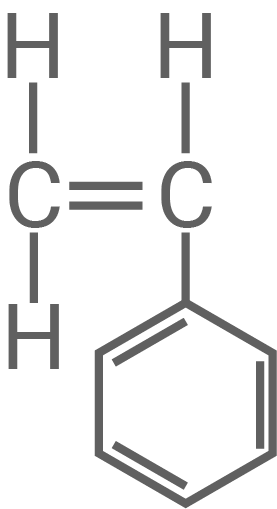 Styrol lässt sich ohne weiteren Reaktionspartner in einer Gleichgewichtsreaktion mithilfe eines Katalysators aus Ethylbenzol herstellen. Als zusätzliches Reaktionsprodukt entsteht Wasserstoff. Bei dieser Reaktion wird die Temperatur so gewählt, dass alle Reaktionspartner gasförmig vorliegen.
Die folgenden Nebenreaktionen lassen sich durch die entsprechende Wahl der Reaktionsbedingungen zwar zurückdrängen, sind jedoch bei der Herstellung von Styrol grundsätzlich bedeutsam:
Styrol lässt sich ohne weiteren Reaktionspartner in einer Gleichgewichtsreaktion mithilfe eines Katalysators aus Ethylbenzol herstellen. Als zusätzliches Reaktionsprodukt entsteht Wasserstoff. Bei dieser Reaktion wird die Temperatur so gewählt, dass alle Reaktionspartner gasförmig vorliegen.
Die folgenden Nebenreaktionen lassen sich durch die entsprechende Wahl der Reaktionsbedingungen zwar zurückdrängen, sind jedoch bei der Herstellung von Styrol grundsätzlich bedeutsam:
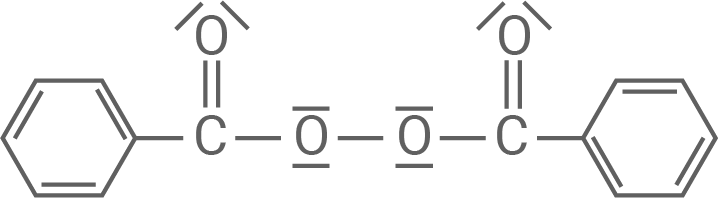



 bezeichnet man als die molare freie Standardreaktionsenthalpie. Sie wird in
bezeichnet man als die molare freie Standardreaktionsenthalpie. Sie wird in  angegeben. Für die Berechnung von
angegeben. Für die Berechnung von  muss der für
muss der für  berechnete Wert vor dem Einsetzen in die Gleichung zunächst von Joule
berechnete Wert vor dem Einsetzen in die Gleichung zunächst von Joule  in Kilojoule
in Kilojoule  umgerechnet werden.
Der Wert für die Temperatur
umgerechnet werden.
Der Wert für die Temperatur  wird in der Einheit Kelvin
wird in der Einheit Kelvin  angegeben. Es gilt:
angegeben. Es gilt:  entspricht
entspricht  ; der absolute Nullpunkt der Temperatur liegt bei
; der absolute Nullpunkt der Temperatur liegt bei  Ergibt sich für
Ergibt sich für  ein negativer Wert, so läuft die Reaktion freiwillig ab, ergibt sich ein positiver Wert, so ist dies nicht der Fall.
ein negativer Wert, so läuft die Reaktion freiwillig ab, ergibt sich ein positiver Wert, so ist dies nicht der Fall.
Der wichtigste aus Styrol hergestellte Kunststoff ist Polystyrol, wobei die Synthese nicht nur radikalisch (Material 2), sondern auch anionisch erfolgen kann (Material 5).
Werden während des Polymerisationsprozesses von Styrol zu Polystyrol geeignete andere Verbindungen, wie zum Beispiel 1,4-Divinylbenzol (Material 6), zugegeben, entstehen andere Kunststoffe.
Die Verbindung 1,2,5,6,9,10-Hexabromcyclododecan befindet sich zum Beispiel in Polystyrol-Hartschaum, der in Gebäuden verbaut ist. Dieser Stoff dient als Flammschutzmittel und soll zur Gebäudesicherheit beitragen.
2.1
Formuliere mit Hilfe von Material 1 in Strukturformeln für die organischen Moleküle jeweils die Reaktionsgleichung für die Herstellung von Styrol sowie für jede der drei angegebenen Nebenreaktionen.
Erkläre die Bedeutung eines niedrigen Drucks sowie die Bedeutung der Verdünnung der Gase mit Wasserdampf für eine hohe Ausbeute an Styrol.
(12 BE)
2.2
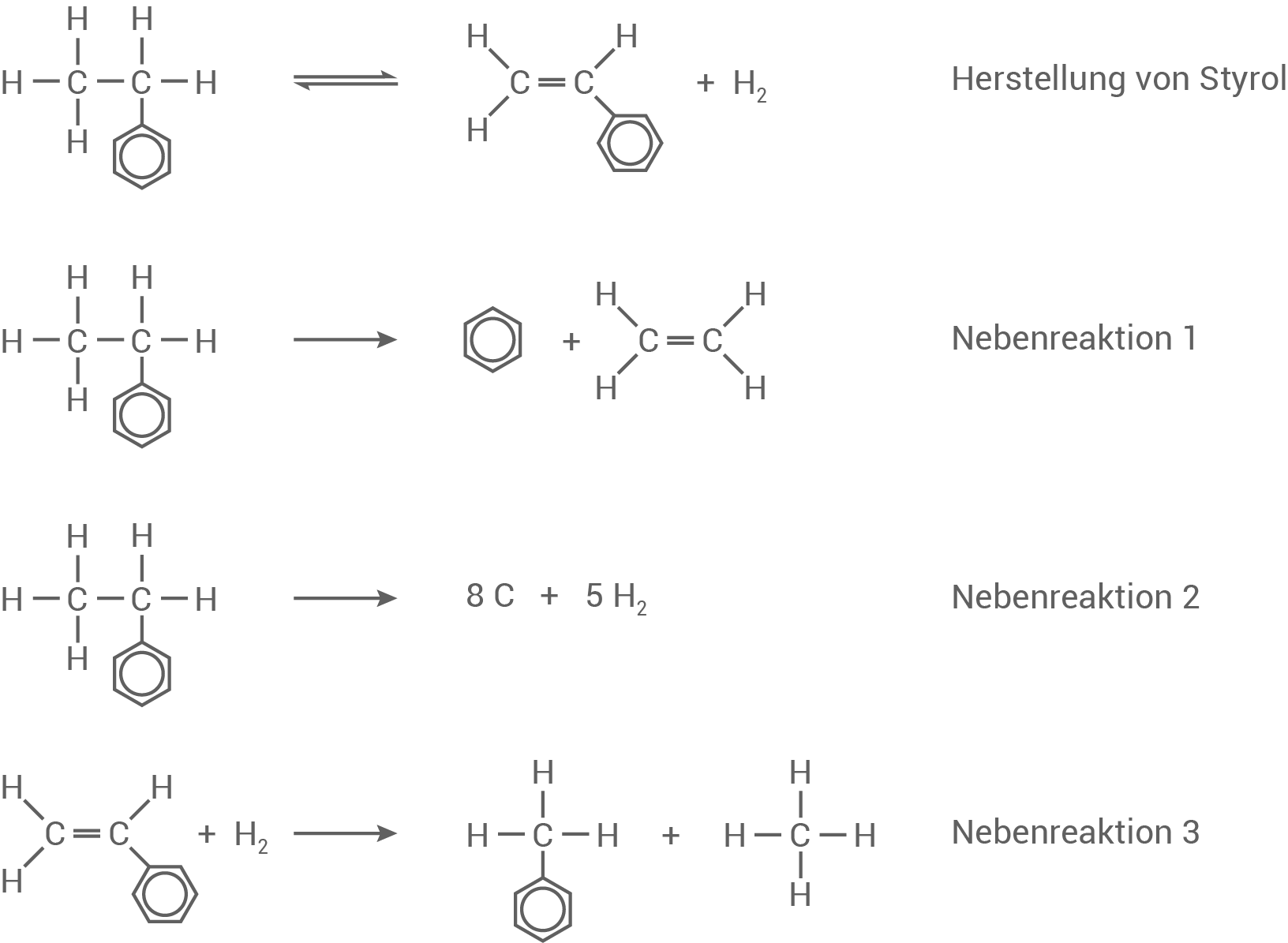
Formuliere mit Hilfe von Material 2 unter Berücksichtigung zweier möglicher Abbruchreaktionen den Reaktionsmechanismus für die radikalische Polymerisation von Styrol zu Polystyrol.
(6 BE)
2.3
Erkläre, weshalb der Wert der molaren Standard-Polymerisationsentropie (Material 3) für die Reaktion von Styrol zu Polystyrol negativ ist.
Begründe mit Hilfe von Material 3 und Material 4 die Tatsache, dass die Reaktionstemperatur bei der Polymerisation von Styrol einen bestimmten Wert nicht überschreiten darf.
Hinweis
Eine Berechnung ist nicht erforderlich.
Eine Berechnung ist nicht erforderlich.
(8 BE)
2.4
Formuliere mit Hilfe von Material 5 unter Berücksichtigung des ersten und des zweiten Reaktionsschritts den Reaktionsmechanismus für die anionische Polymerisation von Styrol zu Polystyrol.
Formuliere unter Verwendung von Strukturformeln für die organischen Moleküle die Reaktionsgleichung für die in Material 5 genannte Protolysereaktion.
Begründe, dass die über eine anionische Polymerisation entstandenen Polystyrol-Makromoleküle alle annähernd die gleiche Molekülmasse bzw. Kettenlänge haben.
(11 BE)
2.5
Beschreibe und erläutere das Verhalten von Polystyrol beim Erwärmen.
Erkläre, wie sich die Eigenschaften des entstehenden Kunststoffs verändern, wenn während des Polymerisationsprozesses von Styrol die Verbindung 1,4-Divinylbenzol (Material 6) zur Reaktionsmischung hinzugefügt wird.
(7 BE)
2.6
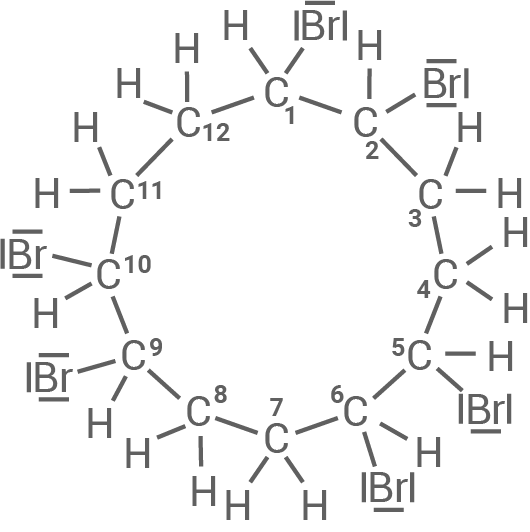
Die Verbindung 1,2,5,6,9,10-Hexabromcyclododecan ist ein ringförmiges Halogenalkan.
Formuliere die Strukturformel von 1,2,5,6,9,10-Hexabromcyclododecan mit allen bindenden und nichtbindenden Elektronenpaaren.
Beschreibe, weshalb zwischen 1,2,5,6,9,10-Hexabromcyclododecan-Molekülen keine Wasserstoffbrücken ausgebildet werden können.
(6 BE)
(50 BE)
Material 1
Herstellung von Styrol

Styrol
a)
Spaltung von Ethylbenzol in Benzol (Benzen) und Ethen
b)
Vollständiger Zerfall von Ethylbenzol zu Kohlenstoff und Wasserstoff
c)
Reaktion von Styrol mit Wasserstoff zu Toluol (Methylbenzol) und Methan
Um die Ausbeute an Styrol zu erhöhen, ist es von Bedeutung, dass der Druck im Reaktionsgefäß, das räumlich von der Umgebung abgeschlossen ist, möglichst niedrig gehalten wird.
Darüber hinaus befindet sich ständig Wasserdampf in der Apparatur, der nicht an der Reaktion teilnimmt, aber zu einer Verdünnung der Gase führt. Diese Verdünnung der Gase mit Wasserdampf wirkt sich zusätzlich günstig auf die Ausbeute an Styrol aus. Dies ist der Fall, da Wasserstoff-Moleküle und Wasser-Moleküle nun um Zusammenstöße mit Styrol-Molekülen konkurrieren. Ein Zusammenstoß von Molekülen ist eine Voraussetzung für eine chemische Reaktion.
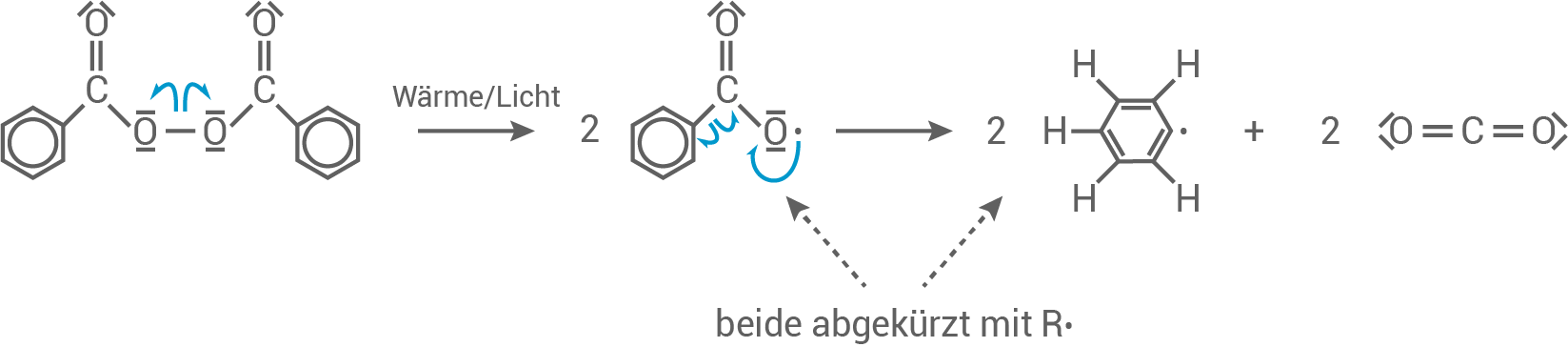
Material 2
Dibenzoylperoxid
Dibenzoylperoxid gilt in der Chemie als ein „Radikalstarter“, da es leicht in einer homolytischen Spaltung in zwei Radikale zerfällt.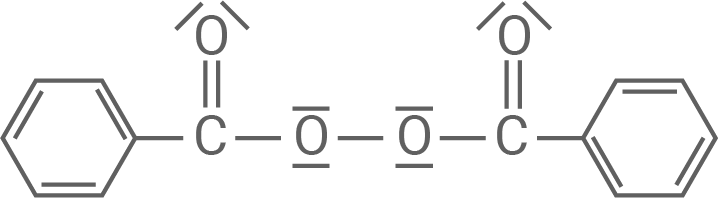
Material 3
Molare Standard-Polymerisationsenthalpie und molare Standard-Polymerisationsentropie zur Bildung von Polystyrol
Material 4
Verfahren zur Beurteilung, ob eine chemische Reaktion freiwillig abläuft
Mithilfe folgender Gleichung („Gibbs-Helmholtz-Gleichung") lässt sich ermitteln, ob bei einer bestimmten Temperatur eine chemische Reaktion freiwillig abläuft:Material 5
Anionische Polymerisation von Styrol
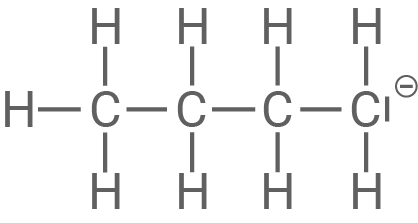
Die Polymerisation von Styrol zu Polystyrol kann in einer Argon-Schutzatmosphäre auch über einen anionischen Reaktionsmechanismus erfolgen. Diese Schutzatmosphäre ist erforderlich, um auch Spuren von Luftfeuchtigkeit auszuschließen, da andernfalls die Kettenreaktion durch eine Protolysereaktion abgebrochen würde. Im ersten Reaktionsschritt reagiert jeweils ein Butyl-Anion mit einem Styrol-Molekül zu einem größeren Anion, das in einem zweiten Reaktionsschritt seinerseits in die Kettenreaktion eintritt. Im vorliegenden Fall gilt, dass der erste Reaktionsschritt schneller verläuft als der zweite.
Butyl-Anion
Material 6
Strukturformel von 1,4-Divinylbenzol

2.1
Reaktionsgleichungen
 Bedeutung niedriger Druck
Bedeutung niedriger Druck

- Da es sich um eine Gleichgewichtsreaktion handelt, wird das Prinzip von LE CHATELIER und BRAUN, also das Prinzip des kleinsten Zwangs angewendet.
- Bei einer Druckerhöhung verschiebt sich das Gleichgewicht zum Ausgleich auf die Seite mit dem kleineren Volumen bzw. auf die, bei der weniger gasförmige Teilchen vorhanden sind.
- Die Reaktionsgleichung zeigt, dass ein Eduktmolekül zu zwei Produktmolekülen reagiert – das Volumen ist daher auf der Produktseite höher.
- Durch einen niedrigen Druck kann das Gleichgewicht auf Seite der Produkte verschoben werden, wodurch folglich die Styrolausbeute erhöht wird.
- Die Zugabe von Wasserdampf bewirkt die Verdünnung des Produkts. Dadurch nimmt die Wahrscheinlichkeit, dass Wasserstoff und Styrol zusammentreffen und reagieren ab.
- Die Styrolausbeute wird also erhöht, weil dadurch die Rückreaktion vermindert abläuft.
- Die Verdünnung kann auch bewirken, dass die dritte Nebenreaktion weniger abläuft und somit der Verlust an Styrol vermindert wird.
2.2
Reaktionsmechanismus für die radikalische Polymerisation von Styrol zu Polystyrol
Bildung des Startradikals:
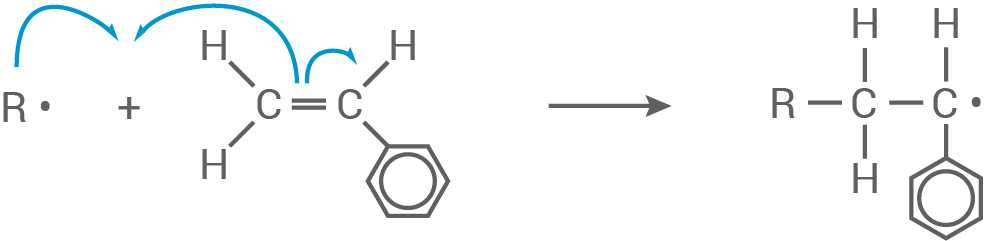 Kettenwachstum:
Kettenwachstum:
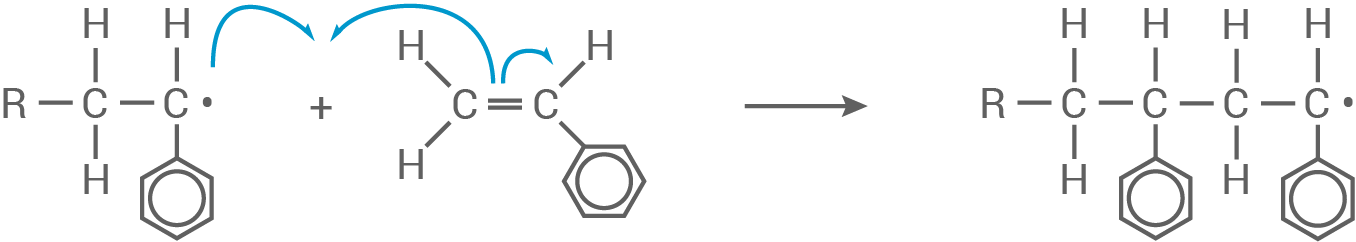 Abbruchreaktion (Rekombination):
Abbruchreaktion (Rekombination):
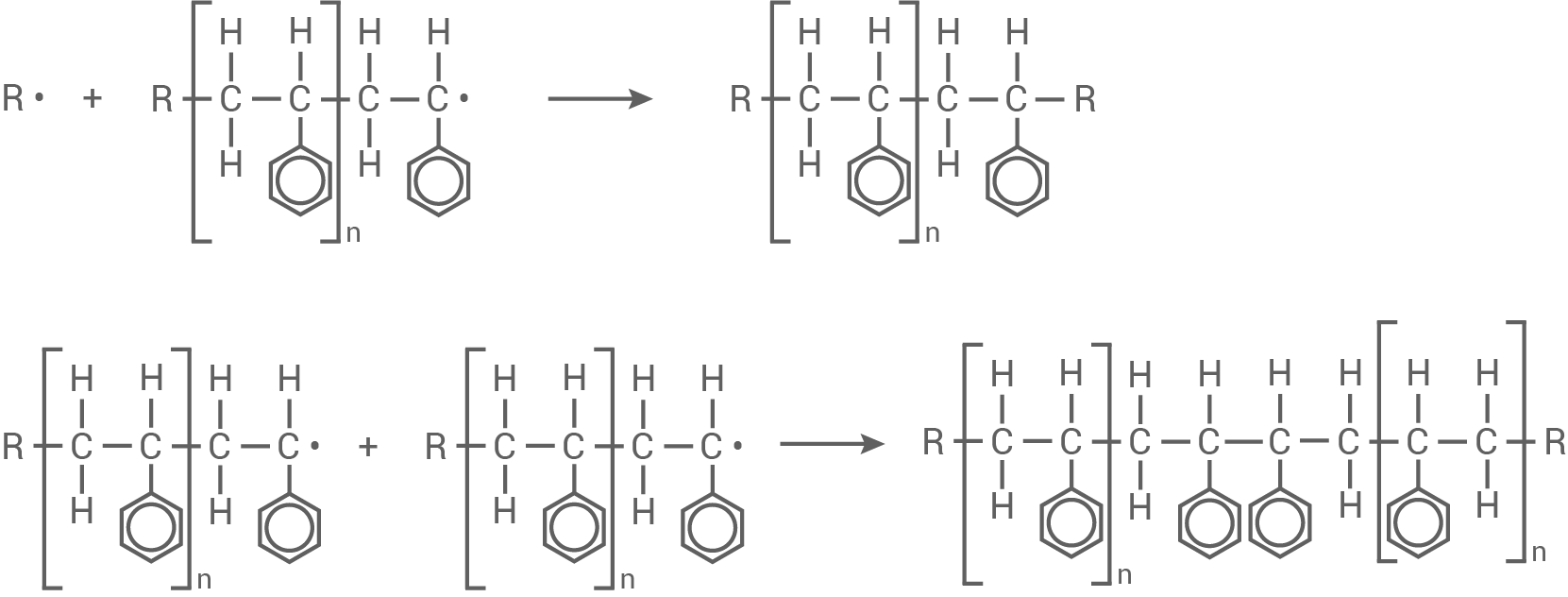

- Durch die Zufuhr von Energie (Wärme/Licht) wird die Peroxid-Bindung
homolytisch gespalten.
- Das Dibenzylperoxid reagiert hier zu zwei Benzylradikalen, die die Startradikale für die folgende Kettenreaktion darstellen.



2.3
Molare Standard-Polymerisationsentropie
- Der Wert für die molare Standard-Polymerisationsentropie ist negativ.
- Die Entropie beschreibt die herrschende Ordnung. Das bedeutet, je höher der Wert der Entropie, desto höher die Unordnung.
- Bei der radikalischen Polymerisation wächst die Polymerkette und die Anzahl der Styrolmonomere nimmt ab.
- Folglich nimmt die Unordnung und damit auch die Entropie ab, wodurch der negative Wert erklärt wird.
- Für die Erklärung ist es wichtig, die GIBBS-HELMHOLTZ-Gleichung zu betrachten. Diese beschreibt, ob eine Reaktion freiwillig abläuft und bezieht die Entropie, Enthalpie und Temperatur ein:
- Wenn
läuft die Reaktion freiwillig ab (exergon);
wennläuft die Reaktion nicht freiwillig ab (endergon).
- Da die Polymerisationsentropie negativ ist, wird dieser Teil der Gleichung mit steigender Temperatur negativer.
- Durch das negative Vorzeichen bewirkt eine Temperaturerhöhung allerdings, dass der Term immer positiver wird.
- Gegeben ist
deswegen läuft die Reaktion nicht mehr ab, wenn der Term
den Wert
erreicht.
2.4
Reaktionsmechanismus für die anionische Polymerisation von Styrol zu Polystyrol
Kettenstart:
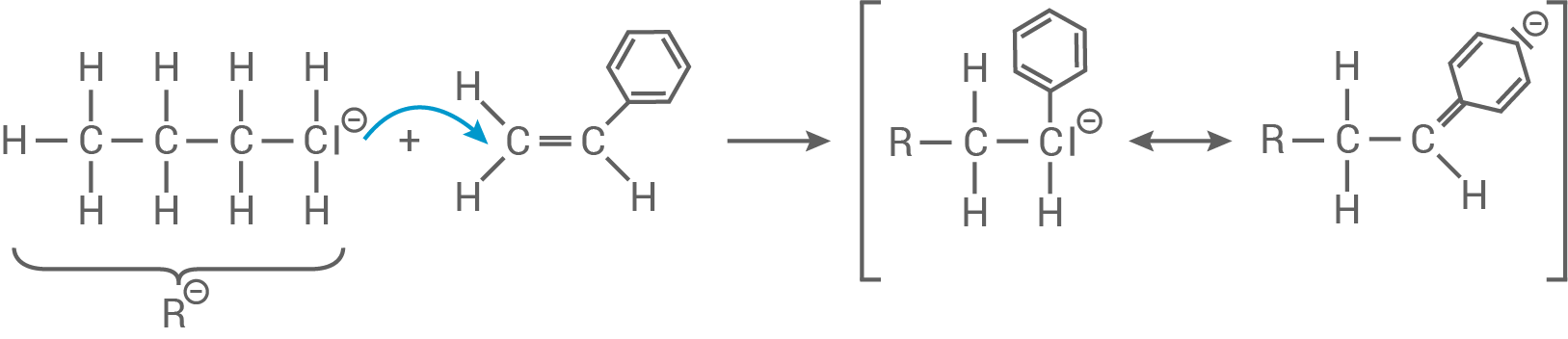 Kettenwachstum:
Kettenwachstum:
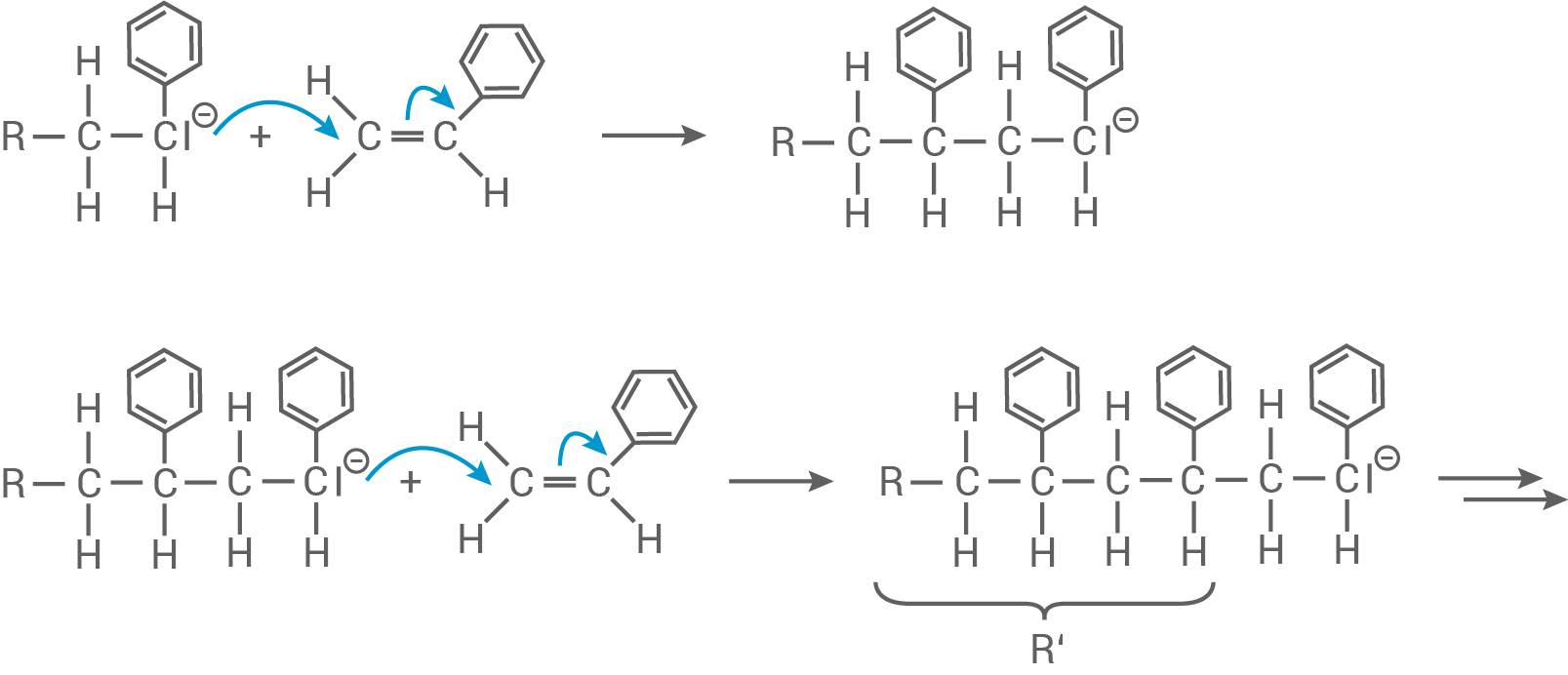 Protolysereaktion
Protolysereaktion
 Gleiche Molekülmasse / Kettenlänge
Gleiche Molekülmasse / Kettenlänge



- Eine anionische Polymerisation stoppt erst, wenn ein Protonendonator (z.B. Wasser) das Kettenwachstum beendet.
- Der erste Reaktionsschritt, indem die Anionen gebildet werden, läuft schneller ab als die Kette wächst.
- Aus dem Grund entsteht schnell nach Zugabe der Butyl-Anionen die gleiche Menge an Starter-Anionen.
- Diese Starter-Anionen initiieren die langsamer ablaufende Fortpflanzung der Kette.
- Im Gegensatz zur radikalischen Polymerisation bricht die wachsende Kette nicht durch Rekombination ab, sondern endet, wenn alle Monomere verbraucht sind oder durch Hydrolyse.
- Dadurch haben alle entstandenen Polystyrol-Makromoleküle annähernd die gleiche Molekülmasse bzw. Kettenlänge.
2.5
Verhalten von Polystyrol beim Erwärmen
- Die Struktur von Polystyrol zeigt lineare, unvernetzte Polymerketten:
- Dies ist charakteristisch für einen Thermoplast.
- Wird ein Thermoplast erwärmt, bewegen sich die Polymerketten immer mehr.
- Je höher die Temperatur, desto stärker die Bewegung und desto weniger wirken intermolekulare Kräfte (hier: VAN-DER-WAALS-Kräfte) zwischen den Polymerketten.
- Es ist ein Schmelzen zu beobachten, wenn diese zwischenmolekularen Kräfte letztendlich überwunden werden und die Polymerketten auseinandergleiten.
- Das bedeutet bei Erwärmung erweicht Polystyrol und schmilzt bei weiterer Wärmezufuhr.

(auf Teilchenebende)
- Wenn während des Polymerisationsprozesses 1,4-Divinylbenzol zu Styrol hinzugegeben wird, kommt es zu einer Strukturveränderung.
- 1,4-Divinylbenzol besitzt zwei Doppelbindungen, die das Kettenwachstum starten können.
- Dadurch entsteht statt einer linearen Polymerkette, eine vernetzte Struktur:
- So ein hochvernetztes Polymernetzwerk ist charakteristisch für einen Duroplasten.
- Durch die engmaschig vernetzte Struktur erweichen oder schmelzen Duroplaste beim Erwärmen nicht, da die Polymerketten nicht auseinander gleiten können.
- Bei hohen Temperaturen kommt es durch starke Schwingungen zu Bindungsbrüchen.
- Dadurch verkohlt der Duroplast und wird irreversibel zerstört.
- Es werden durch die Zugabe also vor allem die thermischen Eigenschaften verändert.
2.6
Strukturformel
 Keine Ausbildung von Wasserstoffbrücken
Keine Ausbildung von Wasserstoffbrücken

1,2,5,6,9,10-Hexabromcyclodecan
- Damit Moleküle untereinander Wasserstoffbrückenbindungen ausbilden können, sind positive und negative Partialladungen durch hohe Elektronegativitätsdifferenzen notwendig.
- Das ist beispielsweise der Fall, wenn
durch einen elektronegativeren Bindungspartner wie
positiv polarisiert ist und folglich eine Wasserstoffbrücke zu einem negativ polarisierten Atom ausbildet.
- In diesem Fall beträgt die Elektronegativitätsdifferenz zwischen den
- und
-Atomen nur
- Das bedeutet, die Polarisierung ist nicht groß genug, um intermolekulare Brücken auszubilden.