Vorschlag C – Aufbau und Abbau energiereicher Stoffe
Aufbau und Abbau energiereicher Stoffe
Pflanzen und viele Mikroorganismen sind in der Lage, die für ihre Lebensprozesse notwendigen energiereichen Stoffe und Moleküle selbst herzustellen. Grüne Pflanzen nutzen hierfür die Energie des Sonnenlichts, um im Rahmen der Photosynthese Glucose herzustellen. Manche Mikroorganismen, die unter Lichtausschluss leben, nutzen dagegen die chemische Energie aus anorganischen Stoffen, um energiereiche Moleküle herzustellen. Menschen und Tiere müssen energiereiche Stoffe wie z.B. Glucose und Stärke mit ihrer Nahrung aufnehmen. Glucose wird in Körperzellen im Rahmen der sogenannten Zellatmung in Anwesenheit von Sauerstoff zu Kohlendioxid und Wasser abgebaut. Fehlt Sauerstoff zum (vollständigen) Abbau der Glucose, so laufen sogenannte Gärungsprozesse ab. Die Energie mancher süß schmeckenden Stoffe kann der menschliche Körper nicht nutzen, da diese Stoffe im Körper nicht verdaut bzw. nicht abgebaut werden können. Daher können diese Stoffe als sogenannte Zuckeraustauschstoffe Verwendung finden.
1
Formuliere die im Rahmen der Photosynthese erfolgende Umsetzung von Kohlendioxid und Wasser zu Glucose und Sauerstoff in Summenformeln für alle beteiligten Stoffe.
Erläutere, ob die Entropie bei dieser Reaktion zunimmt oder abnimmt.
Berechne mithilfe von Material 1 die molare Standardreaktionsenthalpie für die oben formulierte Reaktion und berechne, welches Volumen an Sauerstoff bei gleichzeitiger Bildung von  Glucose entsteht.
Glucose entsteht.
Hinweis:
Für das molare Volumen eines Gases bei Raumtemperatur gilt
Hinweis:
Für das molare Volumen eines Gases bei Raumtemperatur gilt
(8 BE)
2
Im Gegensatz zu Lebewesen, die im Rahmen der Photosynthese Licht als Energiequelle nutzen, beziehen manche Organismen, die unter Lichtausschluss leben, ihre Energie aus anorganischen Stoffen, die in ihrem Lebensraum vorliegen.
Formuliere mithilfe von Material 2 die Reaktionsgleichung der ersten Reaktion und zeige für die zweite Reaktion anhand der wesentlichen Oxidationszahlen und der Elektronenübergänge, dass es sich um eine Redoxreaktion handelt.
(5 BE)
3
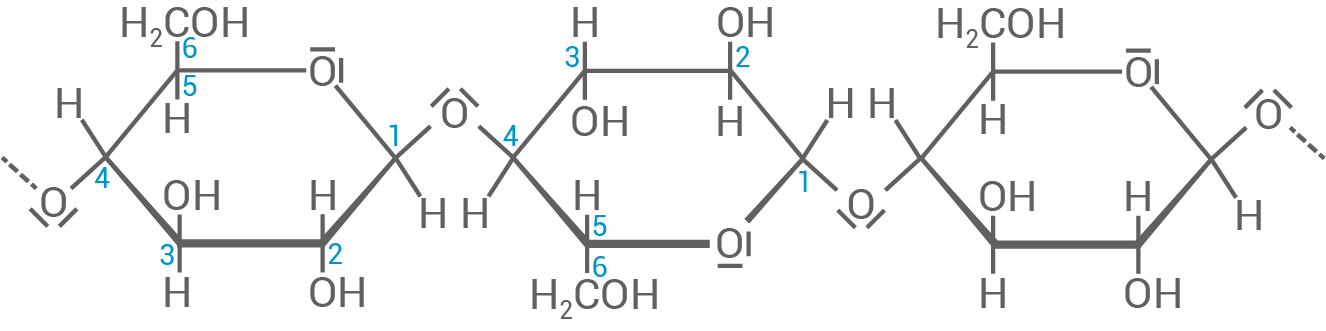
Die im Rahmen der Photosynthese gebildete Glucose kann zu Stärke, die zur Energiespeicherung dient, oder zu Cellulose, die Zellwandbestandteil ist, verknüpft werden.
Beschreibe sowohl für Stärke als auch für Cellulose den Aufbau der Makromoleküle und die Verknüpfung der jeweiligen Monomer-Bausteine.
Zeichne einen Strukturausschnitt der Cellulose, der drei Monomer-Bausteine umfasst.
(7 BE)
4
Formuliere mithilfe von Material 3 die jeweilige Strukturformel von Stoff X und Stoff Y und benenne die beiden Stoffe gemäß der IUPAC-Nomenklatur.
Beschreibe allgemein die Durchführung einer Fehling-Probe sowie die Beobachtung bei ihrem positiven Verlauf.
Formuliere für den Nachweis von Kohlendioxid eine Reaktionsgleichung und erkläre die Beobachtung im positiven Fall.
Gib für jedes Atom des Kohlendioxid-Moleküls die Hybridisierung an und beschreibe die Bindungsverhältnisse im Kohlendioxid-Molekül auf der Grundlage des Orbitalmodells.
(13 BE)
5
Brenztraubensäure (Material 3) stellt ein wesentliches Zwischenprodukt im Abbau der Glucose dar. Brenztraubensäure unterscheidet sich hinsichtlich ihrer Säurestärke von Propansäure. Außerdem kann Brenztraubensäure in wässriger Lösung in unterschiedlichen Formen vorliegen (Material 4).
Erkläre, welche der beiden Säuren (Brenztraubensäure oder Propansäure) die stärkere Säure ist.
Formuliere für Reaktion A (Material 4) der Brenztraubensäure die Reaktionsgleichung in Strukturformeln für alle Stoffe und benenne den Reaktionsmechanismus.
Entwickle für Reaktion B (Material 4) der Brenztraubensäure den Reaktionsmechanismus und benenne diese Art der Umwandlung von Isomeren.
(11 BE)
6
Erythrit (Material 5) ist ein Beispiel für einen Zuckeraustauschstoff, der von manchen Mikroorganismen produziert wird und weder den menschlichen Blutzuckerspiegel beeinflusst noch von Karies-Bakterien im Mund abgebaut werden kann.
Entwickle für alle Stereoisomere von Butan-1,2,3,4-tetrol die jeweilige Strukturformel in der Fischer-Projektion.
Nimm Stellung zur Richtigkeit der unterschiedlichen Aussagen der beiden Praktikanten aus Material 5.
(6 BE)
Material 1
Molare Standardbildungsenthalpien
| Stoff | molare Standardbildungsenthalpie
|
|---|---|
| Kohlendioxid | |
| Glucose | |
| Wasser |
Material 2
Energiegewinnung unter Lichtausschluss
Spezielle Schwefelbakterien sind in der Lage, Schwefelwasserstoff als Energiequelle zu nutzen. In einer ersten energieliefernden Reaktion setzen sie SchwefelwasserstoffMaterial 3
Der Abbau von Glucose bei Abwesenheit von Sauerstoff (Gärung)
Der Abbau der Glucose im Rahmen der Zellatmung erfolgt in mehreren Phasen, wobei zunächst die sogenannte Brenztraubensäure (2-Oxopropansäure) gebildet wird. Steht der Zelle Sauerstoff zur Verfügung, so erfolgt unter Energiefreisetzung der weitere Abbau der Brenztraubensäure bis hin zum Kohlendioxid. Fehlt Sauerstoff, so kann die Zelle dennoch in geringem Umfang Energie gewinnen. Dieser Vorgang wird als Gärung bezeichnet und kann – je nach Zelltyp und Organismus – in unterschiedlichen Varianten auftreten, die in der folgenden Abbildung dargestellt sind.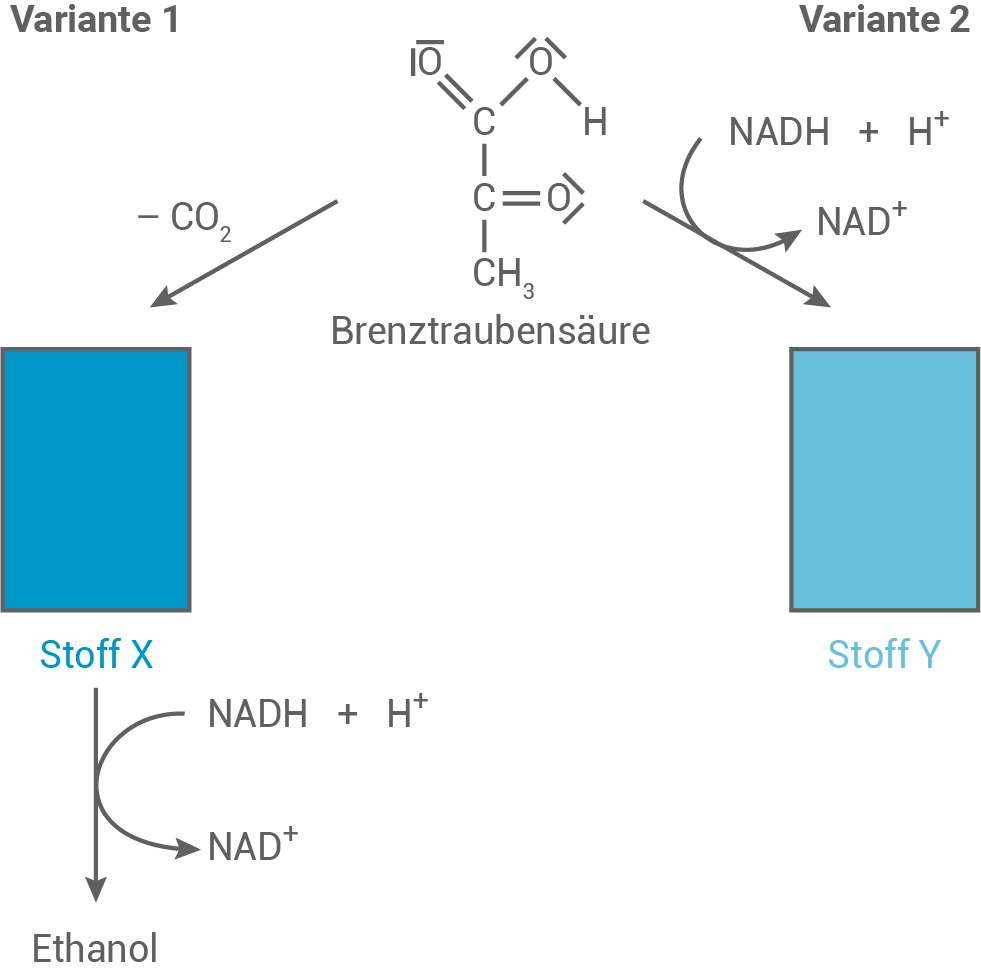
Stoff Y reagiert sauer und ist optisch aktiv und soll hier in der L-Konfiguration vorliegen.
Material 4
Reaktionen von Brenztraubensäure in wässriger Lösung
Reaktion A: Brenztraubensäure reagiert an der Keto-Gruppe mit Wasser unter Bildung zweier für Alkohole charakteristischer Gruppen; ein weiteres Produkt entsteht nicht. Reaktion B: Durch Reaktion mit einem Hydroxid-Ion kommt es am Molekül der Brenztraubensäure zur Deprotonierung an der Methyl-Gruppe und es entstehen Wasser sowie ein mesomeriestabilisiertes Anion.Durch Reaktion eines Wasser-Moleküls mit dem mesomeriestabilisierten Anion entstehen ein Hydroxid-Ion sowie eine Verbindung, die eine Kohlenstoff-Kohlenstoff-Doppelbindung enthält.
Material 5
Der Zuckeraustauschstoff Erythrit
Erythrit ist eines der Stereoisomeren von Butan-1,2,3,4-tetrol (alternativ 1,2,3,4-Tetrahydroxybutan). Das Erythrit-Molekül stellt also einen unverzweigten Alkohol mit vier Kohlenstoff-Atomen und vier Hydroxy-Gruppen dar, wobei es sich beim C2-Atom und beim C3-Atom jeweils um ein asymmetrisches Kohlenstoff-Atom handelt. Zwischen zwei Praktikanten kommt es zu einer fachwissenschaftlichen Diskussion. Praktikant A sagt:„Im Molekül existieren zwei asymmetrische Kohlenstoff-Atome. Da an jedem der beiden asymmetrischen Kohlenstoff-Atome die Hydroxy-Gruppen jeweils auf unterschiedlichen Seiten stehen können, muss es insgesamt 4 Stereoisomere der Verbindung geben.“ Praktikant B widerspricht und behauptet:
„Es gibt weniger als vier Stereoisomere der Verbindung.“
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1
Reaktionsgleichung der Photosynthese


 Erläuterung zur Entropie
Bei dieser Reaktion nimmt die Entropie ab, da sich gasförmige Moleküle (Kohlendioxid und Wasser in der Gasphase) in feste Moleküle (Glucose) und weniger gasförmigen Sauerstoff umwandeln. Es entstehen weniger gasförmige Moleküle, was zu einer geringeren Unordnung (Entropie) führt.
Berechnung der molaren Standardreaktionsenthalpie
Die Standardreaktionsenthalpie lässt sich aus den molaren Standardbildungsenthalpien der Edukte und Produkte berechnen:
Da Sauerstoff im Standardzustand gilt:
Erläuterung zur Entropie
Bei dieser Reaktion nimmt die Entropie ab, da sich gasförmige Moleküle (Kohlendioxid und Wasser in der Gasphase) in feste Moleküle (Glucose) und weniger gasförmigen Sauerstoff umwandeln. Es entstehen weniger gasförmige Moleküle, was zu einer geringeren Unordnung (Entropie) führt.
Berechnung der molaren Standardreaktionsenthalpie
Die Standardreaktionsenthalpie lässt sich aus den molaren Standardbildungsenthalpien der Edukte und Produkte berechnen:
Da Sauerstoff im Standardzustand gilt:
![\(\begin{array}[t]{rll}
\Delta_fH_m^0 (O_2)&=& 0 &\\[5pt]
\end{array}\)](https://www.schullv.de/resources/formulas/372e71d712fb07390448521ae2a66a20dab673ee8e7183ad1f0690bd48356d72_light.svg) Die anderen Werte lassen sich aus Material 1 entnehmen.
Damit ergibt sich:
Die molare Standardreaktionsenthalpie beträgt
Die anderen Werte lassen sich aus Material 1 entnehmen.
Damit ergibt sich:
Die molare Standardreaktionsenthalpie beträgt  Berechnung des Volumens an Sauerstoff
Zunächst wird mit der gegebenen Masse an Glucose deren Stoffmenge berechnet:
Berechnung des Volumens an Sauerstoff
Zunächst wird mit der gegebenen Masse an Glucose deren Stoffmenge berechnet:
![\(\begin{array}[t]{rll}
n (C_6H_{12}O_6)&=& \dfrac{m(C_6H_{12}O_6)}{M(C_6H_{12}O_6)} &\\[5pt]
&=& \dfrac{1 \,\text{g}}{180 \,\text{g}\cdot \text{mol}^{-1} } &\\[5pt]
&\approx& 0,006 \,\text{mol}
\end{array}\)](https://www.schullv.de/resources/formulas/f018c8b83bedbc8b661489ce37828115844d6b1012d8d3abd154cd1867584b39_light.svg) Aus der Reaktionsgleichung ergibt sich nun das Stoffmengenverhältnis.
Es gilt:
Aus der Reaktionsgleichung ergibt sich nun das Stoffmengenverhältnis.
Es gilt:
 Daraus folgt:
Daraus folgt:
![\(\begin{array}[t]{rll}
V (O_2)&=& n (O_2) \cdot V_m & \\[5pt]
&=& 6 \cdot 0,006 \,\text{mol} \cdot 24 \,\text{L}\cdot \text{mol}^{-1} & \\[5pt]
&=& 0,864 \,\text{L}
\end{array}\)](https://www.schullv.de/resources/formulas/26b5062f73a8dd3ef52c1d1cfcc59c9de5db326b469ab7c1d52dee11846b3b67_light.svg) Bei gleichzeitiger Bildung von
Bei gleichzeitiger Bildung von  Glucose entstehen
Glucose entstehen  an Sauerstoff.
an Sauerstoff.
2
Reaktionsgleichung der ersten Reaktion


 Zeigen der Redoxreaktion
Zeigen der Redoxreaktion


 Schwefel wird oxidiert, indem er pro Atom 6 Elektronen abgibt (0
Schwefel wird oxidiert, indem er pro Atom 6 Elektronen abgibt (0  +6), während Sauerstoff reduziert wird, indem er Elektronen aufnimmt (0
+6), während Sauerstoff reduziert wird, indem er Elektronen aufnimmt (0  −2). Es handelt sich daher um eine Redoxreaktion.
−2). Es handelt sich daher um eine Redoxreaktion.
3
Aufbau von Stärke
Stärke ist ein Polysaccharid, das aus zwei verschiedenen Molekülen besteht: Amylose und Amylopektin.
Amylose besteht aus langen, unverzweigten Ketten von  -D-Glucose-Einheiten, die durch
-D-Glucose-Einheiten, die durch  -1,4-glycosidische Bindungen miteinander verknüpft sind. Diese Ketten bilden aufgrund der Bindungswinkel eine helikale Struktur, die es der Stärke ermöglicht, kompakt zu sein und als Energiespeicher zu dienen.
Amylopektin ist stark verzweigt. Es besteht ebenfalls aus
-1,4-glycosidische Bindungen miteinander verknüpft sind. Diese Ketten bilden aufgrund der Bindungswinkel eine helikale Struktur, die es der Stärke ermöglicht, kompakt zu sein und als Energiespeicher zu dienen.
Amylopektin ist stark verzweigt. Es besteht ebenfalls aus  -D-Glucose-Einheiten, die hauptsächlich durch
-D-Glucose-Einheiten, die hauptsächlich durch  -1,4-glycosidische Bindungen verbunden sind. Die Verzweigungen treten an den
-1,4-glycosidische Bindungen verbunden sind. Die Verzweigungen treten an den  -1,6-Bindungen auf. Diese verzweigte Struktur macht Amylopektin leichter zugänglich für Enzyme, die es abbauen, was zu einer schnelleren Energieverfügbarkeit führt.
Stärke dient in Pflanzen als Speicherform von Glucose. Da sie sowohl Amylose als auch Amylopektin enthält, hat sie eine Mischung aus linearen und verzweigten Ketten.
Aufbau von Cellulose
Cellulose ist ebenfalls ein Polysaccharid, besteht jedoch ausschließlich aus
-1,6-Bindungen auf. Diese verzweigte Struktur macht Amylopektin leichter zugänglich für Enzyme, die es abbauen, was zu einer schnelleren Energieverfügbarkeit führt.
Stärke dient in Pflanzen als Speicherform von Glucose. Da sie sowohl Amylose als auch Amylopektin enthält, hat sie eine Mischung aus linearen und verzweigten Ketten.
Aufbau von Cellulose
Cellulose ist ebenfalls ein Polysaccharid, besteht jedoch ausschließlich aus  -D-Glucose-Monomeren, die über
-D-Glucose-Monomeren, die über  -1,4-glycosidische Bindungen miteinander verknüpft sind. Diese Bindungsart sorgt dafür, dass die Glucose-Moleküle in Cellulose linear angeordnet sind, ohne Verzweigungen. Die linearen Ketten von Cellulose lagern sich durch Wasserstoffbrückenbindungen parallel zueinander und bilden Fasern.
Die lineare, unverzweigte Struktur und die vielen Wasserstoffbrücken zwischen den Ketten machen Cellulose sehr stabil und widerstandsfähig. Diese Eigenschaften sind für die mechanische Festigkeit der Zellwände in Pflanzen entscheidend. Im Gegensatz zur Stärke kann der menschliche Körper Cellulose aufgrund der fehlenden Enzyme zur Spaltung der
-1,4-glycosidische Bindungen miteinander verknüpft sind. Diese Bindungsart sorgt dafür, dass die Glucose-Moleküle in Cellulose linear angeordnet sind, ohne Verzweigungen. Die linearen Ketten von Cellulose lagern sich durch Wasserstoffbrückenbindungen parallel zueinander und bilden Fasern.
Die lineare, unverzweigte Struktur und die vielen Wasserstoffbrücken zwischen den Ketten machen Cellulose sehr stabil und widerstandsfähig. Diese Eigenschaften sind für die mechanische Festigkeit der Zellwände in Pflanzen entscheidend. Im Gegensatz zur Stärke kann der menschliche Körper Cellulose aufgrund der fehlenden Enzyme zur Spaltung der  -1,4-glycosidischen Bindungen nicht verdauen.
Strukturausschnitt der Cellulose aus drei Monomer-Bausteinen
-1,4-glycosidischen Bindungen nicht verdauen.
Strukturausschnitt der Cellulose aus drei Monomer-Bausteinen

4
Strukturformeln und Nomenklatur von Stoff X und Y
Durchführung der Fehling-Probe
Die Fehling-Probe ist ein chemischer Nachweis für reduzierende Zucker oder Aldehyde. Bei dieser Reaktion wird eine alkalische Lösung von Kupfer -Ionen verwendet, die durch die Anwesenheit von Aldehyden reduziert werden.
Dafür werden zwei Lösungen benötigt:
-Ionen verwendet, die durch die Anwesenheit von Aldehyden reduziert werden.
Dafür werden zwei Lösungen benötigt:
![\([Cu(C_4H_4O_6)_2]^{2-},\)](https://www.schullv.de/resources/formulas/b01fbebf82b052d1c058475953707c5710977149b287ec5952b2aac5e7c8fe96_light.svg) in dem Kupfer
in dem Kupfer -Ionen komplex gebunden vorliegen. Zu dieser Lösung wird die zu testende Substanz hinzugefügt und anschließend erhitzt.
Bei einem positiven Verlauf der Fehling-Probe, also wenn die Substanz eine Aldehydgruppe enthält oder ein reduzierender Zucker ist, verschwindet die blaue Farbe der Kupfer
-Ionen komplex gebunden vorliegen. Zu dieser Lösung wird die zu testende Substanz hinzugefügt und anschließend erhitzt.
Bei einem positiven Verlauf der Fehling-Probe, also wenn die Substanz eine Aldehydgruppe enthält oder ein reduzierender Zucker ist, verschwindet die blaue Farbe der Kupfer -Lösung allmählich und es wird ein rotbrauner Niederschlag von Kupfer
-Lösung allmählich und es wird ein rotbrauner Niederschlag von Kupfer -oxid
-oxid  gebildet.
Der entstandene rotbraune Feststoff
gebildet.
Der entstandene rotbraune Feststoff  zeigt, dass das Kupfer
zeigt, dass das Kupfer -Ion zu Kupfer
-Ion zu Kupfer -oxid reduziert wurde, was bedeutet, dass eine Reduktion durch die Oxidation einer Aldehydgruppe stattgefunden hat.
Reaktionsgleichung:
-oxid reduziert wurde, was bedeutet, dass eine Reduktion durch die Oxidation einer Aldehydgruppe stattgefunden hat.
Reaktionsgleichung:


 Nachweis von Kohlendioxid
Kohlendioxid wird durch Kalkwasser nachgewiesen. Dabei wird das zu testende Gas in eine Kalkwasserlösung (gesättigte Calciumhydroxid-Lösung) eingeleitet. Wenn Kohlendioxid in die Lösung gelangt, reagiert es mit dem Calciumhydroxid zu Calciumcarbonat und Wasser. Das entstehende Calciumcarbonat ist in Wasser schwer löslich und bildet einen weißen, feinen Niederschlag, wodurch die Lösung trüb wird.
Nachweis von Kohlendioxid
Kohlendioxid wird durch Kalkwasser nachgewiesen. Dabei wird das zu testende Gas in eine Kalkwasserlösung (gesättigte Calciumhydroxid-Lösung) eingeleitet. Wenn Kohlendioxid in die Lösung gelangt, reagiert es mit dem Calciumhydroxid zu Calciumcarbonat und Wasser. Das entstehende Calciumcarbonat ist in Wasser schwer löslich und bildet einen weißen, feinen Niederschlag, wodurch die Lösung trüb wird.


 Bei weiterem Einleiten kann das entstandene Calciumcarbonat weiter mit Kohlendioxid reagieren und sich in wasserlösliches Calciumhydrogencarbonat
Bei weiterem Einleiten kann das entstandene Calciumcarbonat weiter mit Kohlendioxid reagieren und sich in wasserlösliches Calciumhydrogencarbonat  umwandeln. Dadurch kann die Trübung wieder verschwinden und die Lösung wird wieder klar.
Hybridisierung und Bindungsverhältnisse im Kohlendioxid-Molekül
Das Kohlendioxid-Molekül ist linear aufgebaut und besteht aus einem Kohlenstoff-Atom, das über zwei Doppelbindungen mit zwei Sauerstoff-Atomen verbunden ist:
umwandeln. Dadurch kann die Trübung wieder verschwinden und die Lösung wird wieder klar.
Hybridisierung und Bindungsverhältnisse im Kohlendioxid-Molekül
Das Kohlendioxid-Molekül ist linear aufgebaut und besteht aus einem Kohlenstoff-Atom, das über zwei Doppelbindungen mit zwei Sauerstoff-Atomen verbunden ist:

Im Kohlendioxid-Molekül gibt es zwei Kohlenstoff-Sauerstoff-Doppelbindungen. Jede Doppelbindung besteht aus einer  -Bindung und einer
-Bindung und einer  -Bindung.
-Bindung.
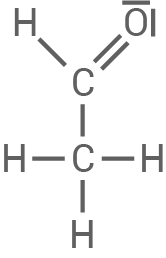
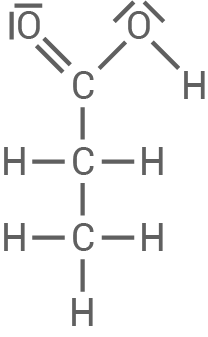
| Stoff X: | Stoff Y: |
| Reagiert positiv auf die Fehling-Probe, was darauf hinweist, dass es sich um eine Verbindung mit einer Aldehydgruppe oder einer reduzierenden Verbindung handelt, die die Fehling-Probe durch Oxidation zu einer Carbonsäure bestehen kann. In der Reaktionskette entsteht durch die Reduktion von Brenztraubensäure (Pyruvat) Ethanol. Das deutet darauf hin, dass Stoff X Acetaldehyd (Ethanal) ist, welches durch Reduktion zu Ethanol reagiert. | Reagiert sauer, was bedeutet, dass es eine Carbonsäure oder eine Substanz mit sauren Eigenschaften ist. Optisch aktiv in der L-Konfiguration, was auf eine chirale Verbindung hinweist. In Verbindung mit Brenztraubensäure kann L-Lactat (Milchsäure) gebildet werden, welches optisch aktiv ist und sauer reagiert. |
|
|
|
Ethanal (Acetalaldehyd)
|
2-Hydroxypropansäure bzw. L-Milchsäure (L-Lactat)
|
- Fehling I: eine wässrige Lösung von Kupfer
-sulfat
die eine tiefblaue Farbe aufweist.
- Fehling II: eine alkalische Lösung von Kalium-Natrium-Tartrat (Rochelle-Salz) in Natronlauge

| Das Kohlenstoff-Atom ist |
Jedes der Sauerstoff-Atome ist |
5
Erklärung der stärkeren Säure
Brenztraubensäure (Pyruvat) ist eine  -Ketosäure mit der Summenformel
-Ketosäure mit der Summenformel  Sie zeichnet sich durch eine Ketogruppe aus, die direkt an die Carboxylgruppe gebunden ist. Diese Nähe der Carbonyl- und Carboxylgruppen ermöglicht eine Mesomeriestabilisierung des Anions nach der Deprotonierung, was die Säurestärke der Brenztraubensäure erhöht. Das Anion wird durch Resonanz delokalisiert, wodurch die Elektronendichte reduziert und die Stabilität des Anions erhöht wird.
Propansäure
Sie zeichnet sich durch eine Ketogruppe aus, die direkt an die Carboxylgruppe gebunden ist. Diese Nähe der Carbonyl- und Carboxylgruppen ermöglicht eine Mesomeriestabilisierung des Anions nach der Deprotonierung, was die Säurestärke der Brenztraubensäure erhöht. Das Anion wird durch Resonanz delokalisiert, wodurch die Elektronendichte reduziert und die Stabilität des Anions erhöht wird.
Propansäure  ist eine typische Carbonsäure ohne eine stabilisierende Ketogruppe. Nach der Deprotonierung entsteht ein Propionat-Anion, das nicht mesomeriestabilisiert ist. Daher ist Propansäure eine schwächere Säure als Brenztraubensäure, da die Stabilisierung des Anions durch Resonanz fehlt.
Reaktion A
Die Reaktion folgt einer nucleophilen Addition von Wasser an Brenztraubensäure.
ist eine typische Carbonsäure ohne eine stabilisierende Ketogruppe. Nach der Deprotonierung entsteht ein Propionat-Anion, das nicht mesomeriestabilisiert ist. Daher ist Propansäure eine schwächere Säure als Brenztraubensäure, da die Stabilisierung des Anions durch Resonanz fehlt.
Reaktion A
Die Reaktion folgt einer nucleophilen Addition von Wasser an Brenztraubensäure.
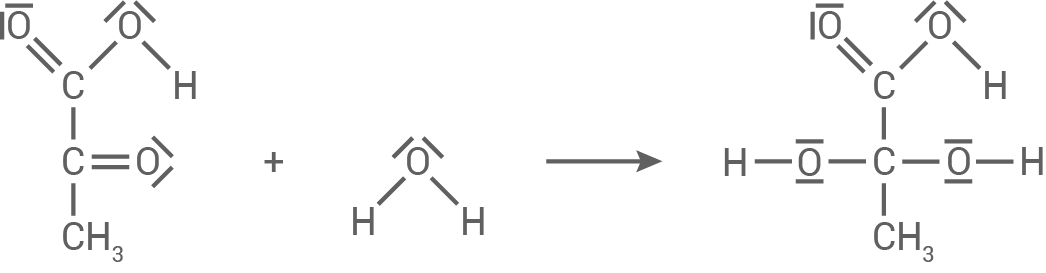 Reaktion B
Reaktion B
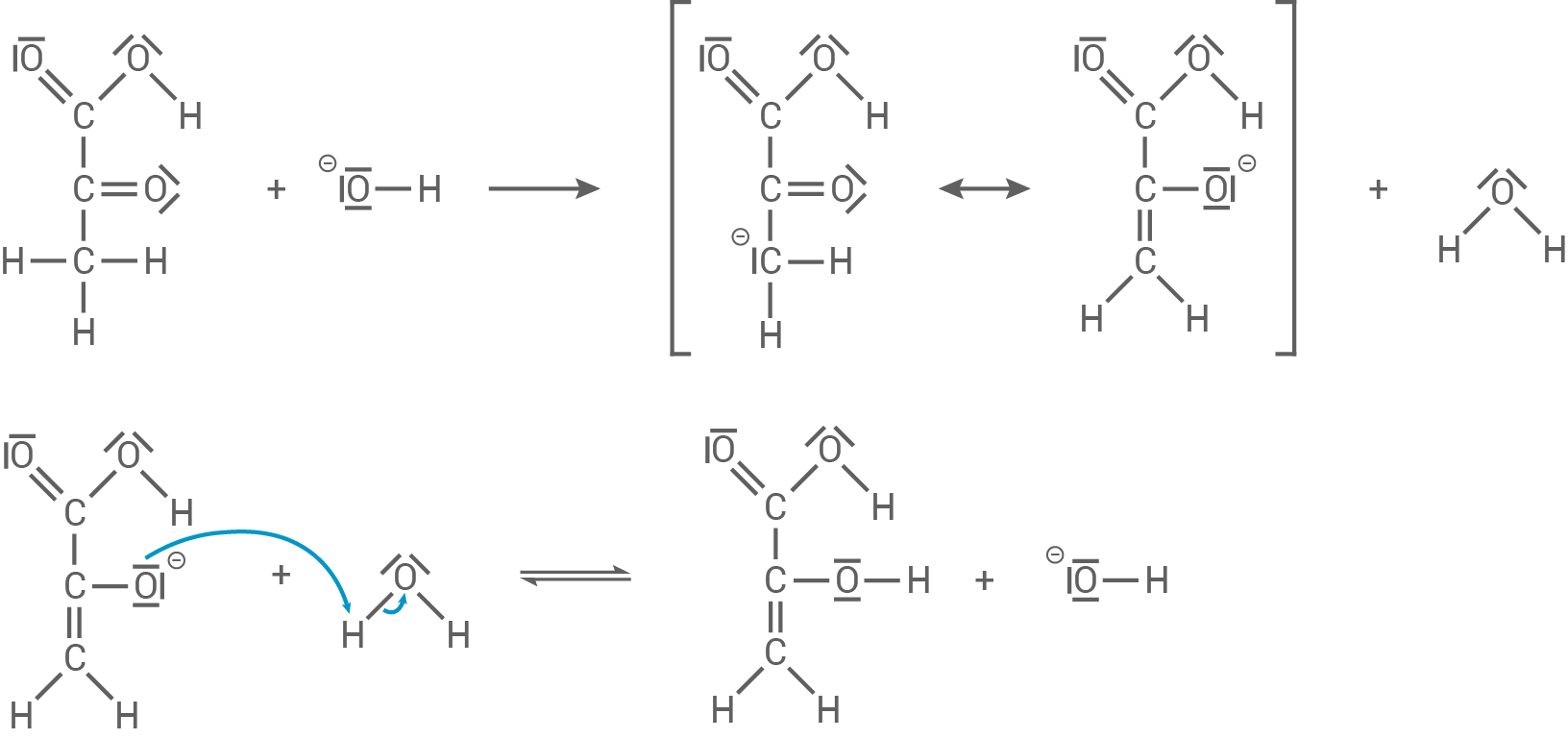 Diese Art der Umwandlung wird als Keto-Enol-Tautomerie bezeichnet, wobei sich das Gleichgewicht zwischen einer Ketoverbindung (Brenztraubensäure) und einer Enolverbindung verschiebt. Es handelt sich um eine isomere Umwandlung zwischen zwei Tautomeren, die über ein Protonen-Shift abläuft.
Diese Art der Umwandlung wird als Keto-Enol-Tautomerie bezeichnet, wobei sich das Gleichgewicht zwischen einer Ketoverbindung (Brenztraubensäure) und einer Enolverbindung verschiebt. Es handelt sich um eine isomere Umwandlung zwischen zwei Tautomeren, die über ein Protonen-Shift abläuft.


6
Stereoisomere von Butan-1,2,3,4-tetrol
Butan-1,2,3,4-tetrol hat vier Kohlenstoff-Atome, von denen  und
und  chiral sind, da sie jeweils vier unterschiedliche Substituenten tragen (eine Hydroxylgruppe, ein Wasserstoff-Atom, sowie zwei verschiedene Kohlenstoffreste). Da es zwei chirale Zentren gibt, sind nach der Regel
chiral sind, da sie jeweils vier unterschiedliche Substituenten tragen (eine Hydroxylgruppe, ein Wasserstoff-Atom, sowie zwei verschiedene Kohlenstoffreste). Da es zwei chirale Zentren gibt, sind nach der Regel  (wobei
(wobei  die Anzahl der chiralen Zentren ist) vier mögliche Stereoisomere von Butan-1,2,3,4-tetrol möglich.
Da es sich jedoch um eine Meso-Verbindung handelt, besitzt die Verbindung eine innere Spiegelebene. Die beiden chiralitätsbestimmenden Zentren gleichen sich hierbei gegenseitig aus, sodass das Molekül insgesamt achiral ist.
Mögliche Stereoisomere sind daher:
die Anzahl der chiralen Zentren ist) vier mögliche Stereoisomere von Butan-1,2,3,4-tetrol möglich.
Da es sich jedoch um eine Meso-Verbindung handelt, besitzt die Verbindung eine innere Spiegelebene. Die beiden chiralitätsbestimmenden Zentren gleichen sich hierbei gegenseitig aus, sodass das Molekül insgesamt achiral ist.
Mögliche Stereoisomere sind daher:
Richtigkeit der unterschiedlichen Aussagen
Praktikant A behauptet, dass es vier Stereoisomere gibt, während Praktikant B dem widerspricht und erklärt, dass nur drei Stereoisomere existieren.
Praktikant A hat zwar recht damit, dass es bei zwei asymmetrischen Kohlenstoff-Atomen gemäß der Formel
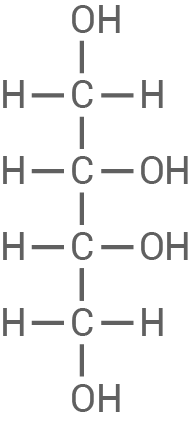
(2R, 3R): Beide Hydroxylgruppen an den chiralen Zentren sind rechts
|
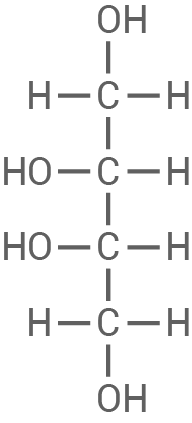
(2S, 3S): Beide Hydroxylgruppen an den chiralen Zentren sind links
|
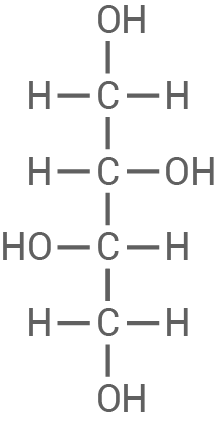
(2R, 3S) oder (2S, 3R): Dies ist dasselbe Molekül aufgrund der Symmetrie des Moleküls
|