Aufgabe 4 – Dickdarmkrebs
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Aufgabe 4, M 1: Entstehung von Onkogenen
Ein Proto-Onkogen ist ein Gen, das durch Mutation oder erhöhte Expression zu einem Onkogen werden kann (Abb. 1). Proto-Onkogene kodieren v. a. für Proteine, die am Zellwachstum, der Zellvermehrung und/oder der Zellspezialisierung beteiligt sind.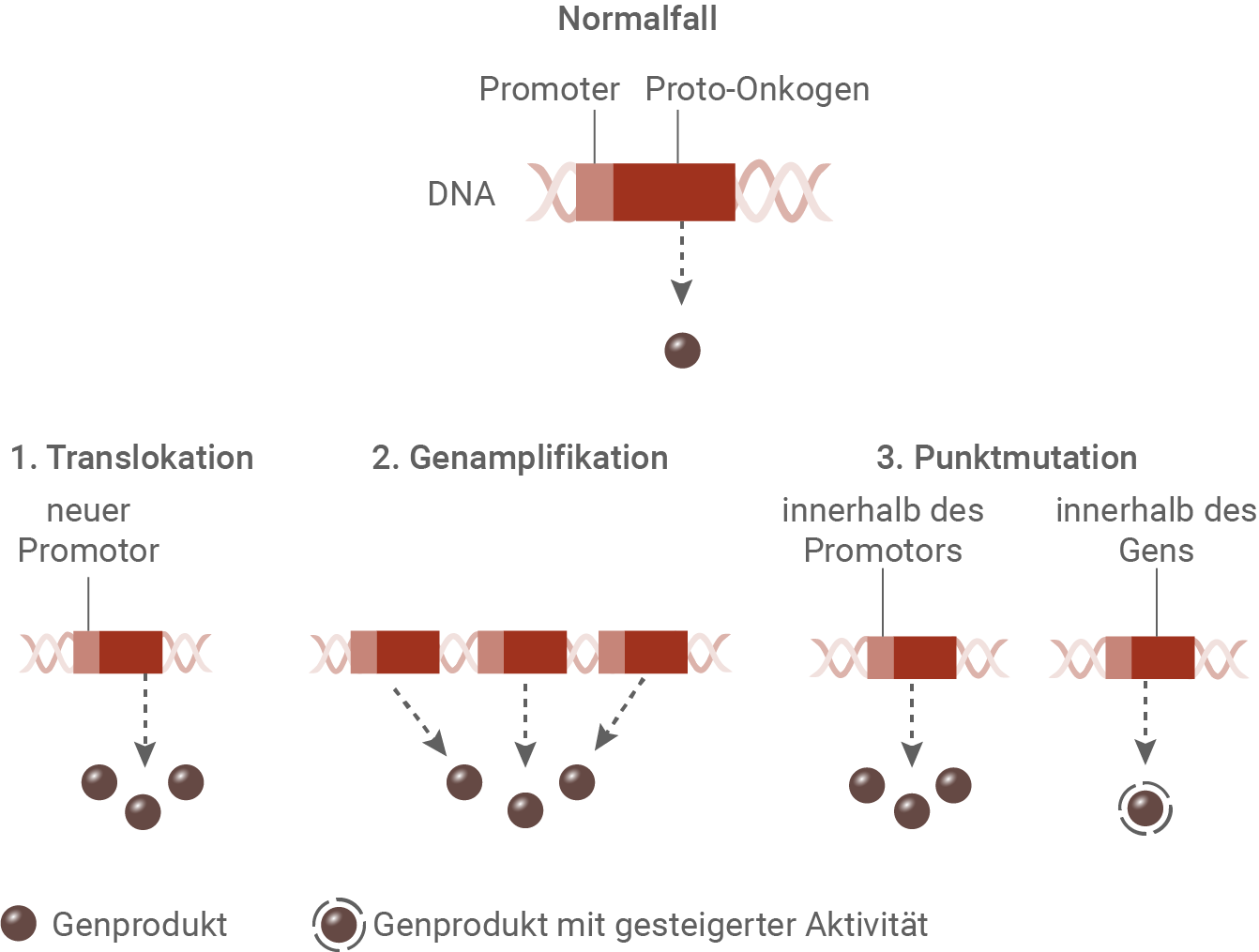
Aufgabe 4, M 2: Der Wnt-Signalweg
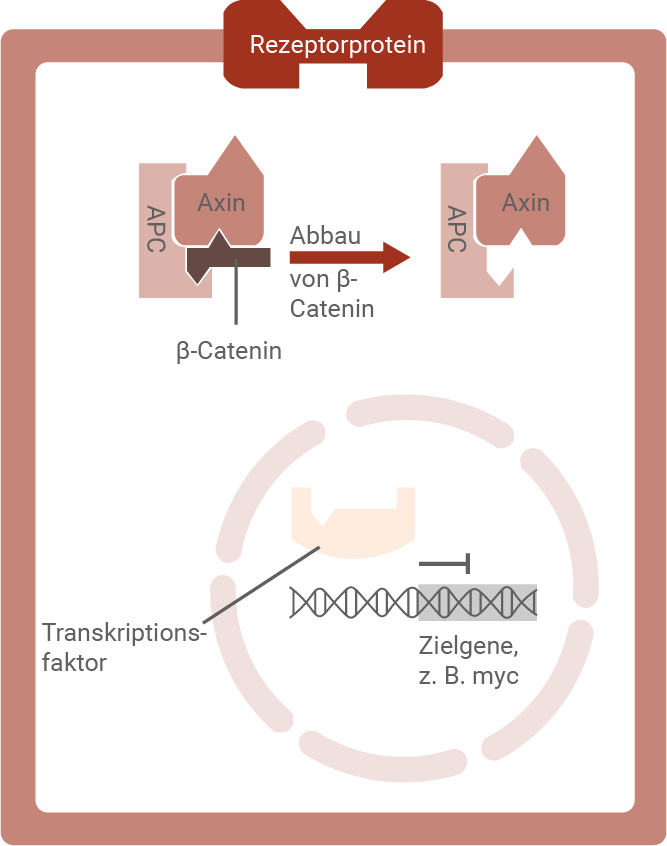
Der Wnt-Signalweg ist ein biochemischer Signalweg, der mit dem extrazellulären Wnt-Protein beginnt (Abb. 1). Es löst in der Zelle Reaktionen aus, die einen wichtigen Einfluss auf Zellwachstum, Zellvermehrung und Zellspezialisierung haben. Beispielsweise führt das Signalprotein Wnt dazu, dass Zellen sich wie Stammzellen verhalten, d. h. teilungsaktiv bleiben. Ein Mangel oder die Abwesenheit des Wnt-Proteins hingegen lösen die Zellspezialisierung aus, z. B. zu einer ausgereiften Darmzelle. Auch bei Dickdarmkrebs scheint der Wnt-Signalweg eine Rolle zu spielen. Dickdarmkrebs entsteht vor allem durch Genmutationen in den Zellen der Darmschleimhaut. Häufig liegt dabei eine Mutation des APC-Gens vor. Das APC-Gen kodiert für das APC-Protein, das im Wnt-Signalweg gemeinsam mit Axin am Abbau vonin Anlehnung an: Schoen, S. (2014). TNFRSF19 als Zielgen des Wnt/ß-Catenin-Signalweges im kolorektalen Karzinom. Dissertation LMU München. https://edoc.ub.uni-muenchen.de/17214/1/Schoen_Simon.pdf (Zugriff am: 24.01.2024)
Aufgabe 4, M 3: Therapie bei Dickdarmkrebs
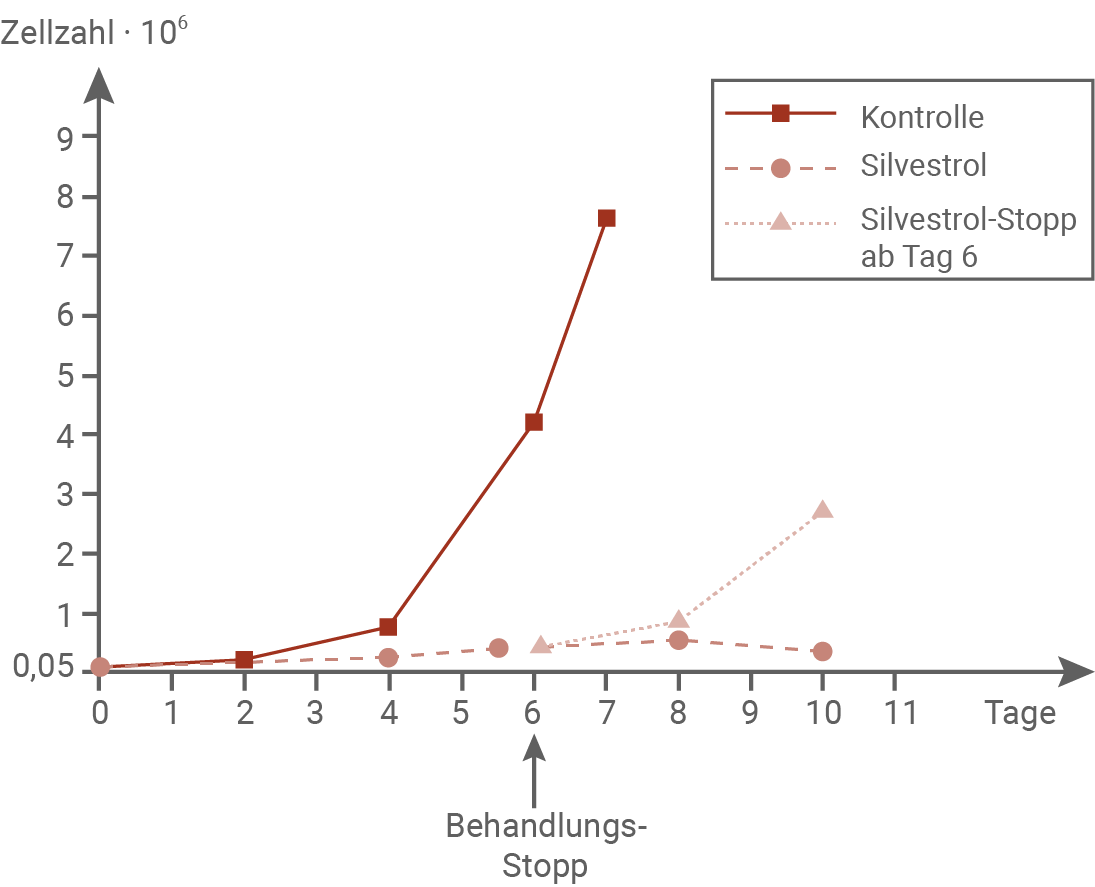
Auf der Suche nach Wegen, das Tumorwachstum zu stoppen, scheint der Naturstoff Silvestrol aus dem tropischen Mahagonibaum Aglaia foveolata eine vielversprechende medizinische Wirksubstanz zu sein. Der Naturstoff kann aus der Borke dieser seltenen Mahagoniart gewonnen werden. Er ist in den Bäumen jedoch nur in sehr kleinen Mengen vorhanden, weshalb ein kommerzieller Anbau nicht ökonomisch gewinnbringend ist. Der Baum steht auf der Roten Liste der vom Aussterben bedrohten Arten, weil sein natürlicher Lebensraum durch Landnutzung immer weiter reduziert wird. Silvestrol kann chemisch synthetisiert werden, jedoch sind diese chemischen Reaktionen so komplex, dass sie nicht in einem großen Maßstab durchgeführt werden. Silvestrol hemmt spezifisch ein Enzym, das eine wichtige Rolle bei der Translation der myc-mRNA spielt. Einige Proto-Onkogene benötigen dieses Enzym für die Translation ihrer mRNA.verändert nach: Pan, L. et al. (2014). Rocaglamide, Silvestrol and Structurally Related Bioactive Compounds from Aglaia Species. Nat Prod Rep, 31(7), p. 924-939. doi:10.1039/c4np00006d.
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Es gibt verschiedene genetische Veränderungen, die zur Entstehung von Krebs beitragen können, indem sie die Aktivität von Proto-Onkogenen erhöhen.
- Translokation: Wird ein Proto-Onkogen durch eine Chromosomenumlagerung (Translokation) hinter einen besonders aktiven Promotor verschoben, führt dies zu einer vermehrten Transkription des Gens. Infolgedessen steigt die Menge des Genprodukts an, was das Zellwachstum fördern kann.
- Genamplifikation: Bei einer Genamplifikation werden bestimmte Proto-Onkogene vervielfacht, sodass zusätzliche Genkopien im Genom vorliegen. Dadurch entsteht mehr mRNA und infolgedessen auch mehr Protein, was zu einer Überproduktion des Genprodukts führt.
- Punktmutation: Eine einzelne Basenveränderung (Punktmutation) kann ebenfalls die Genaktivität beeinflussen. Erfolgt die Mutation in einem Kontrollelement des Gens, wird die Genexpression gesteigert, wodurch die Menge des Genprodukts zunimmt. Befindet sich die Mutation hingegen im codierenden Bereich des Proto-Onkogens, kann dies dazu führen, dass das entstehende Protein eine höhere oder dauerhafte Aktivität besitzt – auch ohne äußere Aktivierungssignale.
Diese Mechanismen können gemeinsam oder einzeln dazu führen, dass aus einem regulierten Proto-Onkogen ein krebsförderndes Onkogen wird.
In Abwesenheit von Wnt ist das Protein β-Catenin im Zellinneren nicht stabil. Es wird von einem intrazellulären Proteinverbund, bestehend aus Axin und APC (Adenomatous Polyposis Coli), gebunden und in der Folge abgebaut. Dadurch ist kein β-Catenin in der Zelle vorhanden, um als Co-Aktivator zu wirken. Der Transkriptionsfaktor, der normalerweise zusammen mit β-Catenin die Expression des myc-Gens aktiviert, bleibt inaktiv. Es erfolgt somit keine Transkription des Zielgens.
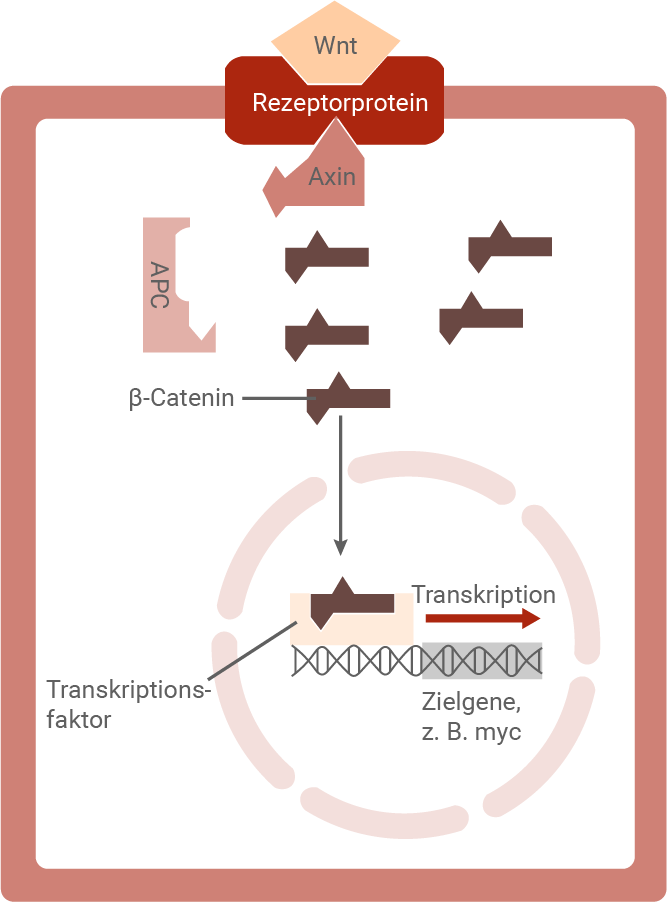
Ist Wnt jedoch vorhanden, bindet es an ein Rezeptorprotein auf der Zelloberfläche. Dies führt zu einer Konformationsänderung des Rezeptors, wodurch Axin an den Rezeptor gebunden wird. Diese Bindung verändert wiederum die Struktur von Axin so, dass β-Catenin nicht mehr daran binden kann. Infolgedessen wird β-Catenin nicht mehr abgebaut, sondern reichert sich im Zytoplasma an und gelangt schließlich in den Zellkern. Dort bindet β-Catenin an einen Transkriptionsfaktor im Promotorbereich des Zielgens, wodurch die Transkription – z. B. des myc-Gens – eingeleitet wird.
Dieser Mechanismus zeigt, wie Zellen mithilfe des Wnt-Signalwegs gezielt Gene aktivieren können, z. B. im Rahmen von Zellwachstum oder Entwicklung.
Eine Mutation im APC-Gen führt zur Bildung eines veränderten APC-Proteins, das seine normale Funktion im Wnt-Signalweg nicht mehr erfüllen kann. Durch die Konformationsänderung des APC-Proteins kann entweder das Gerüstprotein Axin nicht mehr binden oder die Bindungsstelle für β-Catenin ist gestört. In beiden Fällen kann der Proteinkomplex, der normalerweise β-Catenin erkennt und abbaut, nicht mehr korrekt gebildet werden.
Obwohl kein Wnt an das Rezeptorprotein gebunden ist, wird β-Catenin infolgedessen nicht mehr abgebaut. Es reichert sich in der Zelle an, wandert in den Zellkern und bindet dort an einen Transkriptionsfaktor im Promotorbereich des Myc-Gens. Dadurch wird die Transkription dieses Gens aktiviert, und das Myc-Protein – ein Wachstumsregulator – wird in übermäßiger Menge gebildet.
Die Folge ist eine unkontrollierte Zellvermehrung, da die Regulation durch den Wnt-Signalweg fehlt. Dies kann zur Entstehung eines Tumors führen, wie es beispielsweise bei bestimmten Formen von Darmkrebs der Fall ist.
Silvestrol zeigt vielversprechende Eigenschaften als potenzielles Krebsmedikament, da es gezielt das Wachstum von Tumorzellen hemmt und gesunde Zellen weitgehend verschont. Dieser spezifische Wirkmechanismus ist ein großer Vorteil gegenüber vielen herkömmlichen Chemotherapeutika, die häufig auch gesunde Zellen schädigen. Die selektive Wirkung spricht daher grundsätzlich für ein hohes Einsatzpotenzial.
Dem gegenüber stehen jedoch wesentliche Einschränkungen: Die Herstellung und Gewinnung von Silvestrol ist aktuell weder in großem Maßstab möglich noch wirtschaftlich tragfähig. Es muss kontinuierlich verabreicht werden, da die Tumorzellen nach Therapieende wieder zunehmen, was den Bedarf zusätzlich erhöht. Hinzu kommt, dass Silvestrol aus der Borke eines bereits gefährdeten Baums gewonnen wird – dies stellt ein ökologisches Risiko dar und macht eine nachhaltige Nutzung kaum möglich.
Trotz seiner hohen Wirksamkeit besitzt Silvestrol nur ein eingeschränktes Einsatzpotenzial. Die limitierten Ressourcen, die aufwendige Herstellung sowie ökologische und wirtschaftliche Hürden schränken den breiten therapeutischen Einsatz erheblich ein.