Vorschlag C – Bodenbeläge aus PVC und Kork
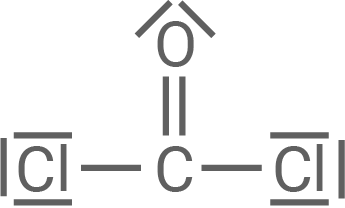
PVC (Polyvinylchlorid, Material 2) ist ein vielseitiger und preiswerter Kunststoff, der häufig als Fußbodenbelag eingesetzt wird. Es gibt Hart-PVC sowie das biegsamere Weich-PVC, das aus sogenannten Copolymeren bestehen kann. Polyvinylchlorid ist allerdings in die Kritik gekommen, da beispielsweise bei der Verbrennung zahlreiche giftige Stoffe freigesetzt werden. Ein mögliches Verbrennungsprodukt ist das Gas Phosgen (Material 4). Atmet man Phosgen ein, reagiert es mit der Feuchtigkeit in den Lungen zu Kohlenstoffdioxid und Chlorwasserstoff.
Als Alternative zu PVC kommen verschiedene andere Materialien als Bodenbeläge in Frage, unter anderem das Naturprodukt Kork. Dieser Naturstoff enthält zahlreiche verschiedene Substanzen wie zum Beispiel Cellulose und Polyester, die aus verschiedenen Hydroxydicarbonsäuren aufgebaut sind.
Ethen reagiert mit Chlor in einer elektrophilen Addition zu einem Zwischenprodukt. Schritt 2:
Das in Schritt 1 entstandene Zwischenprodukt wird unter bestimmten Bedingungen erhitzt, dabei bilden sich Chlorethen (Vinylchlorid) sowie ein gasförmiges anorganisches Produkt. Leitet man dieses Gas in wässrige Silbernitratlösung ein, entsteht ein weißer, milchiger Niederschlag. Schritt 3:
Das in Schritt 2 entstandene Chlorethen (Vinylchlorid) reagiert mithilfe eines Peroxids als Radikalstarter zum Polyvinylchlorid (PVC, Material 2).
als Radikalstarter zum Polyvinylchlorid (PVC, Material 2).
3.1
Die mehrstufige Synthese von PVC (Polyvinylchlorid) ist in Material 1 dargestellt.
Gib in Strukturformeln die Reaktionsgleichung der Reaktion von Schritt 1 an.
Formuliere in Strukturformeln die Reaktionsgleichung für die Reaktion des Zwischenprodukts aus Schritt 1 der Synthese zu Chlorethen (Schritt 2).
Erläutere die Nachweisreaktion in Schritt 2.
(8 BE)
3.2
Formuliere und benenne für den dritten Schritt aus Material 1 den vollständigen, zugehörigen Reaktionsmechanismus. Verknüpfe dabei drei Monomere.
Erläutere die dabei ablaufenden Teilschritte.
(10 BE)
3.3
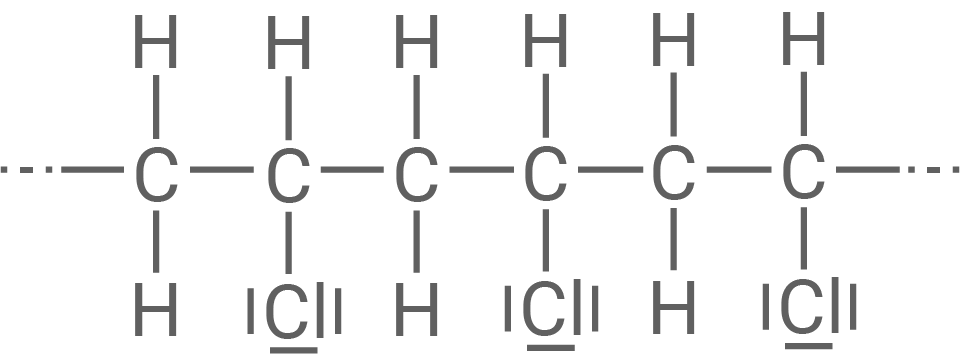
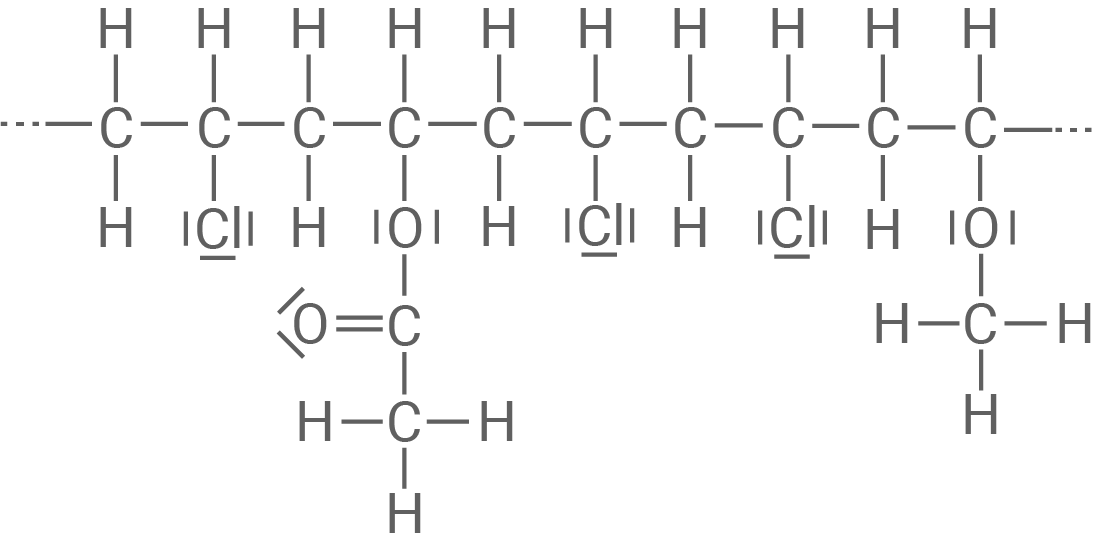
Das in Material 2 gezeigte PVC ist steifer, während das in Material 3 gezeigte sogenannte PVC-Copolymer weicher und biegsamer ist. Für die Herstellung dieses Copolymeren werden neben Chlorethen zwei weitere Monomere als Edukte verwendet.
Ermittle die Strukturformeln der beiden weiteren Edukte, aus denen das in Material 3 dargestellte Copolymer hergestellt wird.
Erkläre mit Hilfe von Material 2 das Verhalten von Hart-PVC beim Erwärmen.
Begründe unter Bezug auf Material 2 und 3 die unterschiedlichen Eigenschaften des PVC-Copolymeren im Vergleich zu Hart-PVC.
(10 BE)
3.4
Bei der Verbrennung von PVC kann unter anderem auch das in Material 4 dargestellte Reaktionsprodukt Phosgen entstehen. Kommt Phosgen in Kontakt mit Wasser, reagieren beide Stoffe zu Kohlenstoffdioxid und Chlorwasserstoff. Chlorwasserstoff bildet seinerseits mit Wasser eine stark ätzende Lösung.
Gib die Reaktionsgleichung für die Reaktion von Phosgen mit Wasser zu Kohlenstoffdioxid und Chlorwasserstoff an.
Erläutere, auch mithilfe einer Reaktionsgleichung, die Bildung der stark ätzenden Lösung und begründe, ob es sich bei dieser Reaktion um eine Gleichgewichtsreaktion handelt.
Berechne den pH-Wert einer Lösung, wenn  Chlorwasserstoff in
Chlorwasserstoff in  Wasser eingeleitet werden.
Wasser eingeleitet werden.
(12 BE)
3.5
Die im Kork chemisch gebundenen Hydroxydicarbonsäuren sind unterschiedlich aufgebaut.
Zeichne die Strukturformel einer beliebigen Octandisäure mit drei Hydroxy-Gruppen als Substituenten. Benenne das von dir gezeichnete Molekül.
Erkläre die Entstehung eines duroplastischen Polyesters aus dem von Ihnen gezeichneten Octandisäure-Abkömmling.
(5 BE)
3.6
Zeichne einen Molekülausschnitt der ebenfalls im Kork enthaltenen Cellulose, in dem vier Monomer-Einheiten miteinander verknüpft sind.
Benenne die Monomere, aus denen die Cellulose gebildet wird, sowie die Art der glykosidischen Bindung.
(5 BE)
(50 BE)
Material 1
Mehrstufige Synthese von PVC (Polyvinylchlorid)
Schritt 1:Ethen reagiert mit Chlor in einer elektrophilen Addition zu einem Zwischenprodukt. Schritt 2:
Das in Schritt 1 entstandene Zwischenprodukt wird unter bestimmten Bedingungen erhitzt, dabei bilden sich Chlorethen (Vinylchlorid) sowie ein gasförmiges anorganisches Produkt. Leitet man dieses Gas in wässrige Silbernitratlösung ein, entsteht ein weißer, milchiger Niederschlag. Schritt 3:
Das in Schritt 2 entstandene Chlorethen (Vinylchlorid) reagiert mithilfe eines Peroxids
Material 2
Strukturformelausschnitt eines Hart-PVC-Makromoleküls

Material 3
Strukturformelausschnitt eines PVC-Copolymer-Makromoleküls

Material 4
Phosgen

3.1
Reaktionsgleichungen
Schritt 1:
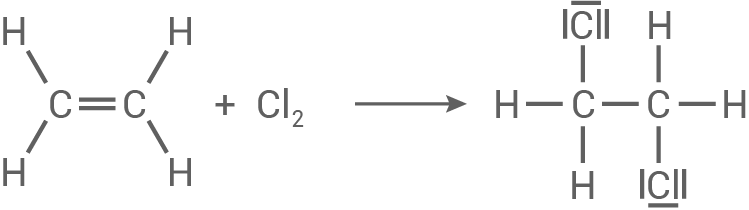 Schritt 2:
Schritt 2:
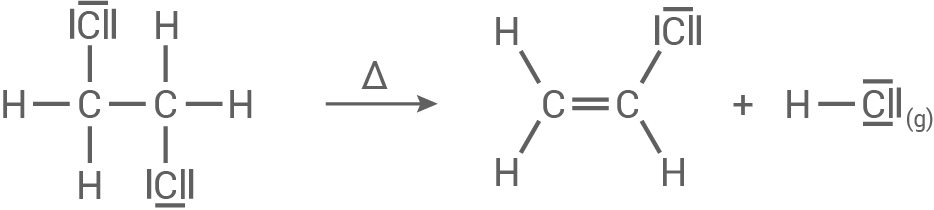 Nachweisreaktion
Nachweisreaktion
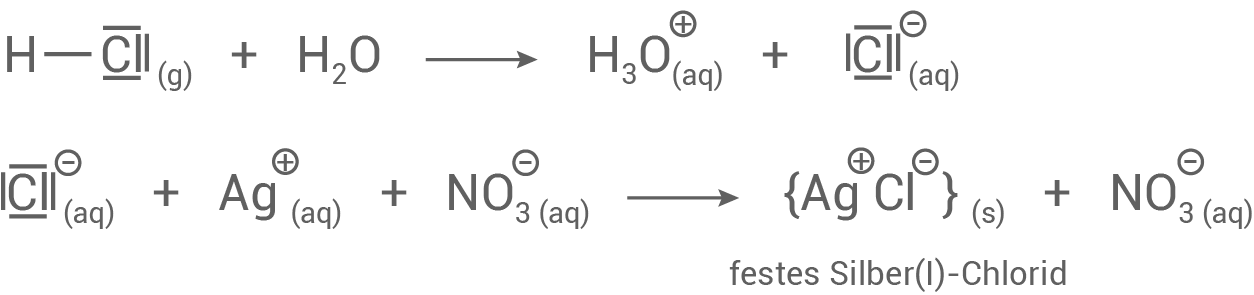
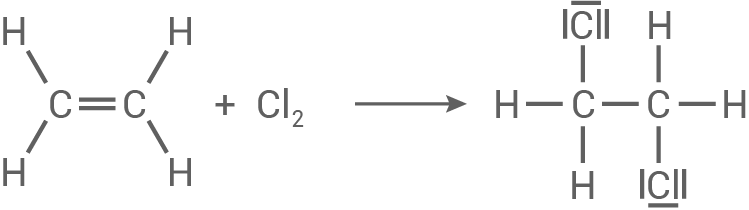


- Wird das gasförmige anorganische Produkt aus Schritt 2 in eine wässrige Silbernitratlösung eingeleitet, entsteht ein weißer, milchiger Niederschlag. Dieser weist auf die Bildung von Chlorwasserstoff hin.
- Bei dieser Reaktion entstehen Chlorid-Ionen, die für die milchige Trübung verantwortlich sind.
- Darauffolgend bildet sich Silber
-Chlorid, welches den weißen, festen, schwer löslichen Niederschlag bildet.
3.2
Vollständiger Reaktionsmechanismus
Die Reaktion in Schritt 3 beschreibt die radikalische Polymerisation von Vinylchlorid (Chlorethen).
Bildung des Startradikals: (homolytische Spaltung)
 Zu Beginn entsteht durch eine homolytische Spaltung des Peroxids ein Starterradikal.
Kettenstart:
Zu Beginn entsteht durch eine homolytische Spaltung des Peroxids ein Starterradikal.
Kettenstart:
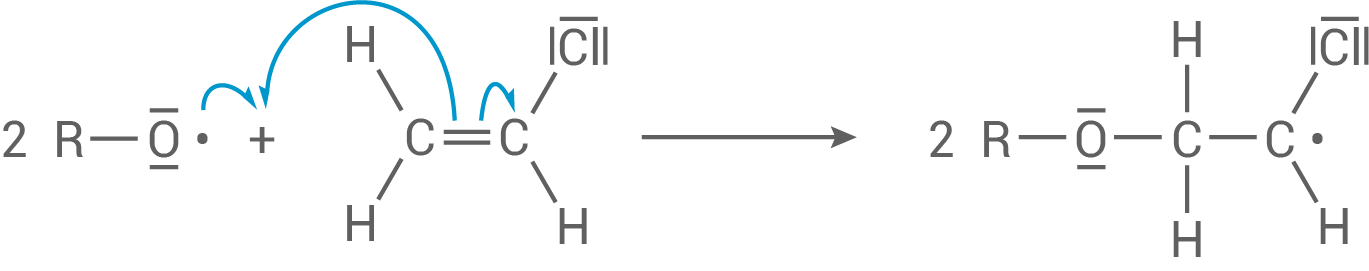 Im nächsten Schritt reagieren das entstandene Startradikal und ein Chlorethen-Monomer miteinander, wobei eine Bindung zwischen den beiden
Im nächsten Schritt reagieren das entstandene Startradikal und ein Chlorethen-Monomer miteinander, wobei eine Bindung zwischen den beiden  -Atomen der Doppelbindung homolytisch gespalten wird. Es entsteht ein neues Radikal mit einem ungepaarten Elektron, welches nun weitere Monomere angreifen kann.
Kettenfortpflanzung:
-Atomen der Doppelbindung homolytisch gespalten wird. Es entsteht ein neues Radikal mit einem ungepaarten Elektron, welches nun weitere Monomere angreifen kann.
Kettenfortpflanzung:
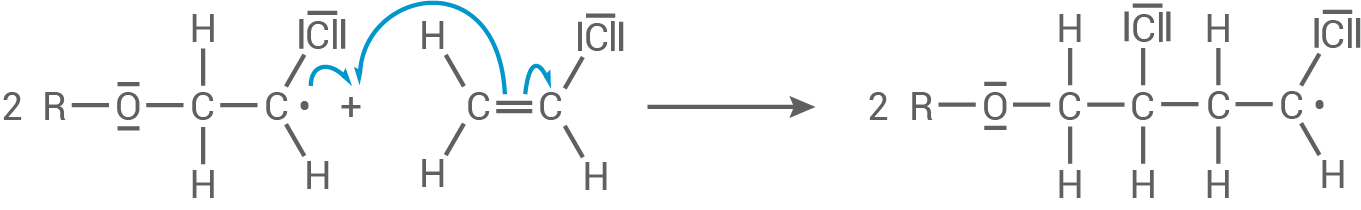
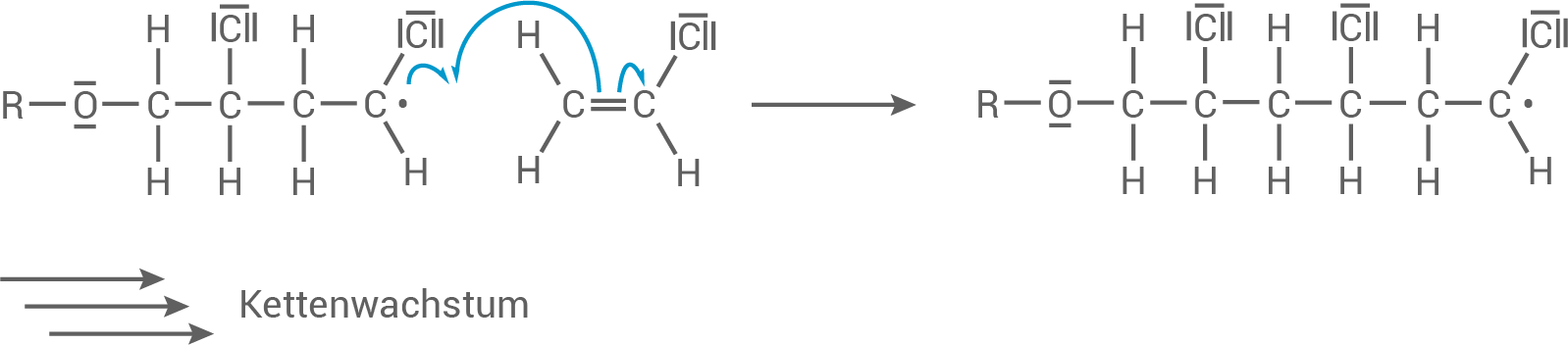 Das Radikal greift weitere Monomere an und es bildet sich ein langes, radikalisches Ketten-Molekül.
Kettenabbruch:
Das Radikal greift weitere Monomere an und es bildet sich ein langes, radikalisches Ketten-Molekül.
Kettenabbruch:
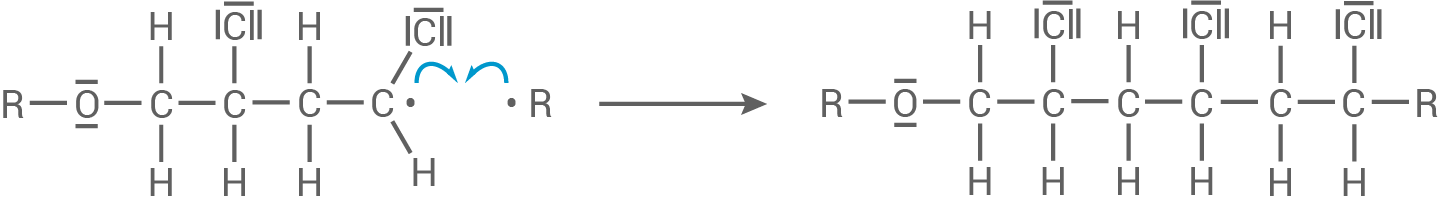 Die wachsende Kette bricht ab, sobald zwei Radikale miteinander reagieren.
Die wachsende Kette bricht ab, sobald zwei Radikale miteinander reagieren.


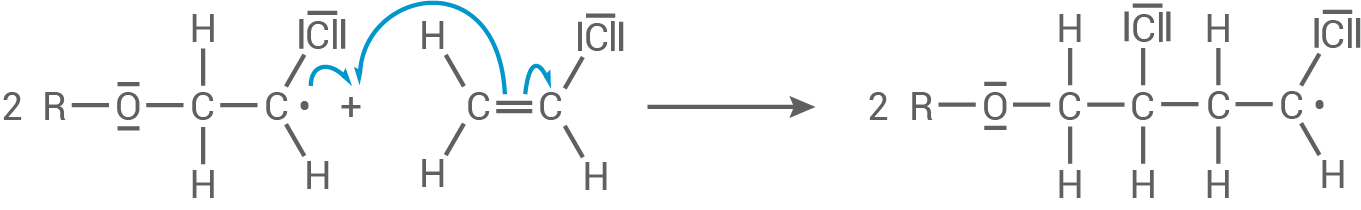


3.3
Strukturformeln der beiden Edukte
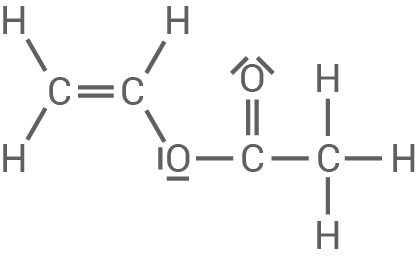
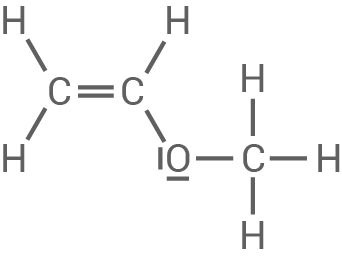 Verhalten von Hart-PVC beim Erwärmen
Verhalten von Hart-PVC beim Erwärmen


- Der Strukturformelausschnitt von Hart-PVC aus Material 2 zeigt eine lineare, unverzweigte und unvernetzte Polymerkette.
- Diese Struktur ist charakteristisch für einen Thermoplasten.
- Beim Erwärmen wird dieser Thermoplast demnach langsam weich und verformbar und schmilzt schließlich.
- Das liegt daran, dass mit der Erhöhung der Temperatur durch stärkere Bewegungen immer mehr zwischenmolekulare Kräfte überwunden werden.
- Die Polymerketten lassen sich schließlich gegeneinander verschieben, gleiten aneinander vorbei und der Kunststoff schmilzt.
- Hart-PVC besitzt lineare und unverzweigte Strukturen, wodurch große Bereiche eine regelmäßige Anordnung und eng beieinander liegende Polymerketten zeigen.
- Damit wird eine bestmögliche Ausbildung von zwischenmolekularen Kräften gewährleistet und es wirken sowohl VAN-DER-WAALS-Kräfte als auch Dipol-Dipol-Wechselwirkungen.
- Daraus resultiert ein harter, spröder Kunststoff.
- Die Struktur des dargestellten Copolymers ist zwar auch linear und unverzweigt, jedoch sind hier Ethenderivate eingebaut, die zu sperrigen Seitengruppen führen.
- Eine enge, regelmäßige Anordnung der Polymerketten so wie bei Hart-PVC ist hier also nicht möglich.
- Folglich wirken zwischen den Polymerketten auch weniger Kräfte.
- Dies führt zu einem biegsamen Kunststoff, der nicht spröder ist.
3.4
Reaktionsgleichung
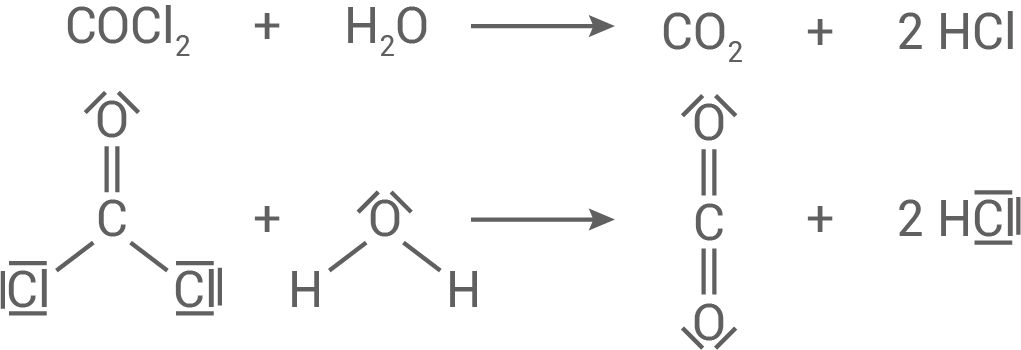 Bildung der stark ätzenden Lösung
Reagiert das bei der Reaktion entstandene Chlorwasserstoff weiter mit Wasser, werden
Bildung der stark ätzenden Lösung
Reagiert das bei der Reaktion entstandene Chlorwasserstoff weiter mit Wasser, werden  -Ionen (Oxonium-Ionen) gebildet, die die beschriebene ätzende Wirkung hervorrufen:
-Ionen (Oxonium-Ionen) gebildet, die die beschriebene ätzende Wirkung hervorrufen:
 Die Reaktion lässt sich als Gleichgewichtsreaktion identifizieren, da Chlorwasserstoff
Die Reaktion lässt sich als Gleichgewichtsreaktion identifizieren, da Chlorwasserstoff  als starke Säure vollständig in Wasser dissoziiert. Wie der Reaktionspfeil jedoch zeigt, liegt das Gleichgewicht bei Raumtemperatur komplett auf Produktseite.
Berechnung des pH-Werts
Aus den gegebenen Werten lässt sich zunächst die Konzentration berechnen:
als starke Säure vollständig in Wasser dissoziiert. Wie der Reaktionspfeil jedoch zeigt, liegt das Gleichgewicht bei Raumtemperatur komplett auf Produktseite.
Berechnung des pH-Werts
Aus den gegebenen Werten lässt sich zunächst die Konzentration berechnen:
![\(\begin{array}[t]{rll}
c&=& \dfrac{n}{V}& \\[5pt]
&=& \dfrac{m }{M \cdot V}& \\[5pt]
&=& \dfrac{0,025 \,\text{g}}{36,45\,\text{g} \cdot \text{mol}^{-1} \cdot 0,2 \,\text{L}} & \\[5pt]
&\approx& 0,0034 \,\text{mol} \cdot \text{L}^{-1}
\end{array}\)](https://www.schullv.de/resources/formulas/9971ffc0ed43a94861d00eb4e4d772e576aeb977b1a9295dfecdbe2cfeb0df3f_light.svg) Da es sich um eine starke Säure handelt, gilt folgende Annahme:
Da es sich um eine starke Säure handelt, gilt folgende Annahme:
![\(\begin{array}[t]{rll}
c (HA)&=& c(H_3O^+) & \\[10pt]
pH&=& - \lg c(H_3O^+) & \\[5pt]
&=& -\lg c(HA) & \\[5pt]
&=& -\lg (0,0034) & \\[5pt]
&\approx& 2,47
\end{array}\)](https://www.schullv.de/resources/formulas/e117f6b3607c781408937e6344926815feef830561fdd6ef6c39c13c8c979cc3_light.svg) Damit hat die Lösung einen pH-Wert von
Damit hat die Lösung einen pH-Wert von 

Reaktion von Phosgen mit Wasser zu Kohlenstoffdioxid und Chlorwasserstoff

3.5
Strukturformel einer Octandisäure und Benennung
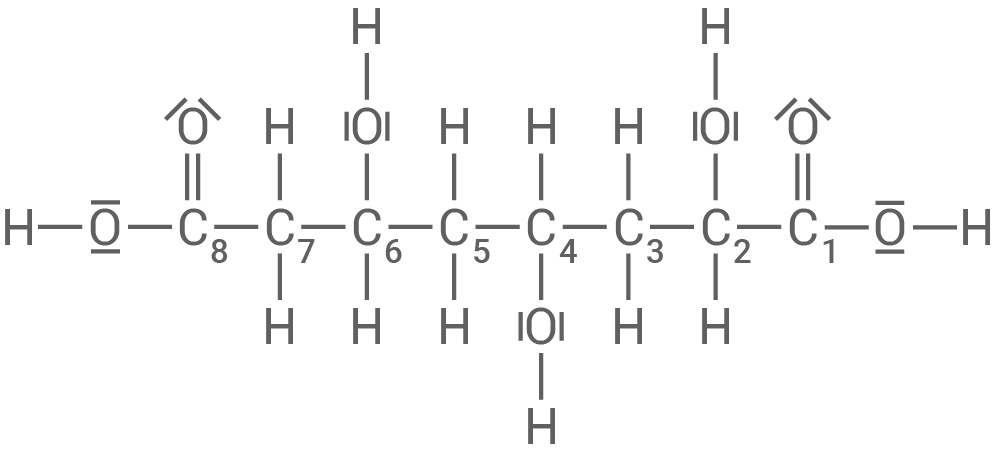 Entstehung eines duroplastischen Polyesters
Entstehung eines duroplastischen Polyesters
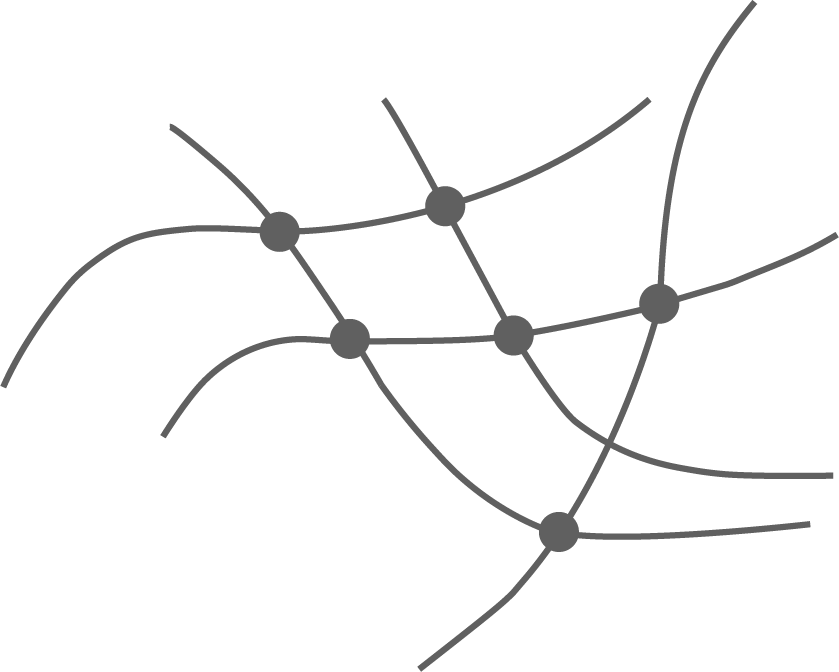

2,4,6-Trihydroxyoctandisäure
- Die Struktur der Trihydroxyocandisäure zeigt drei Hydroxygruppen und zwei Carboxylgruppen.
- Durch diese ist es den Molekülen möglich, untereinander zu reagieren und ein eng vernetztes Polymer zu bilden.
- So eine stark vernetzte Struktur ist charakteristisch für einen duroplastischen Kunststoff.

3.6
Molekülausschnitt der Cellulose
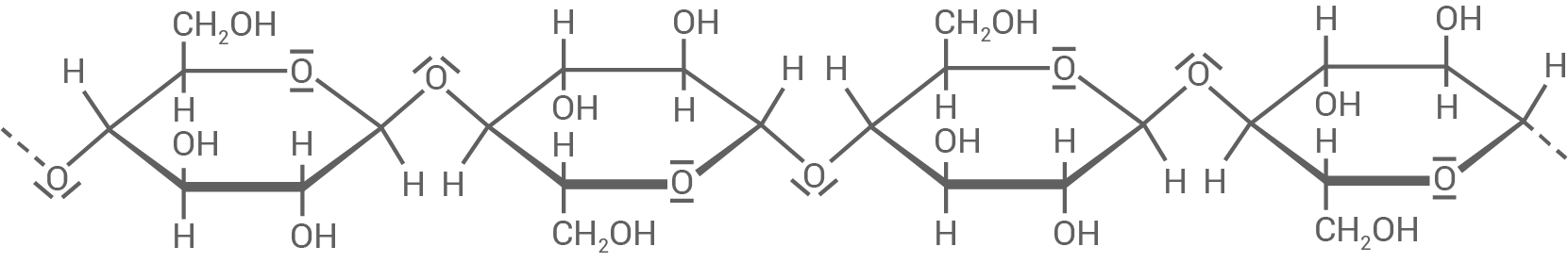

- Cellulose wird aus
-D-Glucose gebildet.
- Die Monomere sind
-1,4-glycosidisch miteinander verknüpft.