Vorschlag A – Alles Essig...
Ethansäure (Essigsäure) ist eine wichtige Chemikalie und kann auf unterschiedlichen Wegen hergestellt werden.
Hauptsächlich wird Ethansäure aus Methanol und Kohlenstoffmonooxid hergestellt. Diese Synthese erfolgt über den sogenannten Monsanto-Prozess, ein von der Firma BASF entwickeltes Verfahren (Material 1).
Ethansäure kann auch aus Sauerstoff und Butan hergestellt werden.
Im Haushalt wird Ethansäure in verdünnter Form als Speiseessig verwendet. Speiseessig enthält meistens einen Ethansäure-Gehalt von
entwickeltes Verfahren (Material 1).
Ethansäure kann auch aus Sauerstoff und Butan hergestellt werden.
Im Haushalt wird Ethansäure in verdünnter Form als Speiseessig verwendet. Speiseessig enthält meistens einen Ethansäure-Gehalt von  in
in  Wasser. Er kommt ohne weitere chemische Zusätze aus und hat wertvolle Inhaltsstoffe, unter anderem weitere Fruchtsäuren wie z. B. Weinsäure (2,3-Dihydroxybutandisäure).
Wasser. Er kommt ohne weitere chemische Zusätze aus und hat wertvolle Inhaltsstoffe, unter anderem weitere Fruchtsäuren wie z. B. Weinsäure (2,3-Dihydroxybutandisäure).
 eines handelsüblichen Speiseessigs enthalten
eines handelsüblichen Speiseessigs enthalten  reine Ethansäure. Der
reine Ethansäure. Der  -Wert dieses Essigs wurde mit
-Wert dieses Essigs wurde mit  bestimmt.
Berechne die Stoffmengen-Konzentration an Ethansäure in diesem Speiseessig.
Berechne die Stoffmengen-Konzentration an
bestimmt.
Berechne die Stoffmengen-Konzentration an Ethansäure in diesem Speiseessig.
Berechne die Stoffmengen-Konzentration an  - und
- und  -Ionen für diesen Speiseessig.
-Ionen für diesen Speiseessig.
 entwickeltes Verfahren hergestellt werden, den sogenannten Monsanto-Prozess.
In diesem Syntheseverfahren werden Methanol und Kohlenstoffmonoxid bei
entwickeltes Verfahren hergestellt werden, den sogenannten Monsanto-Prozess.
In diesem Syntheseverfahren werden Methanol und Kohlenstoffmonoxid bei  und einem Druck von
und einem Druck von  zu Ethansäure umgesetzt. Alle beteiligten Stoffe liegen bei diesen Reaktionsbedingungen gasförmig vor und die Reaktion verläuft exotherm.
zu Ethansäure umgesetzt. Alle beteiligten Stoffe liegen bei diesen Reaktionsbedingungen gasförmig vor und die Reaktion verläuft exotherm.
1
Formuliere die Reaktionsgleichung für die Gleichgewichtsreaktion von Methanol und Kohlenstoffmonoxid zu Ethansäure und das darauf basierende Massenwirkungsgesetz.
Erläutere, wie sich eine Druckerhöhung bei gleichbleibender Temperatur sowie eine Temperaturerhöhung bei gleichbleibendem Druck jeweils auf dieses chemische Gleichgewicht auswirken (Material 1).
(9 BE)
2
In Material 2 sind die  -Werte verschiedener organischer Säuren angegeben.
Formuliere die Reaktionsgleichung für die Protolyse-Reaktion von 2,2-Dimethylpropansäure mit Wasser.
Erkläre anhand der jeweiligen Strukturformeln die unterschiedlichen
-Werte verschiedener organischer Säuren angegeben.
Formuliere die Reaktionsgleichung für die Protolyse-Reaktion von 2,2-Dimethylpropansäure mit Wasser.
Erkläre anhand der jeweiligen Strukturformeln die unterschiedlichen  -Werte im Vergleich.
-Werte im Vergleich.
(10 BE)
3
Butan kann mit reinem Sauerstoff zu Ethansäure und Wasser umgesetzt werden, wobei aus  Butan
Butan  Ethansäure entstehen.
Gib für alle Kohlenstoff-Atome und Sauerstoff-Atome der an der Reaktion beteiligten Stoffe jeweils die Oxidationszahl an.
Entwickle unter Verwendung von Strukturformeln für die organischen Verbindungen die Reaktionsgleichung von Butan mit Sauerstoff zu Ethansäure und Wasser und zeige anhand der Elektronenübergänge, dass es sich um eine Redoxreaktion handelt.
Ethansäure entstehen.
Gib für alle Kohlenstoff-Atome und Sauerstoff-Atome der an der Reaktion beteiligten Stoffe jeweils die Oxidationszahl an.
Entwickle unter Verwendung von Strukturformeln für die organischen Verbindungen die Reaktionsgleichung von Butan mit Sauerstoff zu Ethansäure und Wasser und zeige anhand der Elektronenübergänge, dass es sich um eine Redoxreaktion handelt.
(8 BE)
4
(7 BE)
5
Weinsäure (2,3-Dihydroxybutandisäure) ist eine der sogenannten Fruchtsäuren, die in Speiseessig enthalten sind. Für Weinsäure gibt es drei verschiedene Stereoisomere – obwohl sich in der Fischer-Projektion vier Strukturformeln zeichnen lassen.
Zeichne für Weinsäure (2,3-Dihydroxybutandisäure) vier Strukturformeln in der Fischer-Projektion und beschrifte in einer Formel die asymmetrischen Kohlenstoff-Atome mit einem Stern 

 Erkläre, dass tatsächlich nicht vier, sondern nur drei verschiedene Stereoisomere der Weinsäure existieren.
Erkläre, dass tatsächlich nicht vier, sondern nur drei verschiedene Stereoisomere der Weinsäure existieren.
(6 BE)
6
In der chemischen Industrie erzeugt man Ethansäureethylester in nur einer Reaktion aus Ethanal als einzigem Edukt.
Entwickle unter Verwendung von Strukturformeln die Reaktionsgleichung der Reaktion von Ethanal zu Ethansäureethylester.
Formuliere den Reaktionsmechanismus der alkalischen Hydrolyse des Ethansäureethylesters und erläutere die dabei ablaufenden Teilschritte.
(10 BE)
Material 1
Herstellung von Ethansäure – Monsanto-Prozess
Ethansäure kann über ein von der Firma BASFMaterial 2
 -Werte verschiedener organischer Verbindungen
-Werte verschiedener organischer Verbindungen
| Name der Verbindung | |
|---|---|
| Ethansäure | |
| Hydroxyethansäure | |
| 2,2-Dimethylpropansäure |
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1
Reaktionsgleichung


 Massenwirkungsgesetz
Massenwirkungsgesetz
![\(K = \dfrac{[CH_3COOH]}{[CH_3OH] \cdot [CO]}\)](https://www.schullv.de/resources/formulas/f7b1f095901cfac1c667fdd16503754fabc3f6c700708dc8c099875aff6872d0_light.svg) Auswirkung einer Druckerhöhung
Nach dem Prinzip des kleinsten Zwangs von LE CHATELIER und BRAUN weicht ein System bei einer Druckerhöhung auf die Seite mit den wenigeren Gasteilchen aus.
Die Reaktionsgleichung zeigt auf der Eduktseite zwei Gasteilchen und auf der Produktseite eins. Folglich verschiebt sich das Gleichgewicht auf die rechte Seite, also die der Ethansäure. Wird der Druck erhöht, läuft die Hinreaktion also verstärkt ab, um diesen von außen einwirkenden Zwang zu vermindern.
Auswirkung einer Druckerhöhung
Nach dem Prinzip des kleinsten Zwangs von LE CHATELIER und BRAUN weicht ein System bei einer Druckerhöhung auf die Seite mit den wenigeren Gasteilchen aus.
Die Reaktionsgleichung zeigt auf der Eduktseite zwei Gasteilchen und auf der Produktseite eins. Folglich verschiebt sich das Gleichgewicht auf die rechte Seite, also die der Ethansäure. Wird der Druck erhöht, läuft die Hinreaktion also verstärkt ab, um diesen von außen einwirkenden Zwang zu vermindern.
Das Gleichgewicht stellt sich neu ein. Auswirkung einer Temperaturerhöhung Nach dem Prinzip des kleinsten Zwangs von LE CHATELIER und BRAUN begünstigen hohe Temperaturen endotherme Reaktionen und niedrige Temperaturen die exotherme. Da die Reaktion exotherm ist, wird bei einer Temperaturerhöhung das Gleichgewicht auf die Seite der Edukte verschoben (nach links).
Das Gleichgewicht stellt sich neu ein. Auswirkung einer Temperaturerhöhung Nach dem Prinzip des kleinsten Zwangs von LE CHATELIER und BRAUN begünstigen hohe Temperaturen endotherme Reaktionen und niedrige Temperaturen die exotherme. Da die Reaktion exotherm ist, wird bei einer Temperaturerhöhung das Gleichgewicht auf die Seite der Edukte verschoben (nach links).
2
Reaktionsgleichung für die Protolyse-Reaktion


 Begründung der unterschiedlichen
Begründung der unterschiedlichen  -Werte anhand der Strukturformeln
Die unterschiedlichen
-Werte anhand der Strukturformeln
Die unterschiedlichen  -Werte der betrachteten Säuren lassen sich durch ihre molekularen Strukturen und die Stabilität der resultierenden Anionen nach der Deprotonierung erklären.
-Werte der betrachteten Säuren lassen sich durch ihre molekularen Strukturen und die Stabilität der resultierenden Anionen nach der Deprotonierung erklären.
Die Stabilität der Anionen und die Fähigkeit der Moleküle, intermolekulare Wechselwirkungen einzugehen, sind entscheidende Faktoren – eine höhere Stabilität des Anions führt zu einer stärkeren Säure und somit zu einem niedrigeren -Wert.
-Wert.
Die Stabilität der Anionen und die Fähigkeit der Moleküle, intermolekulare Wechselwirkungen einzugehen, sind entscheidende Faktoren – eine höhere Stabilität des Anions führt zu einer stärkeren Säure und somit zu einem niedrigeren
| Ethansäure
|
|---|
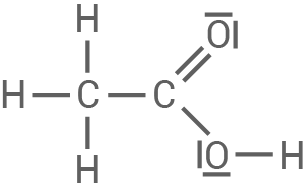
|
| Die Ethansäure hat einen |
| Hydroxyethansäure
|
|---|
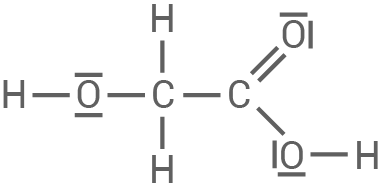
|
| Die Hydroxyethansäure hat einen |
| 2,2-Dimethylpropansäure
|
|---|
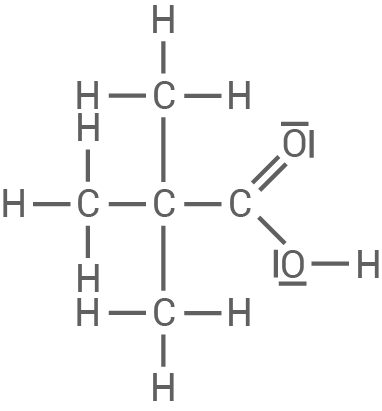
|
| Die 2,2-Dimethylpropansäure hat einen |
3
Oxidationszahlen für alle Kohlenstoff- und Sauerstoffatome der beteiligten Stoffe
Reaktionsgleichung und Elektronenübergänge
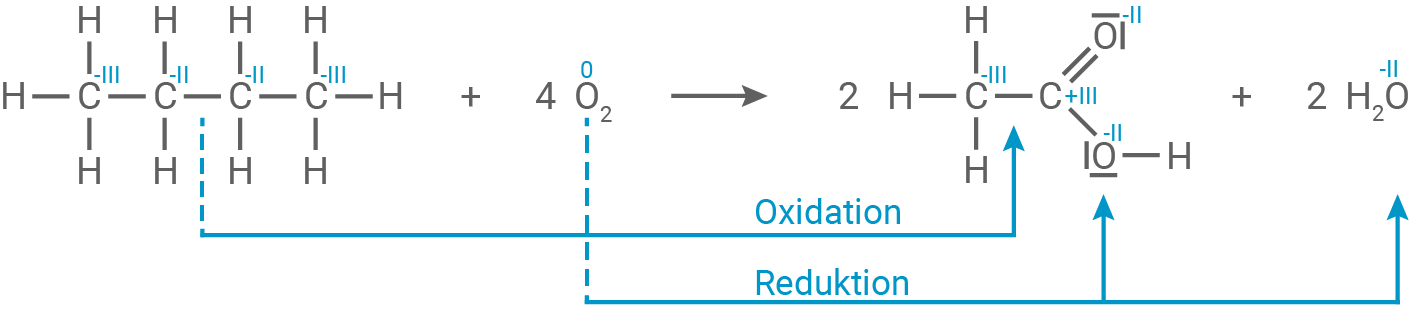 Die Oxidation des Kohlenstoffs in Butan
Die Oxidation des Kohlenstoffs in Butan  führt zu einem Elektronenverlust. Die Kohlenstoffatome gehen von einer niedrigeren Oxidationszahl
führt zu einem Elektronenverlust. Die Kohlenstoffatome gehen von einer niedrigeren Oxidationszahl  zu einer höheren
zu einer höheren  im
im  über, indem sie Elektronen abgeben.
Der molekulare Sauerstoff
über, indem sie Elektronen abgeben.
Der molekulare Sauerstoff  nimmt diese Elektronen auf und wird dabei reduziert, da die Oxidationszahl von
nimmt diese Elektronen auf und wird dabei reduziert, da die Oxidationszahl von  auf
auf  sinkt, wenn er zu Wasser
sinkt, wenn er zu Wasser  wird.
wird.
| Butan |
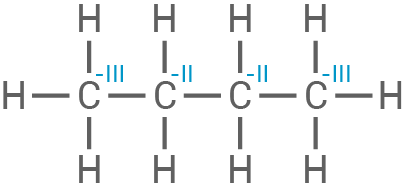
|
|---|---|
| Sauerstoff |
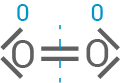
|
| Ethansäure |
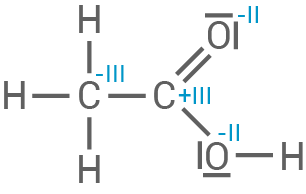
|
| Wasser |
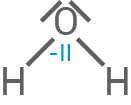
|

4
Berechnung der Stoffmengen-Konzentration in Speiseessig
Zunächst wird die Stoffmenge an Ethansäure berechnet:
![\(\begin{array}[t]{rll}
n (CH_3COOH)&=& \dfrac{m(CH_3COOH)}{M(CH_3COOH)} &\\[5pt]
&=& \dfrac{5\,\text{g}}{60,05\,\text{g} \cdot \text{mol}^{-1}} &\\[5pt]
&\approx& 0,083\,\text{mol}
\end{array}\)](https://www.schullv.de/resources/formulas/408b9842fe55098a9e3cc49de8ea991ad50363ee16d7cbfcb44e9fac9325cfe2_light.svg) Weiterhin folgt:
Weiterhin folgt:
![\(\begin{array}[t]{rll}
c (CH_3COOH) &=& \dfrac{n(CH_3COOH)}{V(CH_3COOH)} & \\[5pt]
&=& \dfrac{0,083\,\text{mol}}{0,1\,\text{L}} & \\[5pt]
&=& 0,83 \,\text{mol} \cdot \text{L}^{-1}
\end{array}\)](https://www.schullv.de/resources/formulas/9edc0bd6d0d353de3f07cb5e224e5a5aee0c1d2a6a59a2161043835fff41161b_light.svg) Die Stoffmengen-Konzentration der Ethansäure beträgt
Die Stoffmengen-Konzentration der Ethansäure beträgt  Berechnung der Stoffmengen-Konzentration an
Berechnung der Stoffmengen-Konzentration an  -Ionen:
Da der
-Ionen:
Da der  -Wert des Speiseessigs gegeben ist, können wir die Konzentration der
-Wert des Speiseessigs gegeben ist, können wir die Konzentration der  -Ionen wie folgt berechnen:
-Ionen wie folgt berechnen:
![\(\begin{array}[t]{rll}
c(H_3O^+)&=& 10^{-pH} & \\[5pt]
&=& 10^{-2,41} & \\[5pt]
&\approx& 0,0039 \,\text{mol} \cdot \text{L}^{-1}
\end{array}\)](https://www.schullv.de/resources/formulas/3c70c7085a59cc99082bb87b1fe42382f0324dcf4d35b6976b009b67934251ee_light.svg) Die Stoffmengen-Konzentration der
Die Stoffmengen-Konzentration der  -Ionen beträgt etwa
-Ionen beträgt etwa  Berechnung der Stoffmengen-Konzentration an
Berechnung der Stoffmengen-Konzentration an  -Ionen
Die Konzentration der
-Ionen
Die Konzentration der  -Ionen kann auch über den
-Ionen kann auch über den  -Wert berechnet werden.
-Wert berechnet werden.
 Die Stoffmengen-Konzentration der
Die Stoffmengen-Konzentration der  -Ionen kann nun äquivalent berechnet werden:
-Ionen kann nun äquivalent berechnet werden:
![\(\begin{array}[t]{rll}
c(OH^-)&=& 10^{-pOH} & \\[5pt]
&=& 10^{-11,59} & \\[5pt]
&\approx& 2,57×10^{−12} \,\text{mol} \cdot \text{L}^{-1}
\end{array}\)](https://www.schullv.de/resources/formulas/f82d7652989ea4c3fd1ef60e6dd83d77f2194afdca5add2b4ead5bf669591579_light.svg) Die Stoffmengen-Konzentration der
Die Stoffmengen-Konzentration der  -Ionen beträgt etwa
-Ionen beträgt etwa 
5
Strukturformeln der Weinsäure in Fischer-Projektion
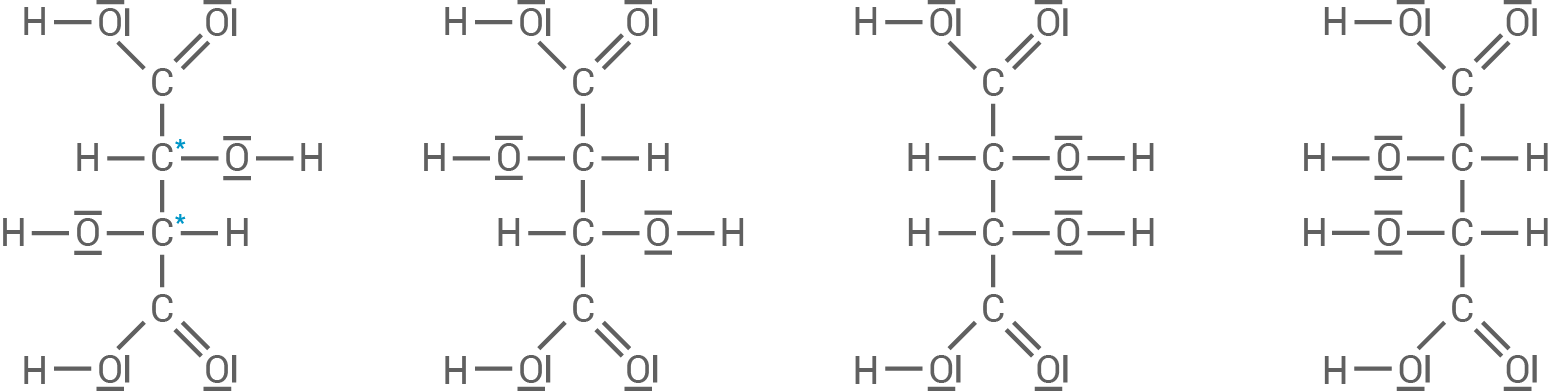 Anzahl der Stereoisomere
Es existieren in diesem Fall nur drei verschiedene Stereoisomere, da es sich bei den beiden rechten Stereoisomeren um eine Meso-Verbindung handelt. Das bedeutet, die Verbindung besitzt eine innere Spiegelebene. Die beiden chiralitätsbestimmenden Zentren gleichen sich hierbei gegenseitig aus, sodass das Molekül insgesamt achiral ist.
Anzahl der Stereoisomere
Es existieren in diesem Fall nur drei verschiedene Stereoisomere, da es sich bei den beiden rechten Stereoisomeren um eine Meso-Verbindung handelt. Das bedeutet, die Verbindung besitzt eine innere Spiegelebene. Die beiden chiralitätsbestimmenden Zentren gleichen sich hierbei gegenseitig aus, sodass das Molekül insgesamt achiral ist.

6
Reaktionsgleichung von Ethanal zu Ethansäureethylester
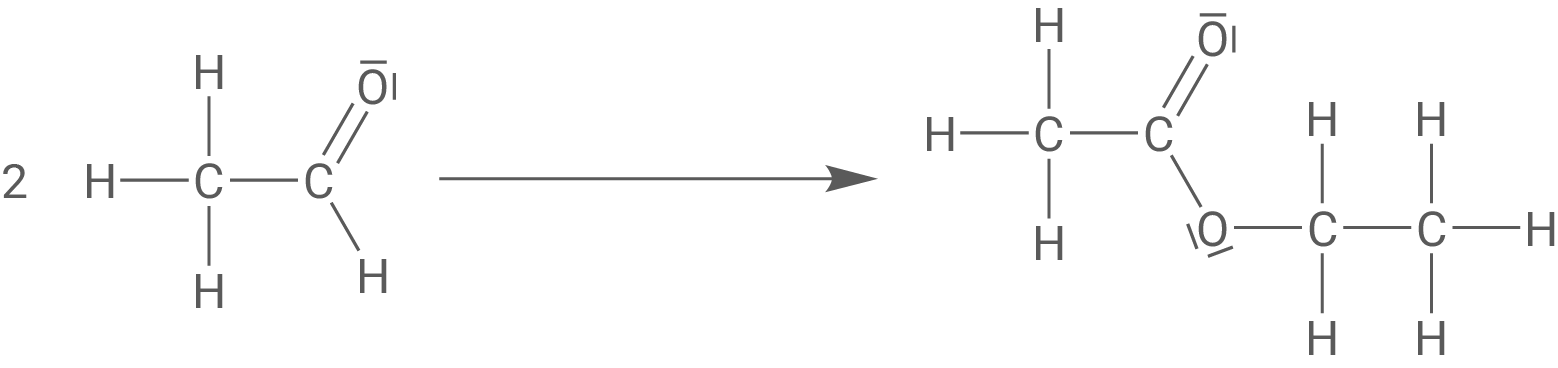 Reaktionsmechanismus der alkalischen Hydrolyse von Ethansäureethylester
Die alkalische Hydrolyse des Ethansäureethylesters (Essigsäureethylester) ist eine klassische Reaktion in der organischen Chemie, die als Verseifung bezeichnet wird. Hierbei wird der Ester unter Verwendung einer starken Base, typischerweise Natronlauge
Reaktionsmechanismus der alkalischen Hydrolyse von Ethansäureethylester
Die alkalische Hydrolyse des Ethansäureethylesters (Essigsäureethylester) ist eine klassische Reaktion in der organischen Chemie, die als Verseifung bezeichnet wird. Hierbei wird der Ester unter Verwendung einer starken Base, typischerweise Natronlauge  in die entsprechenden Alkohole und Säuresalze gespalten.
Im ersten Schritt greift das Hydroxid-Ion
in die entsprechenden Alkohole und Säuresalze gespalten.
Im ersten Schritt greift das Hydroxid-Ion  das Carbonyl-Kohlenstoffatom des Ethansäureethylesters an und bildet ein tetraedrisches Zwischenprodukt mit einer negativ geladenen Alkoholatgruppe:
das Carbonyl-Kohlenstoffatom des Ethansäureethylesters an und bildet ein tetraedrisches Zwischenprodukt mit einer negativ geladenen Alkoholatgruppe:
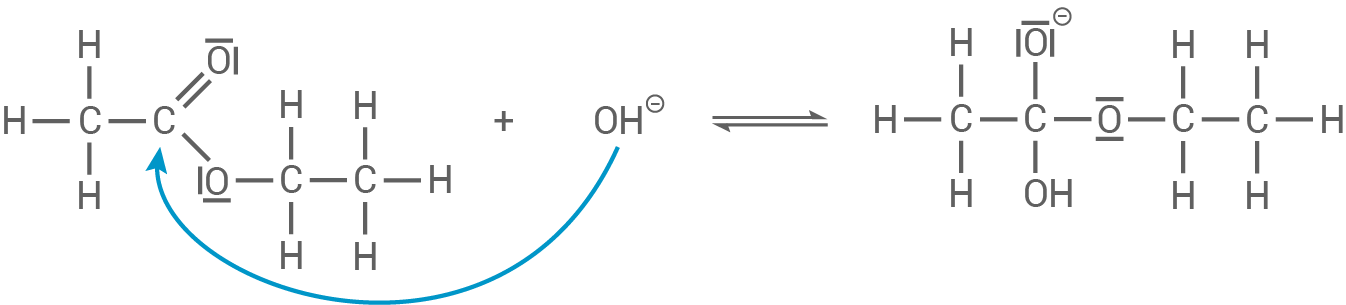 Im nächsten Schritt zerfällt das Zwischenprodukt, indem das Ethoxid-Ion
Im nächsten Schritt zerfällt das Zwischenprodukt, indem das Ethoxid-Ion  als Abgangsgruppe freigesetzt wird.
als Abgangsgruppe freigesetzt wird.
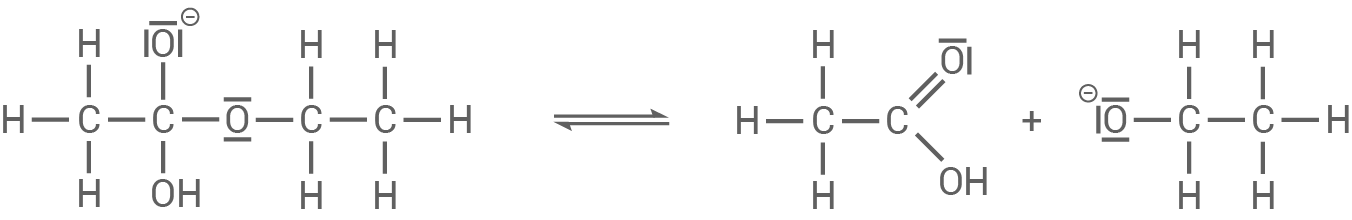 Die gebildete Carbonsäure
Die gebildete Carbonsäure  Ethansäure,
Ethansäure,  würde theoretisch entstehen, wird aber sofort durch das basische Reaktionsmedium neutralisiert. Das Hydroxid-Ion deprotoniert die Carbonsäure, sodass direkt das Acetat-Ion entsteht:
würde theoretisch entstehen, wird aber sofort durch das basische Reaktionsmedium neutralisiert. Das Hydroxid-Ion deprotoniert die Carbonsäure, sodass direkt das Acetat-Ion entsteht:
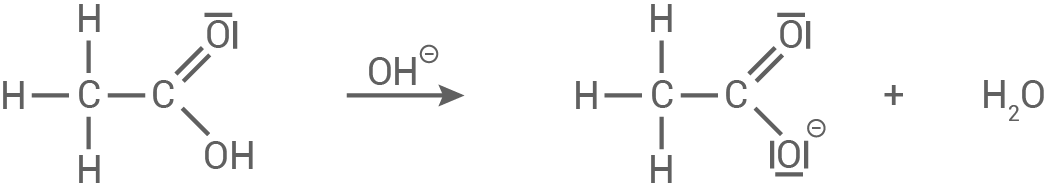 Im letzten Schritt wird das entstandene Ethoxid-Ion
Im letzten Schritt wird das entstandene Ethoxid-Ion  reagiert anschließend mit einem Wassermolekül, um Ethanol zu bilden:
reagiert anschließend mit einem Wassermolekül, um Ethanol zu bilden:
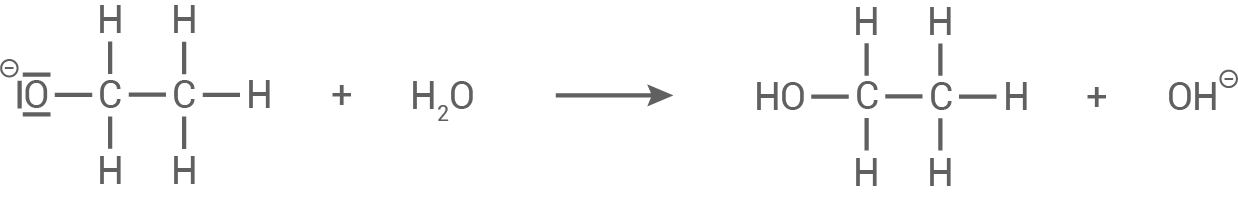 Das Hydroxid-Ion
Das Hydroxid-Ion  wird während der Reaktion nicht verbraucht, sondern fungiert als Katalysator. Die Hydrolyse ist daher irreversibel, weil das Carboxylat-Ion (Acetat) nicht mehr zum Ester zurück reagieren kann.
wird während der Reaktion nicht verbraucht, sondern fungiert als Katalysator. Die Hydrolyse ist daher irreversibel, weil das Carboxylat-Ion (Acetat) nicht mehr zum Ester zurück reagieren kann.




