Vorschlag A – Zahnpasta zum Selbermachen – ein DIY-Trend
In herkömmlicher Zahnpasta finden sich häufig Inhaltsstoffe, die bezogen auf die menschliche Gesundheit bedenklich sind. Neben Mikroplastik-Partikeln enthält Zahnpasta häufig viele verschiedene Konservierungsstoffe und Süßstoffe. Der in der Vergangenheit oft enthaltene Süßstoff Aspartam wird seit dem Jahr 2023 durch die IARC (International Agency for Research on Cancer) grundsätzlich als krebserregend für den Menschen klassifiziert.
Alternativ kann man Zahnpasta selbst herstellen, ein „do it yourself“-Trend. Hierbei werden Inhaltsstoffe verwendet, die überwiegend natürlicher Herkunft sind.
Als Grundlage wird häufig Kokosöl eingesetzt, denn es wirkt antibakteriell. Die Caprylsäure und Laurinsäure im Kokosöl senken somit das Kariesrisiko.
Der sogenannte Birkenzucker Xylit erfüllt gleich mehrere Anforderungen, die an eine Zahnpasta gestellt werden. Es ist ein Zuckeraustauschstoff, der süßt, gleichzeitig säurereduzierend und damit nachweislich kariesreduzierend wirkt, außerdem hält er die Zahnpasta feucht.
Menthol, das aus Pfefferminze gewonnen wird, sorgt für ein frisches Mundgefühl und ist entzündungshemmend.
Für weiße Zähne sorgt der Zusatz von Natron in der Zahnpasta.
Zum Abfüllen der DIY-Zahnpasta gibt es mittlerweile vollständig im Wertstoffkreislauf recyclebare Tuben.
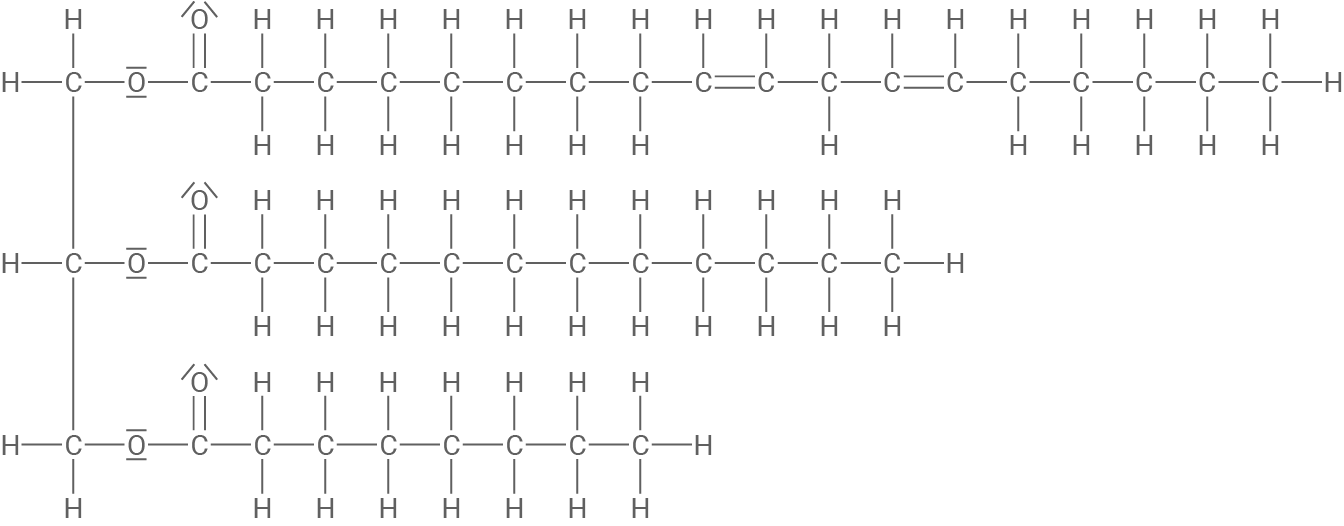
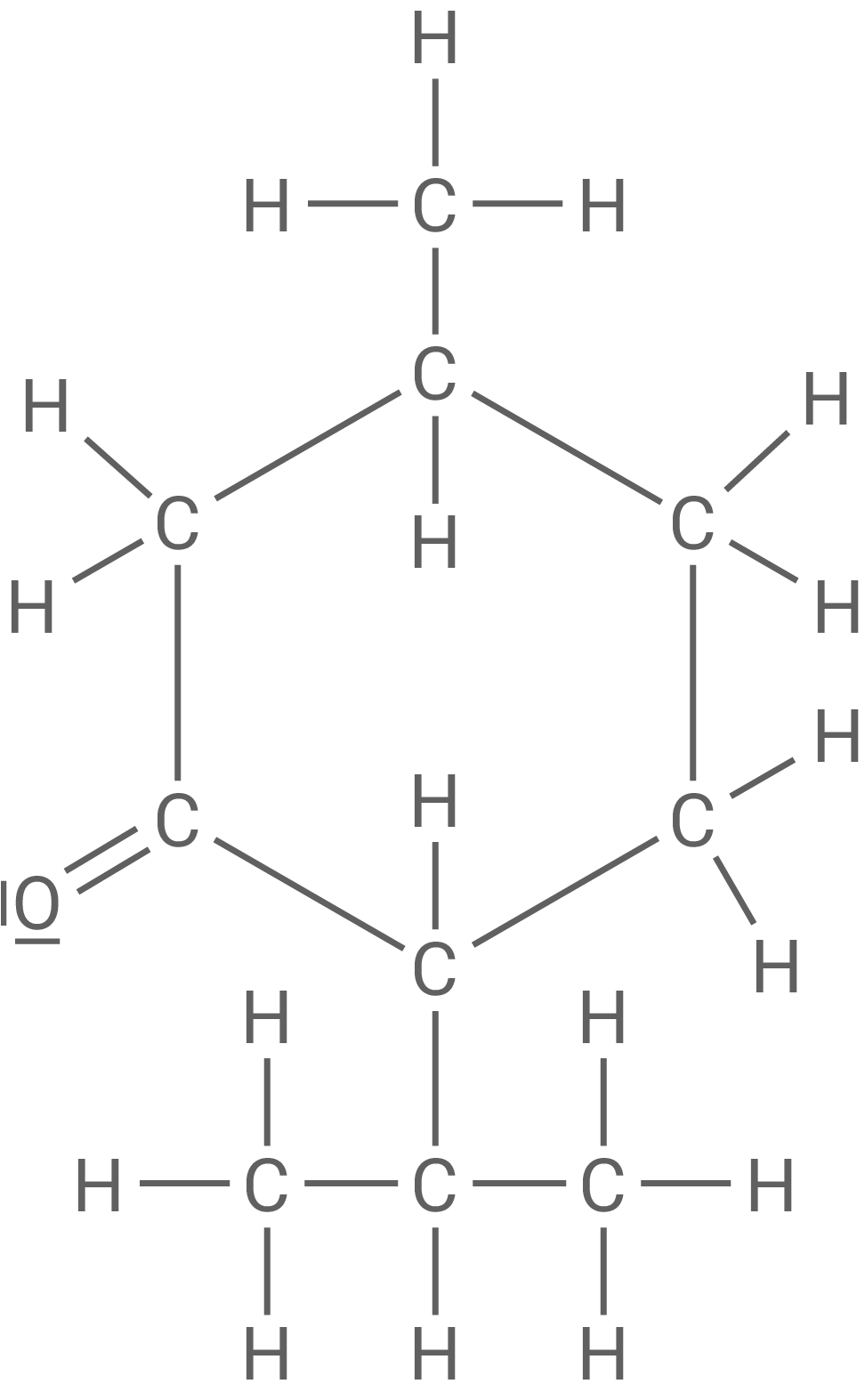
In Material 1 ist ein sogenanntes Triglycerid-Molekül abgebildet, das in Kokosöl vorkommt.
Solche Triglycerid-Moleküle können Ausgangsstoffe für weitere Reaktionen sein.
Beschreibe den Aufbau des in Material 1 abgebildeten Triglycerid-Moleküls.
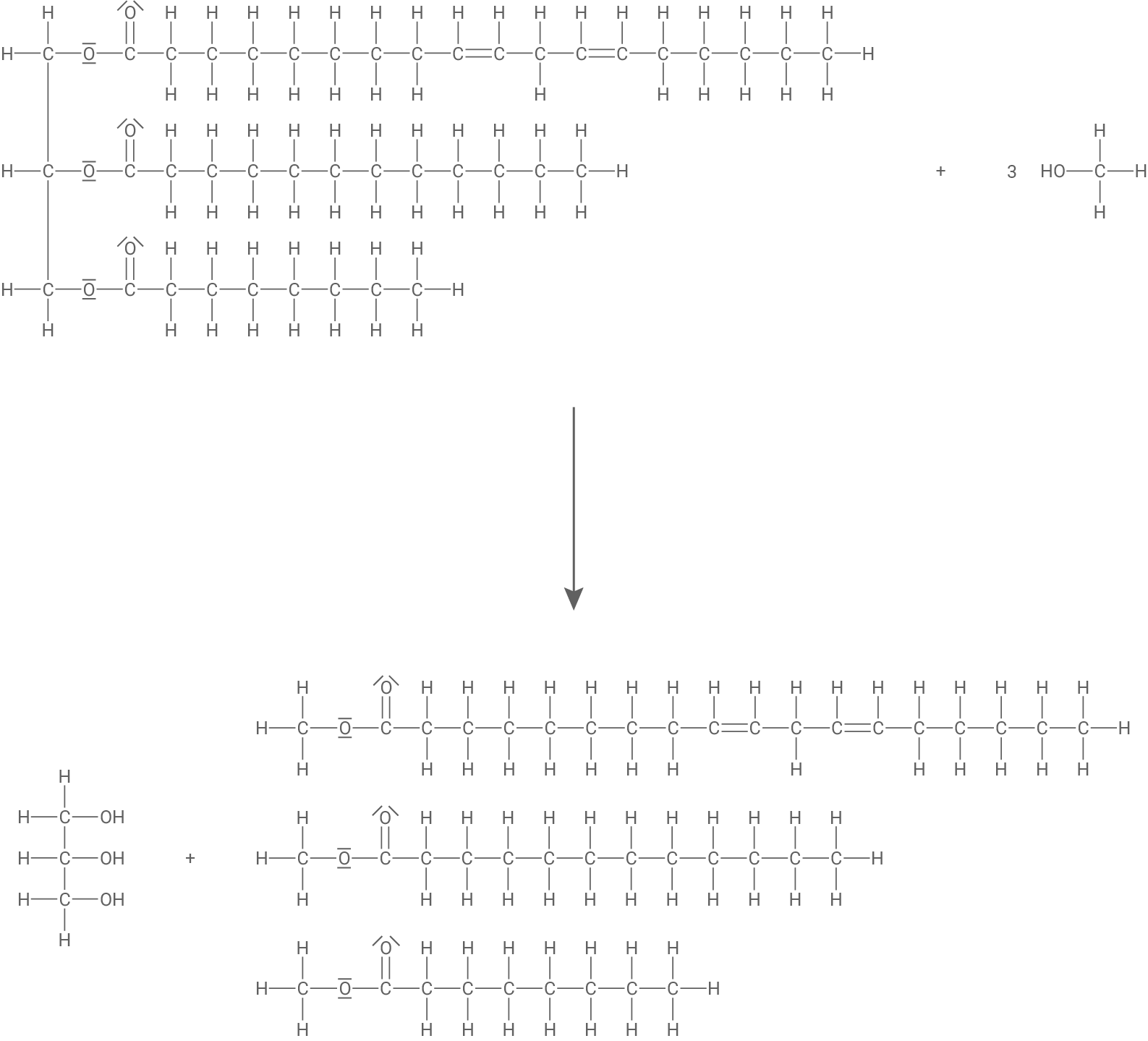
Formuliere in Strukturformeln die Reaktionsgleichung für die in Material 1 beschriebene Reaktion des Triglycerid-Moleküls.
Material 2 zeigt die Fischer-Projektion von D-Xylit.
Gib die Fischer-Projektion von L-Xylit sowie eine Definition von „D-“ und „L-“ an und benenne Xylit nach der IUPAC-Nomenklatur.
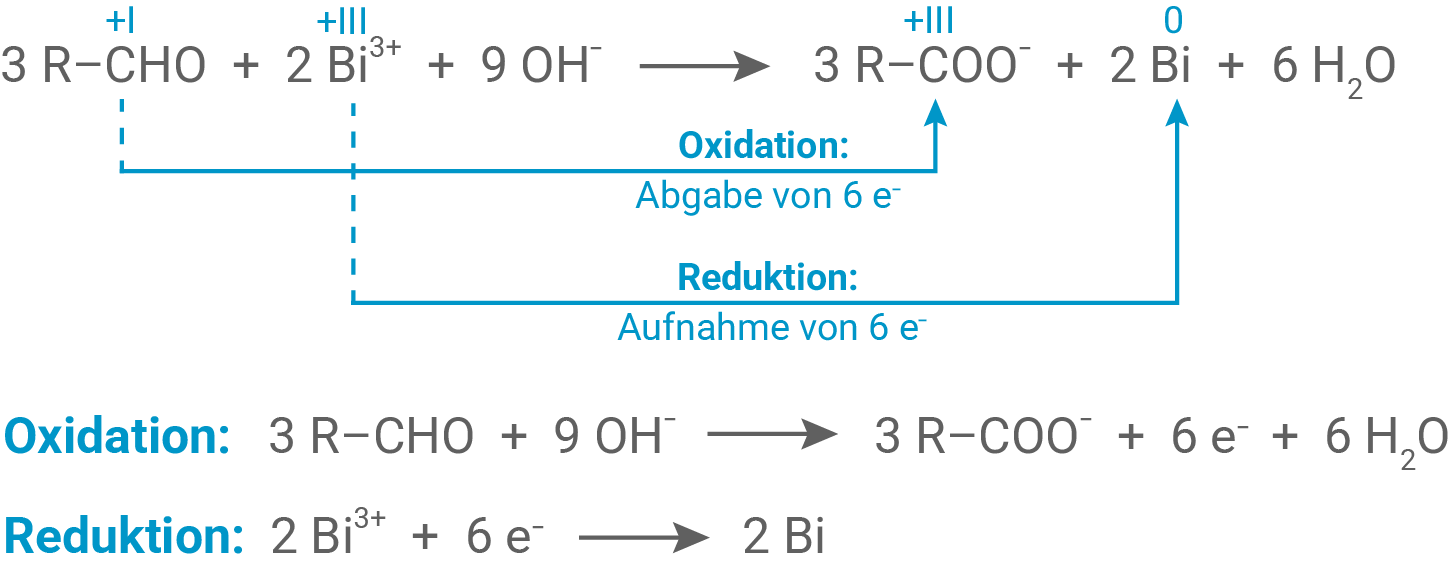
Formuliere die Reaktionsgleichung für die Reaktion des aus D-Xylit entstandenen Aldehyds (Alkanals) mit Nylander-Reagenz (Material 2), gib die wesentlichen Oxidationszahlen an und zeige anhand der Elektronenübergänge, dass es sich um eine Redoxreaktion handelt.
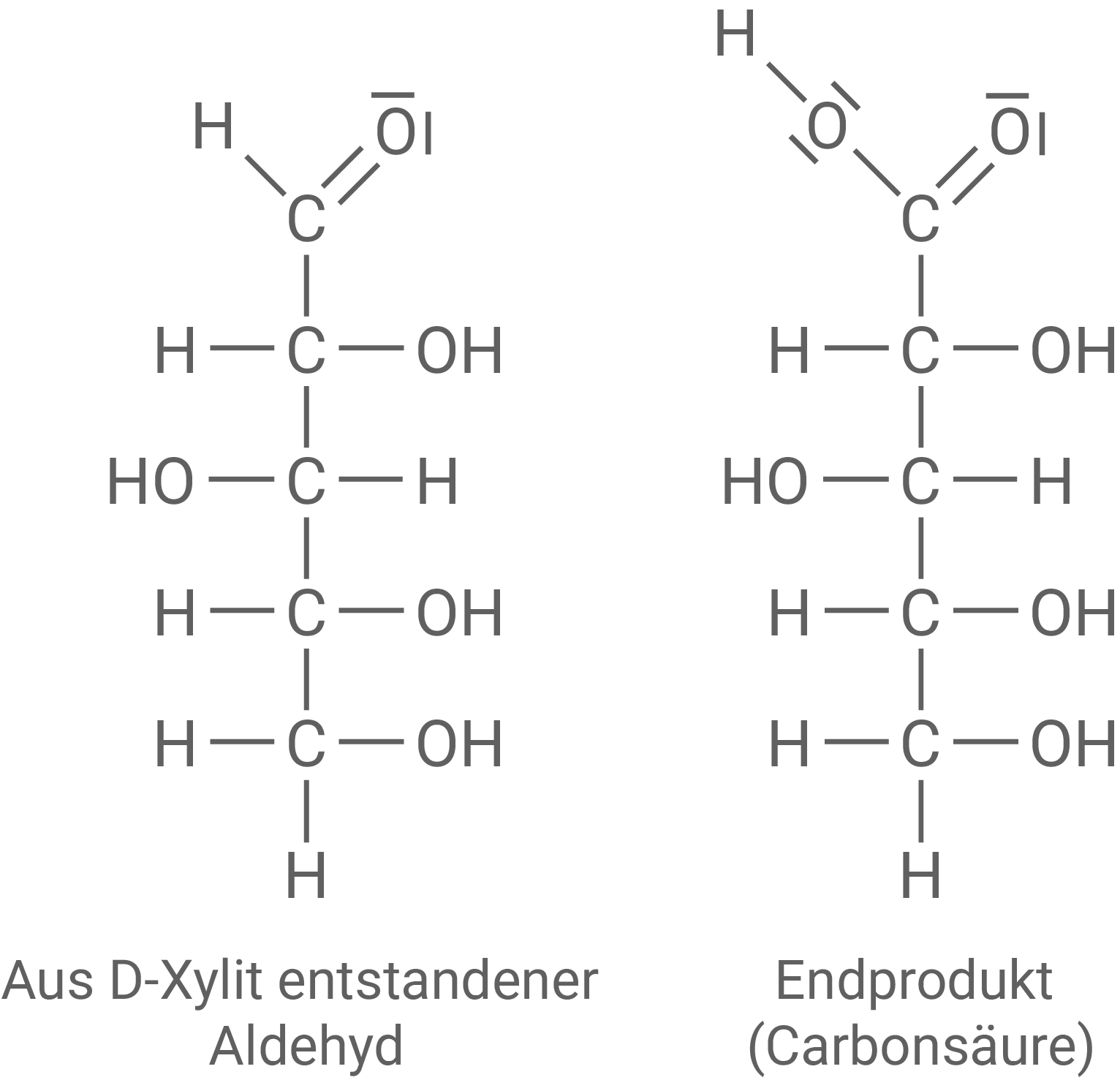
Formuliere jeweils die Fischer-Projektion des aus D-Xylit entstandenen Aldehyds (Alkanals) und des organischen Produkts der Reaktion mit Nylander-Reagenz (Material 2).
Xylit kann in der Zahnpasta auch als „Feuchthaltemittel“ verwendet werden.
Erkläre auch mithilfe von Material 2 die Fähigkeit von Xylit, die Zahnpasta feucht zu halten und damit ein Austrocknen zu verhindern.
Pfefferminzöl enthält etwa 35 % bis 45 % des Aromastoffs Menthol sowie 15 % bis 20 % des Aromastoffs Menthon.
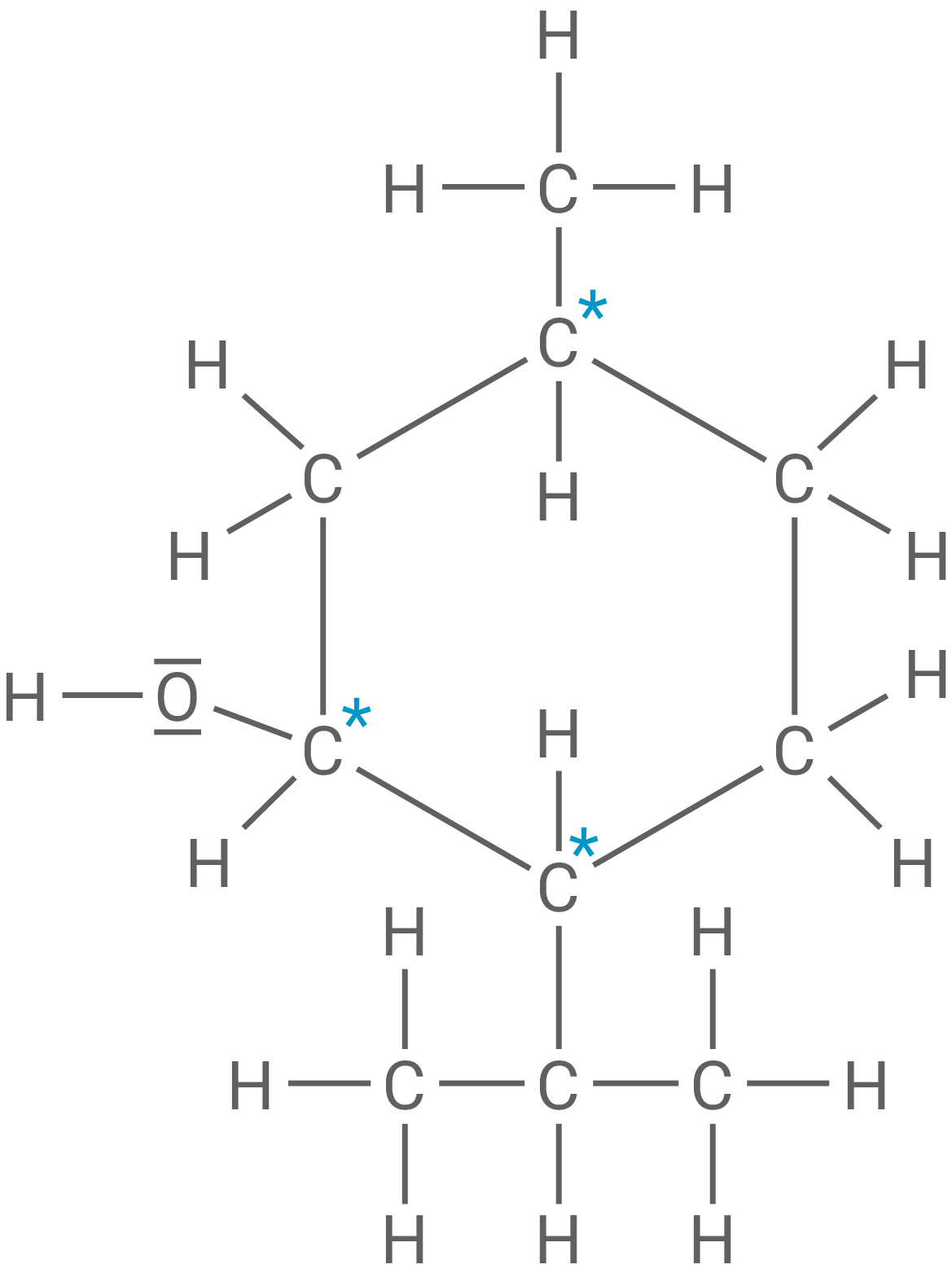
Beschrifte die drei asymmetrischen Kohlenstoff-Atome im Menthol-Molekül (Material 3).
Gib eine Definition für den Fachbegriff „optische Aktivität“ an.
Entwickle mithilfe von Material 3 die Strukturformel für die Verbindung Menthon.
Natron (Natriumhydrogencarbonat; ) wird der Zahnpasta zugesetzt, um weiße Zähne zu erzeugen. Bei der Reaktion von Natron in wässriger Lösung entstehen eine alkalische Lösung und ein Gas, das sich mithilfe von Calciumhydroxid-Lösung nachweisen lässt (Kalkwasser-Probe).
Formuliere die Reaktionsgleichung für die Reaktion von Natron in wässriger Lösung und beschreibe die zu erwartende Beobachtung bei einer positiv ausfallenden Kalkwasser-Probe.
Berechne die Konzentration von Hydroxid- und Oxonium-Ionen in einer Zahnpasta-Lösung mit einem -Wert von
Berechne das Volumen von des bei der Reaktion entstehenden Gases bei Raumtemperatur.
Hinweis:
Gehe für diese Berechnung davon aus, dass des Gases ein Volumen von
einnimmt.
Nachhaltige Zahnpastatuben können beispielsweise aus Polyethen aufgebaut sein.
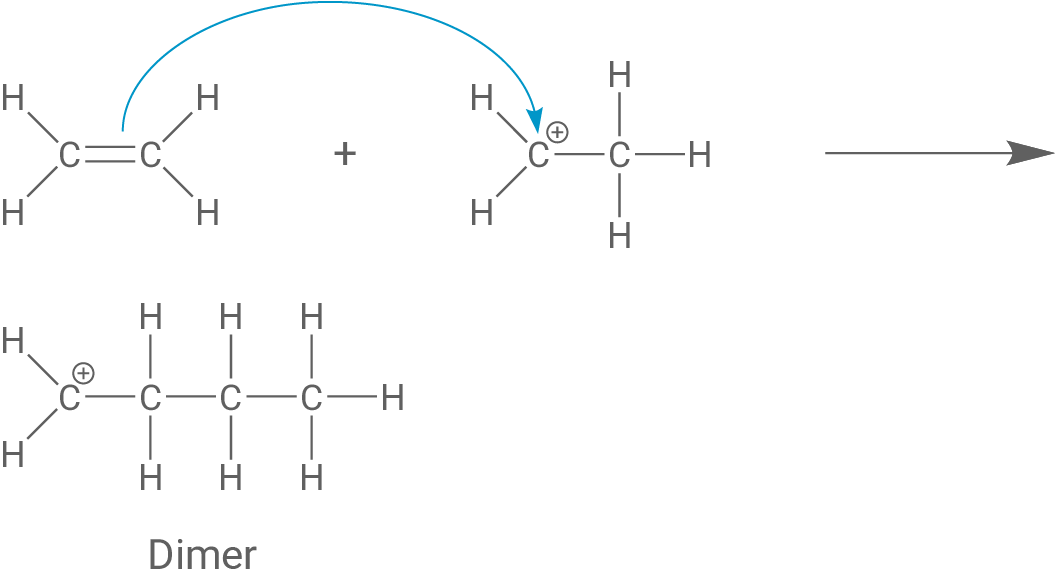
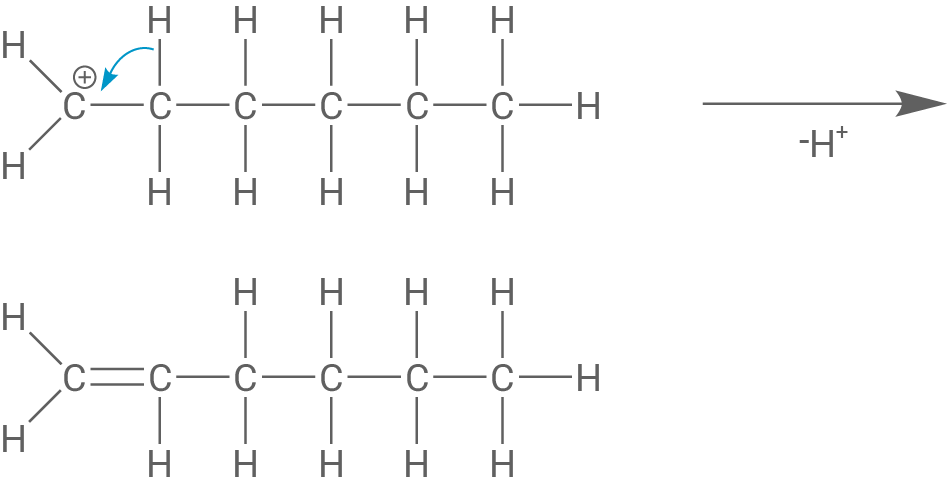
Formuliere einschließlich einer Abbruchreaktion den Reaktionsmechanismus der Reaktion von Ethen mit einer starken Säure als Starter (Material 4), wobei du drei Ethen-Moleküle miteinander verknüpfst.
Erörtere, dass die neuentwickelte Zahnpastatube, obwohl sie aus Kunststoff ist, trotzdem als nachhaltig eingestuft werden kann (Material 5 und 6).
Material 1
Triglycerid-Molekül im Kokosöl
Die Triglycerid-Moleküle im Kokosöl können als Ausgangsstoffe für die Synthese von sogenannten Fettsäuremethylestern (FAME-Verbindungen) genutzt werden. Dabei reagiert das dargestellte Triglycerid mit Methanol zu sogenannten Fettsäuremethylestern und einer weiteren organischen Verbindung. Diese Reaktion wird als Umesterung bezeichnet.
Material 2
D-Xylit
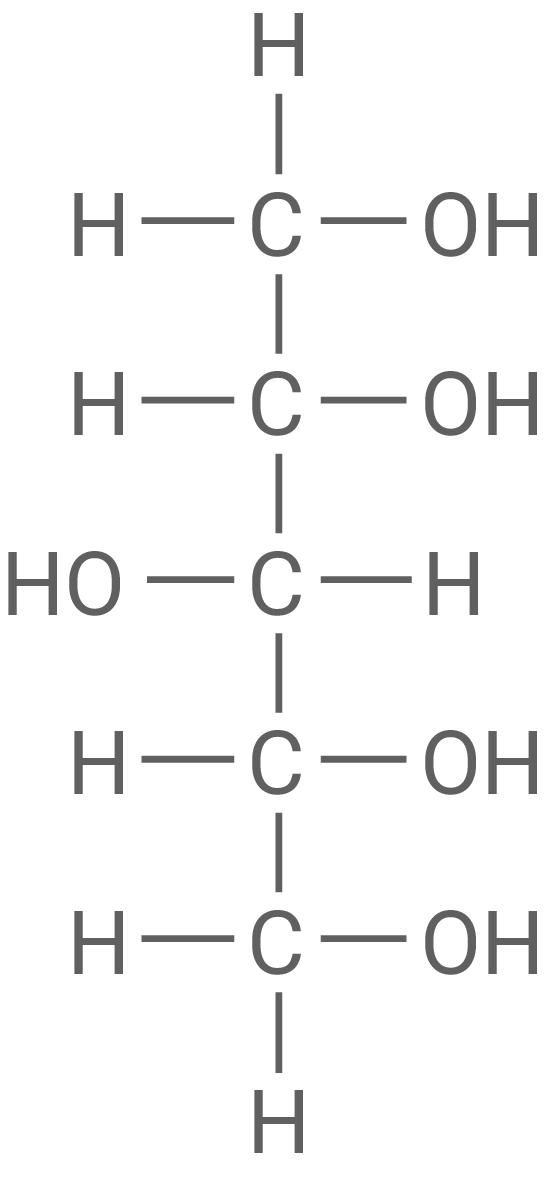
Mit einem geeigneten Oxidationsmittel kann man Xylit am C1-Atom zu einem Aldehyd (Alkanal) oxidieren. Dieser Aldehyd kann mit dem sogenannten Nylander-Reagenz nachgewiesen werden. Nylander-Reagenz enthält Bismut(III)-Ionen in alkalischer Lösung, die bei der Reaktion mit Aldehyd-Gruppen zu elementarem
(Bismut) reagieren. Das organische Reaktionsprodukt besitzt am C1-Atom eine Carboxylat-Gruppe.
Material 3
Menthol
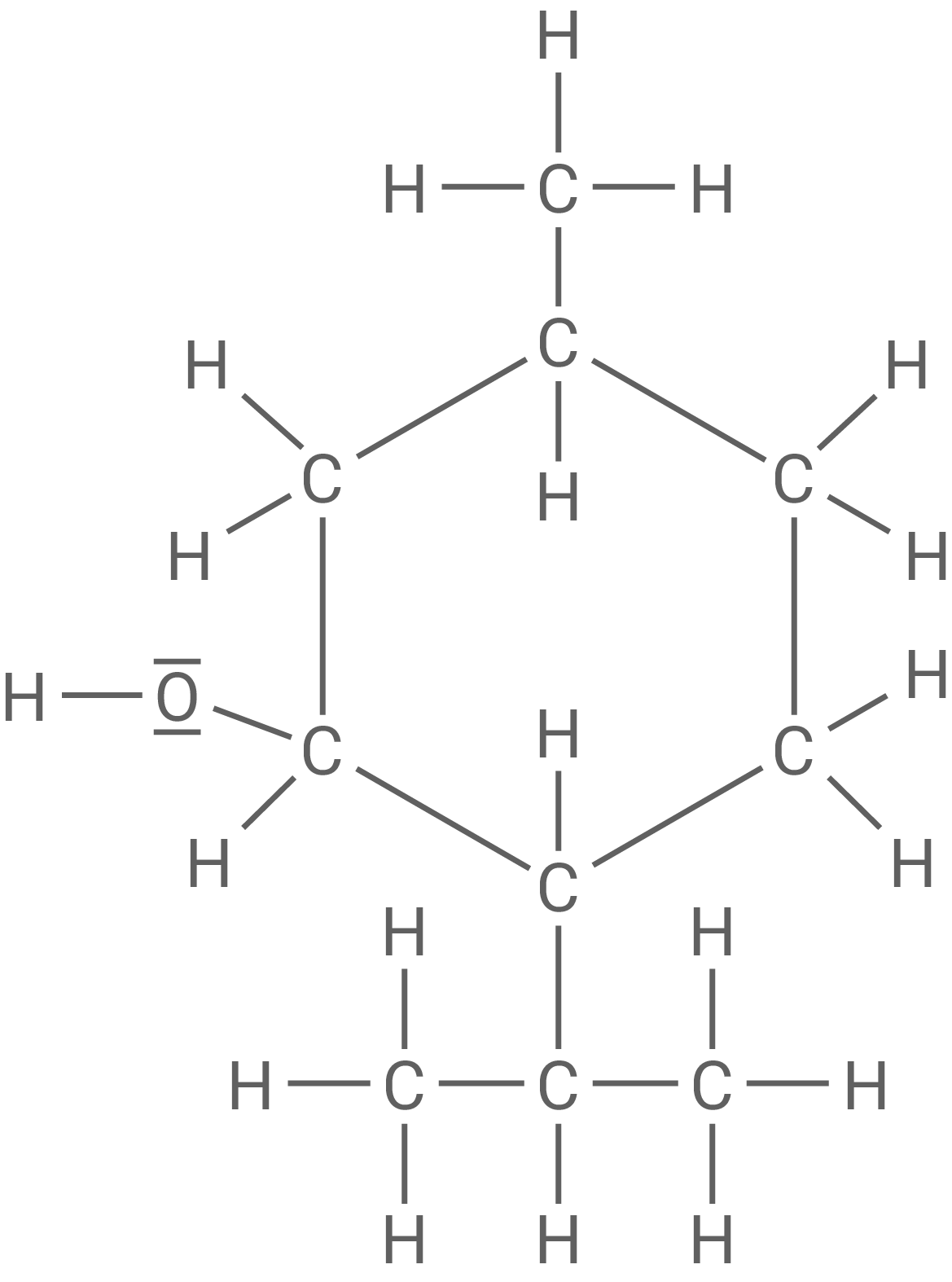
Das die Hydroxy-Gruppe bindende Kohlenstoff-Atom von Menthol lässt sich mit einem geeigneten Oxidationsmittel oxidieren, dabei entsteht die Verbindung Menthon. Das Kohlenstoff-Gerüst bleibt dabei unverändert.
Material 4
Polymerisation von Ethen
Die Herstellung von Polyethen kann je nach verwendeter Startersubstanz über unterschiedliche Reaktionsmechanismen ablaufen.
Startet man die Polymerisation von Ethen durch Zugabe einer starken Säure, dann reagiert ein Elektronenpaar der C-C-Doppelbindung mit einem Proton Dadurch wird die Doppelbindung aufgebrochen. Das entstandene Ion startet nun die Kettenreaktion, indem es ein weiteres Ethen-Molekül angreift.
Ein Abbruch erfolgt durch Abspaltung eines Protons und Ausbildung einer C-C-Doppelbindung.
Material 5
Aufbau von Zahnpastatuben und Nachhaltigkeit
Die am häufigsten verwendeten Zahnpastatuben haben einen Tubenkörper, der aus mehreren Schichten Kunststoff (Polyethen oder Polypropen) mit einer dazwischenliegenden Trennschicht aus einem anderen Kunststoff oder Aluminium aufgebaut ist. Meist wird die Tube durch Aluminium versiegelt und der Tubenverschluss besteht aus einem anderen Kunststoff als der Tubenkörper. Eine neu entwickelte Zahnpastatube besteht komplett aus Polyethen (PE), das zu 50 % wiederverwertet wurde.
Material 6
Nachhaltigkeit
Nach dem Bundesministerium für wirtschaftliche Zusammenarbeit und Entwicklung wird Nachhaltigkeit wie folgt definiert:
„Nachhaltigkeit oder nachhaltige Entwicklung bedeutet, die Bedürfnisse der Gegenwart so zu befriedigen, dass die Möglichkeiten zukünftiger Generationen nicht eingeschränkt werden. Dabei ist es wichtig, die drei Dimensionen der Nachhaltigkeit – wirtschaftlich effizient, sozial gerecht, ökologisch tragfähig – gleichberechtigt zu betrachten.“
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Beschreibung des Aufbaus des Triglycerid-Moleküls
Bei dem gezeigten Triglycerid handelt es sich (wie bei allen Triglyceriden) um einen dreifachen Ester aus Glycerin (Propan-1,2,3-triol) und drei Fettsäuren. Alle drei Hydroxy-Gruppen des Glycerins sind hierbei jeweils mit der Carboxy-Gruppe einer Fettsäure verestert. Die gezeigten Fettsäure-Reste variieren in der Länge ihrer Alkyl-Reste. Der untere und der mittlere Fettsäure-Rest gehören zur Klasse der gesättigten Fettsäuren, wohingegen der obere Fettsäure-Rest aufgrund seiner zwei Doppelbindungen zu den mehrfach ungesättigten Fettsäuren zählt.
Reaktionsgleichung der Umesterung in Strukturformeln
Das Triglycerid-Molekül reagiert mit drei Methanol-Molekülen in einer Umesterung. Hierbei entstehen Propan-1,2,3-triol und die jeweiligen Fettsäuremethylester (Octadeca-9,12-diensäuremethylester, Dodecansäuremethylester, Octansäuremethylester).
Fischer-Projektion von L-Xylit und Definition von „D-“ und „L-“
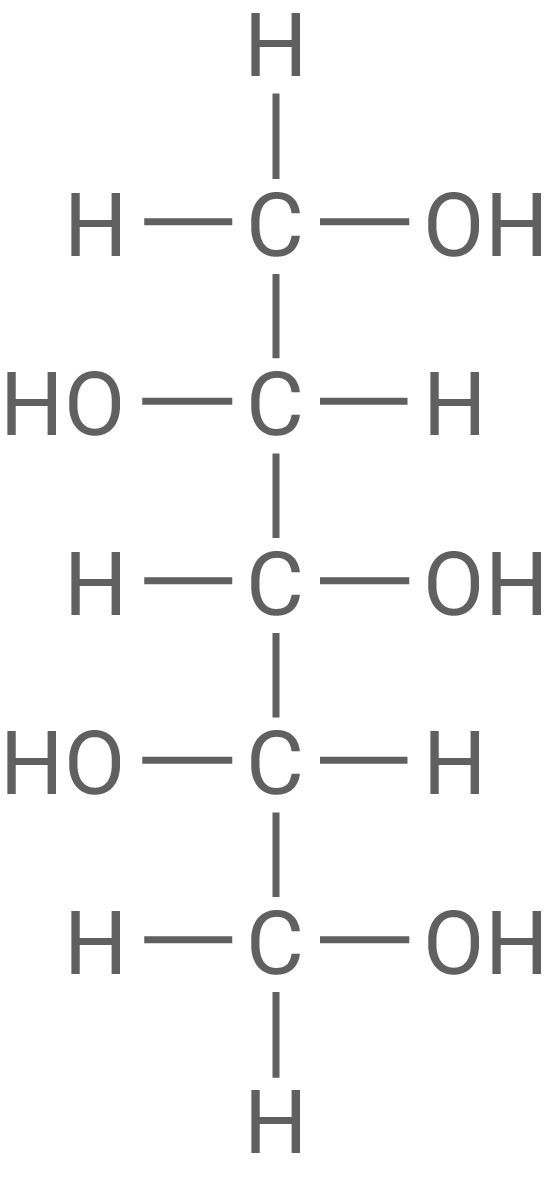
Benennung von Xylit nach der IUPAC-Nomenklatur
Pentan-1,2,3,4,5-pentol
Reaktionsgleichung des aus D-Xylit entstandenen Aldehyds mit Nylander-Reagenz
Hinweis: Die Reaktionsgleichung kann alternativ auch mit einer Carboxy-Gruppe anstelle der Carboxylat-Gruppe formuliert werden.
Angabe der Oxidationszahlen und Zeigen der Redoxreaktion anhand der Elektronenübergänge
Fischer-Projektion des Aldehyds und des organischen Produkts
Erklärung der Fähigkeit von Xylit, die Zahnpasta feucht zu halten
Betrachtet man die Strukturformel von Xylit, erkennt man fünf Hydroxy-Gruppen. Diese polaren Gruppen können Wasserstoffbrücken mit Wassermolekülen ausbilden, da diese ebenfalls polar sind (negativ polarisiertes Sauerstoff-Atom und zwei positiv polarisierte Wasserstoff-Atome). Dadurch kann Wasser eingelagert werden und die Zahnpasta bleibt feucht.
Beschriftung der drei asymmetrischen Kohlenstoff-Atome in Menthol
Definition für den Begriff „optische Aktivität“
Eine optisch aktive Substanz dreht, wenn sie mit linear polarisiertem Licht bestrahlt wird, die Schwingungsebene (Polarisationsrichtung) des Lichts um einen charakteristischen Winkel. Es gibt links- und rechtsdrehende Substanzen. Lediglich chirale Substanzen bewirken eine makroskopisch beobachtbare Drehung der Polarisationsrichtung.
Strukturformel für Menthon
Reaktionsgleichung für Natron in wässriger Lösung
Beobachtung bei positiver Kalkwasser-Probe
Ein weißer Niederschlag bildet sich in der Lösung.
Berechnung der Konzentration von Hydroxid- und Oxonium-Ionen
Der -Wert wird mithilfe des negativ dekadischen Logarithmus der Konzentration der Oxonium-Ionen berechnet. Für die Konzentration der Oxonium-Ionen gilt:
Berechnung des Volumens
Das bei der Reaktion entstehende Gas ist Die atomare Masse eines Kohlenstoffdioxid-Moleküls beträgt:
Die Stoffmenge
Reaktionsmechanismus von Ethen zu Polyethen mit starker Säure als Starter
Es handelt sich um eine säurekatalysierte (kationische) Polymerisationsreaktion.
Zuerst lagert sich ein Proton an die C-C-Doppelbindung im Ethen-Molekül an und es bildet sich ein Carbenium-Ion:
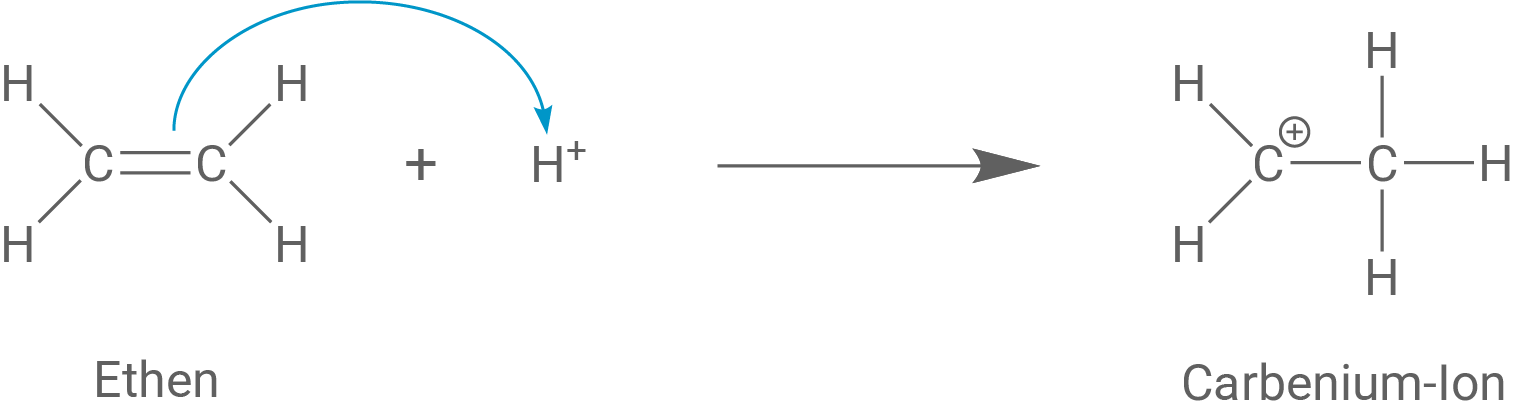
Das entstandene Carbenium-Ion lagert sich nun an die C-C-Doppelbindung eines anderen Monomers an, wodurch ein Dimer entsteht. Das Dimer ist ebenfalls ein Carbenium-Ion.
Das Dimer lagert sich an die C-C-Doppelbindung eines weiteren Monomers an und es entsteht das Trimer.
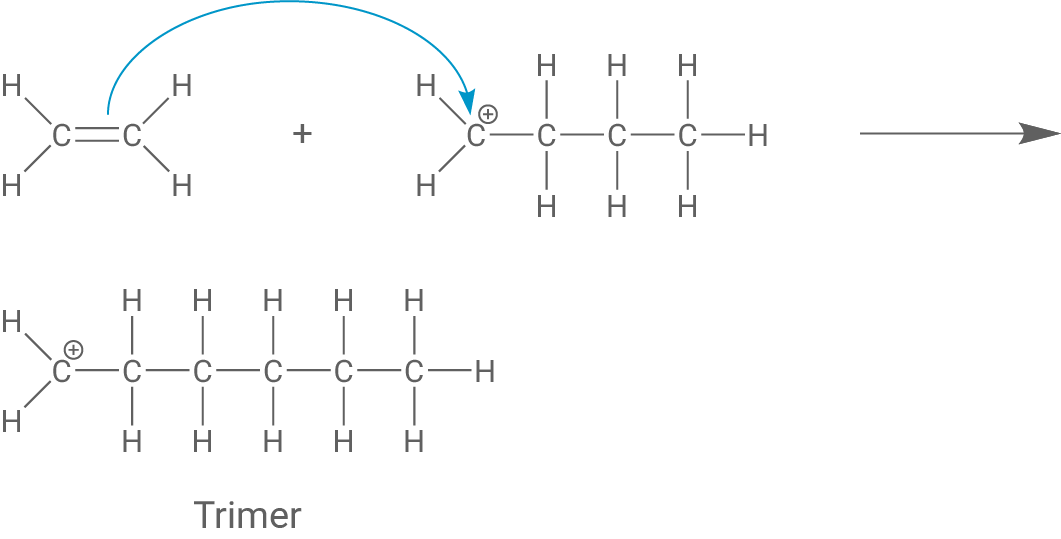
Die Polymerisationsreaktion wird abgebrochen, indem ein Carbenium-Ion ein Proton neben dem positiv geladenen Kohlenstoff-Atom abspaltet, wodurch sich eine C-C-Doppelbindung am Kettenende bildet.
Erörterung der Nachhaltigkeit
Hier können verschiedene Aspekte aufgegriffen werden. Grundsätzlich können Kunststoffverpackungen gesammelt und dem Recycling zugeführt werden. Je „sortenreiner“ ein Kunststoff ist (also idealerweise kein Verbundwerkstoff), desto besser kann er recyclet werden. Bei der neu entwickelten Zahnpastatube handelt es sich nur um einen einzigen Kunststoff (Polyethen), d. h. sie kann gut verwertet werden. Dementsprechend benötigt die Produktion neuer Tuben weniger Rohstoffe und ist energieeffizienter. Auf diese Weise wird mit der neuen Zahnpastatube wirtschaftlich effizient und ökologisch tragfähig im Sinne der Nachhaltigkeit gehandelt.