Vorschlag A – Eigenschaften und Reaktionen von Aldehyden
Aldehyde (Alkanale) gehören zu den Carbonylverbindungen. Sie sind in der organischen Chemie wichtige Stoffe bei chemischen Synthesen. Die Reaktivität der Carbonyl-Gruppe ist die Grundlage für eine Vielzahl an Reaktionsmöglichkeiten, wie beispielsweise Redoxreaktionen, Additionsreaktionen, Polymerisationsreaktionen oder Substitutionsreaktionen.
Im Alltag begegnen uns Aldehyde als Duft-, Aroma- und Geschmacksstoffe. Pentanal ist eine farblose Flüssigkeit mit fruchtigem Geruch, die häufig als Bestandteil in Fruchtaromen verwendet wird.
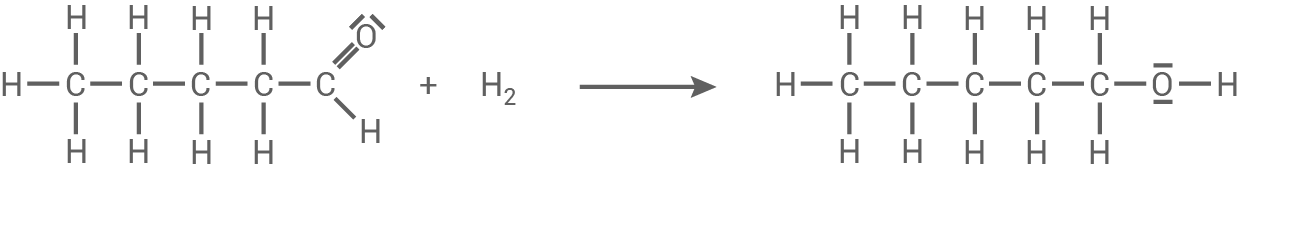
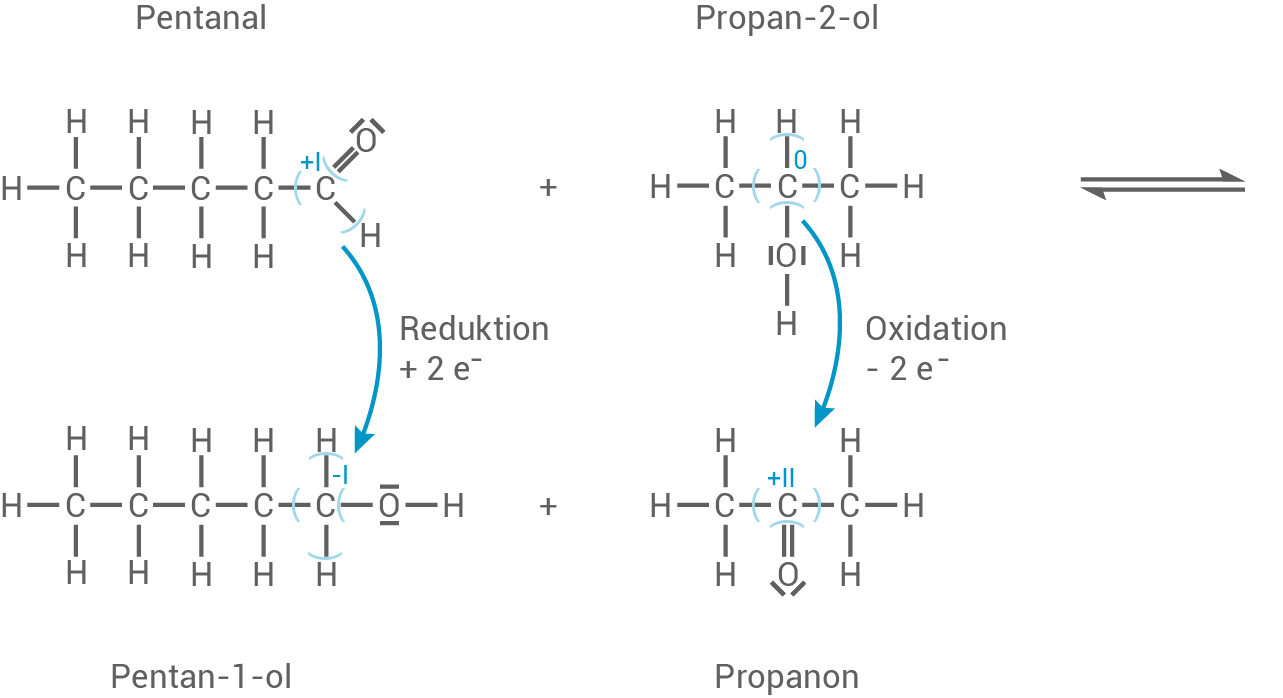
Durch Anlagerung von elementarem Wasserstoff an Aldehyde entstehen primäre Alkohole. Reaktionsweg 2:
Aldehyde können mit Propan-2-ol in einer Gleichgewichtsreaktion zu primären Alkoholen und Propanon reagieren.
Bei der Herstellung des primären Alkohols nach diesem Reaktionsweg wird diskutiert, die Substanz mit der niedrigsten Siedetemperatur abzudestillieren.
1.1
Zu Pentanal gibt es drei weitere isomere Verbindungen, die eine Aldehyd-Gruppe tragen.
Zeichne die Strukturformel von Pentanal sowie die Strukturformeln der drei weiteren Isomere mit Aldehyd-Gruppe und benenne die drei isomeren Verbindungen gemäß der IUPAC-Nomenklatur.
(6 BE)
1.2
Erwärmt man Pentanal mit alkalischer Silbernitrat-Lösung (enthält  -Ionen), beobachtet man einen silberfarbenen Niederschlag an der Reagenzglaswand. Das Pentanal wird in dieser Reaktion oxidiert.
Formuliere für die Reaktion von Pentanal mit alkalischer Silbernitrat-Lösung eine Reaktionsgleichung und benenne das organische Produkt.
Zeige anhand der wesentlichen Oxidationszahlen und der Elektronenübergänge, dass es sich um eine Redoxreaktion handelt.
-Ionen), beobachtet man einen silberfarbenen Niederschlag an der Reagenzglaswand. Das Pentanal wird in dieser Reaktion oxidiert.
Formuliere für die Reaktion von Pentanal mit alkalischer Silbernitrat-Lösung eine Reaktionsgleichung und benenne das organische Produkt.
Zeige anhand der wesentlichen Oxidationszahlen und der Elektronenübergänge, dass es sich um eine Redoxreaktion handelt.
(8 BE)
1.3
Pentanal, Pentan-1-ol und Propan-2-ol unterscheiden sich in ihren Siedetemperaturen (Material 1).
Erkläre unter Verwendung von Strukturformeln die unterschiedlichen Siedetemperaturen.
(7 BE)
1.4
Aus Aldehyden können primäre Alkohole hergestellt werden. Material 2 beschreibt zwei Möglichkeiten hierfür.
Formuliere für den Reaktionsweg 1 die Reaktionsgleichung für die Reaktion von elementarem Wasserstoff mit Pentanal.
Formuliere für den Reaktionsweg 2 die Reaktionsgleichung in Strukturformeln für die Gleichgewichtsreaktion von Pentanal mit Propan-2-ol sowie das dazugehörige Massenwirkungsgesetz.
Zeige anhand der wesentlichen Oxidationszahlen und der Elektronenübergänge, dass es sich dabei um eine Redoxreaktion handelt.
Erkläre, auch mithilfe von Material 1, die Auswirkungen der Destillation im Reaktionsweg 2 auf das chemische Gleichgewicht der Reaktion von Pentanal mit Propan-2-ol.
Hinweis: Die Auswirkung der Temperaturerhöhung bei der Destillation auf das chemische Gleichgewicht kann vernachlässigt werden.
(14 BE)
1.5
In der homologen Reihe der Aldehyde ist Methanal der einfachste Vertreter. Die Verbindung ist bei Zimmertemperatur gasförmig. Für einen Versuch werden  Methanal benötigt.
Berechne die Masse und das Gasvolumen der Stoffmenge von
Methanal benötigt.
Berechne die Masse und das Gasvolumen der Stoffmenge von  Methanal.
Hinweis: Gehe dabei von einem Molvolumen eines Gases von
Methanal.
Hinweis: Gehe dabei von einem Molvolumen eines Gases von  aus.
aus.
(6 BE)
1.6
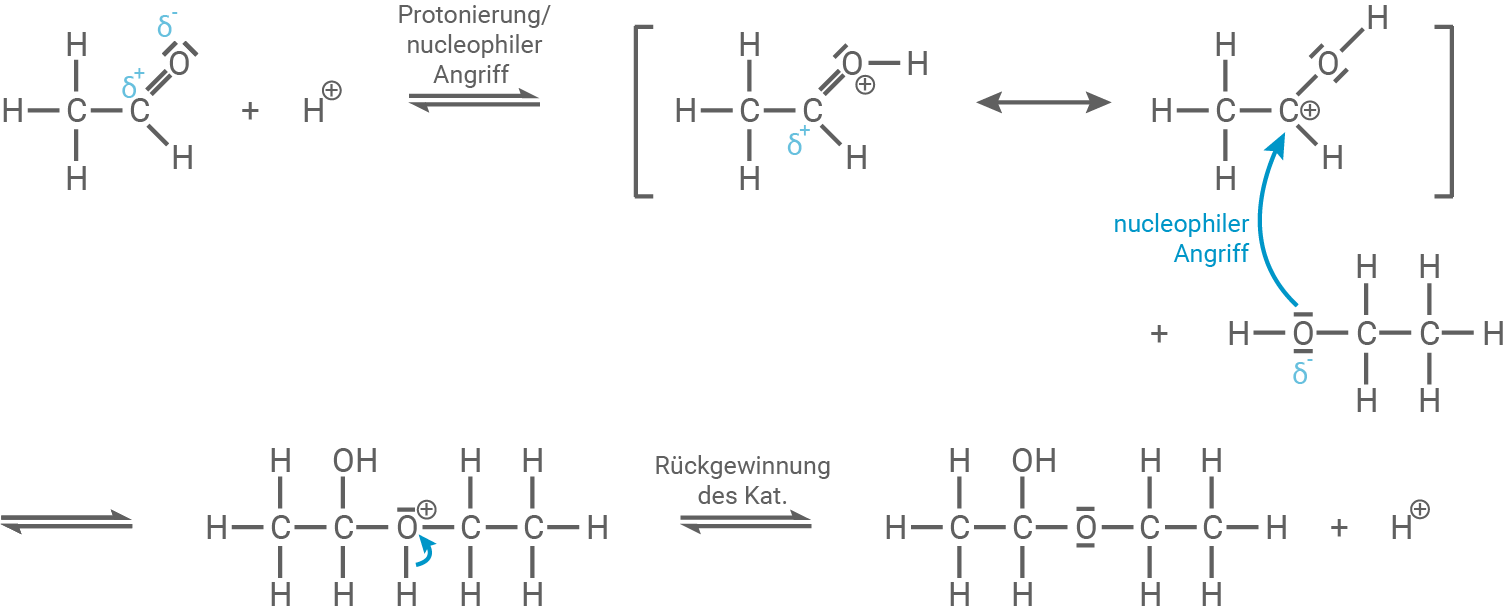
Material 3 beschreibt den Reaktionsmechanismus der säurekatalysierten Reaktion eines Aldehyds mit einem Alkohol zu einem sogenannten Halbacetal am Beispiel der Reaktion von Ethanal mit Ethanol.
Formuliere in Strukturformeln den Reaktionsmechanismus für die in Material 3 beschriebene Reaktion.
Begründe, dass es sich bei dieser Reaktion um eine nucleophile Additionsreaktion handelt.
(9 BE)
(50 BE)
Material 1
Siedetemperaturen einiger organischer Verbindungen
| Verbindung | Siedetemperatur |
|---|---|
| Propan-2-ol | |
| Propanal | |
| Propanon | |
| Pentan-1-ol | |
| Pentanal | |
| Pentan-3-on |
Material 2
Reaktion von Aldehyden zu primären Verbindungen
Reaktionsweg 1:Durch Anlagerung von elementarem Wasserstoff an Aldehyde entstehen primäre Alkohole. Reaktionsweg 2:
Aldehyde können mit Propan-2-ol in einer Gleichgewichtsreaktion zu primären Alkoholen und Propanon reagieren.
Bei der Herstellung des primären Alkohols nach diesem Reaktionsweg wird diskutiert, die Substanz mit der niedrigsten Siedetemperatur abzudestillieren.
Material 3
Reaktionsmechanismus für die Reaktion zu einem Halbacetal
Für die säurekatalysierte Reaktion eines Aldehyds mit einem Alkohol zu einem sogenannten Halbacetal lässt sich der folgende mehrschrittige Reaktionsmechanismus formulieren:- In Schritt 1 lagert sich ein Proton an die Aldehyd-Gruppe des Ethanals an, es entsteht ein Carbenium-Ion.
- Im zweiten Reaktionsschritt greift das Sauerstoff-Atom der Hydroxy-Gruppe des Ethanols am Carbenium-Ion an, es entsteht ein Zwischenprodukt mit einer positiven Ladung an einem Sauerstoff-Atom.
- Im dritten und letzten Schritt spaltet sich vom Zwischenprodukt ein Proton ab, das Halbacetal liegt nun vor.
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Strukturformeln und Benennung nach der IUPAC-Nomenklatur
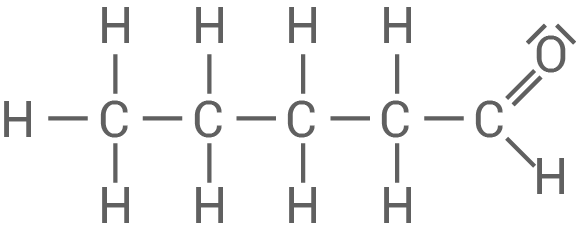
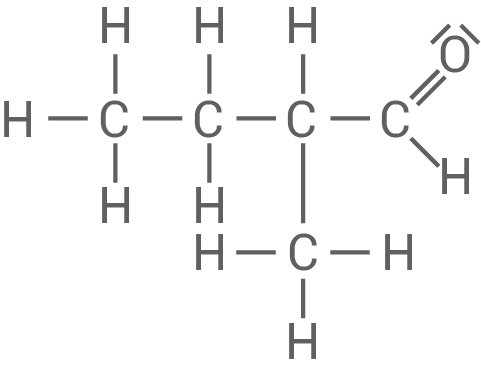
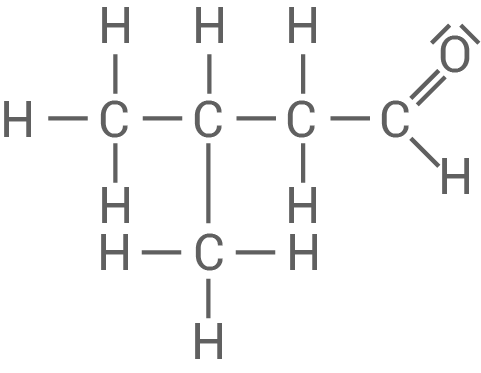
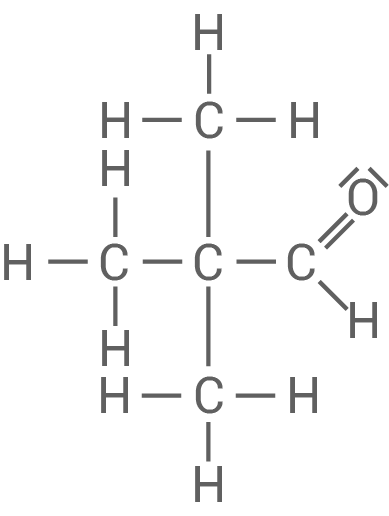

Pentanal

2-Methylbutanal

3-Methylbutanal

2,2-Dimethylpropanal
1.2
Formulierung der Reaktionsgleichung
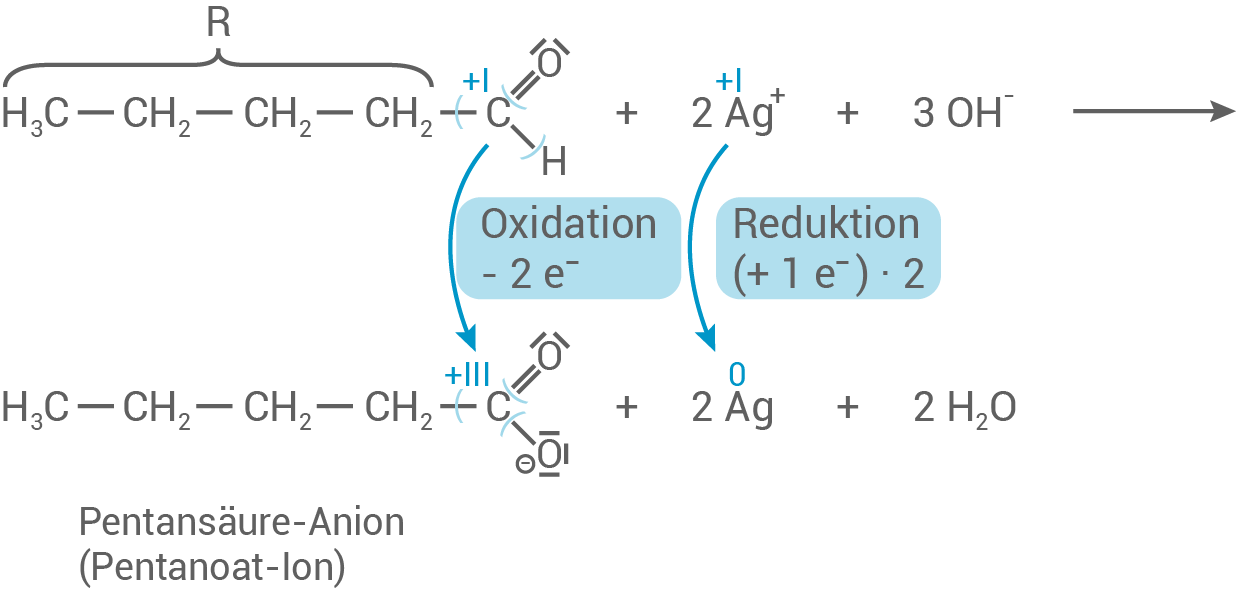

Reaktion von Pentanal mit einer alkalischen Silbernitrat-Lösung, inklusive der wesentlichen Oxidationszahlen und Elektronenübergänge
- Bei dem organischen Produkt handelt es sich um das Pentansäure-Anion (Pentanoat-Ion; Carboxylat-Ion der Pentansäure).
- Die Oxidationszahlen zeigen, dass es sich um eine Redoxreaktion handelt.

1.3
Darstellung der Strukturformeln
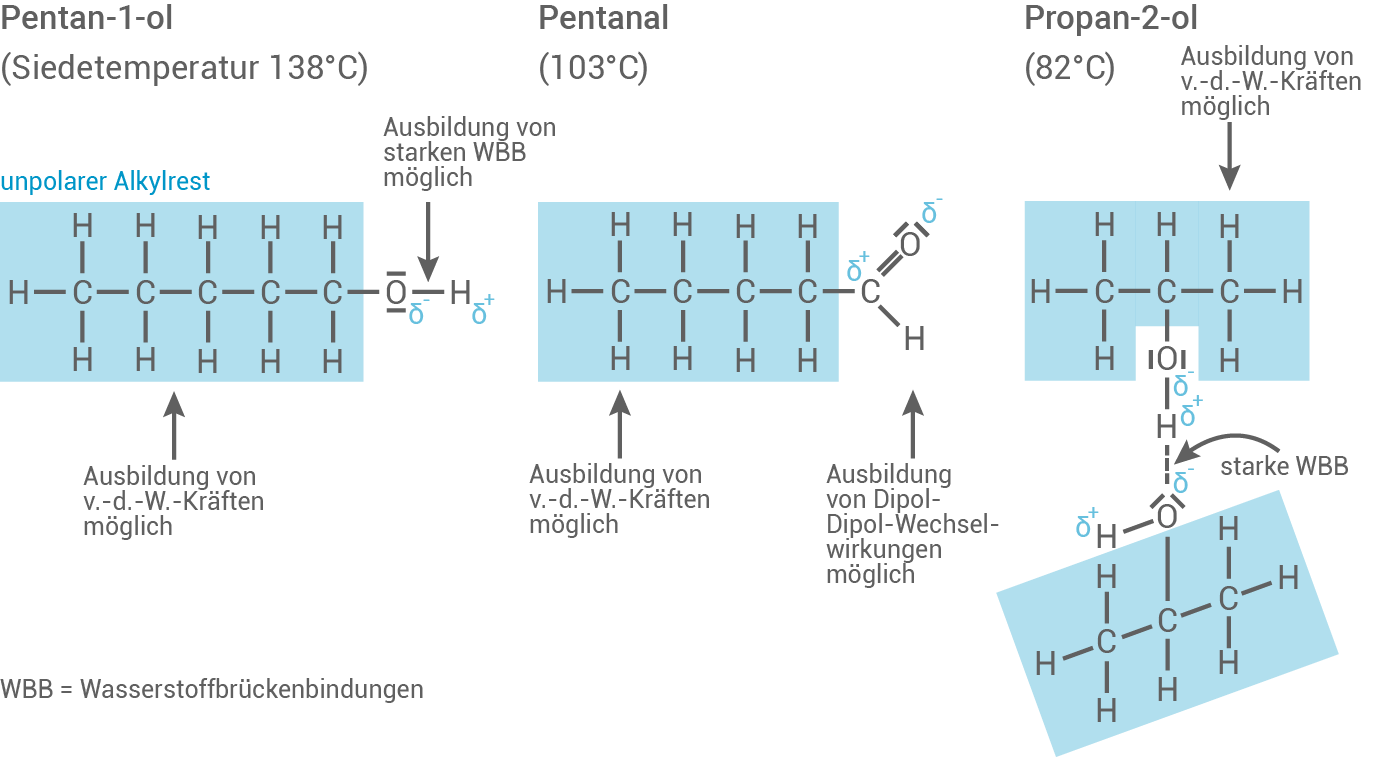

- Siedetemperaturen sind abhängig von zwischenmolekularen Kräften und Wechselwirkungen – Je stärker diese sind, desto mehr Energie wird benötigt, um diese zu überwinden und demnach ist auch die Siedetemperatur höher.
- Zwischen den Propan-2-ol-Molekülen bilden die polaren Hydroxygruppen starke Wasserstoffbrückenbindungen aus und zwischen den unpolaren Alkylresten wirken schwache VAN-DER-WAALS-Kräfte. Allerdings besitzt Propan-2-ol die geringste Kettenlänge und damit die kleinste Oberfläche, weswegen im Vergleich zu den anderen Molekülen weniger VAN-DER-WAALS-Kräfte wirken und damit auch die Siedetemperatur geringer ist.
- Die Pentan-1-ol-Moleküle bilden untereinander ebenfalls Wasserstoffbrückenbindungen aus und es wirken VAN-DER-WAALS-Kräfte zwischen den unpolaren Alkylresten. Dieser unpolare Rest ist bei Pentan-1-ol größer als bei Propan-2-ol, also wirken mehr VAN-DER-WAALS-Kräfte und die Siedetemperatur ist höher.
- Auch beim Pentanal wirken VAN-DER-WAALS-Kräfte zwischen den unpolaren Alkylresten. Diese sind größer als beim kompakten Propan-2-ol. Allerdings weist Pentanal im Gegensatz zu den beiden Alkanolen keine polare Hydroxy-Gruppe auf, sondern eine polare Aldehyd-Gruppe. Das bedeutet, die Moleküle bilden untereinander keine Wasserstoffbrückenbindungen aus, aber es wirken Dipol-Dipol-Wechselwirkungen zwischen den Aldehyd-Gruppen.
- Bei der Betrachtung der molaren Massen fällt auf, dass Pentan-1-ol und Pentanal sich kaum unterscheiden. Pentan-1-ol hat also eine höhere Siedetemperatur, da die ausgebildeten Wasserstoffbrückenbindungen stärker sind als die schwachen Dipol-Dipol-Wechselwirkungen des Pentanals.
1.4
Reaktionsgleichung für den 1. Reaktionsweg
 Reaktionsgleichung für den 2. Reaktionsweg
Reaktionsgleichung für den 2. Reaktionsweg
 Massenwirkungsgesetz
Massenwirkungsgesetz
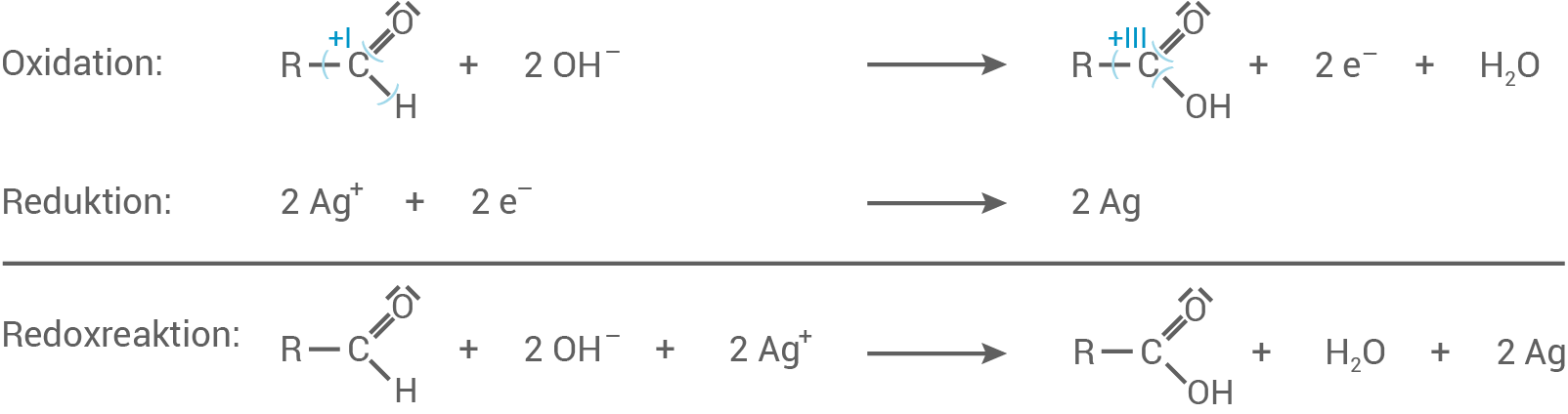
 Redoxreaktion
Redoxreaktion


- Die Änderung der Oxidationszahlen zeigen, dass es sich um eine Redoxreaktion handelt.
- Das Kohlenstoff-Atom der Aldehyd-Gruppe nimmt zwei Elektronen auf und wird somit reduziert: +I
-I
- Das C-2-Atom des Propan-2-ols gibt zwei Elektronen ab und wird damit oxidiert: 0
+II
- Im 2. Reaktionsweg hat Propanon die niedrigste Siedetemperatur
- Wird nun die Temperatur des Stoffgemischs erhöht, siedet Propanon also schon bei
und es entweicht als gasförmiger Stoff in einem offenen System.
- Dadurch wird dieses Produkt aus dem Stoffgemisch entfernt – es wird ein Zwang auf das System ausgeübt.
- Nach dem Prinzip von LE CHATELIER und BRAUN (Prinzip des kleinsten Zwangs) wird dieser äußere Zwang ausgeglichen, in dem mehr Edukte zu Produkten reagieren.
- Das entweichende Propanon wird nachgebildet.
- In der chemischen Industrie kann so die Ausbeute von Propanon (Aceton) erhöht werden.
1.5
Berechnung von Masse und Gasvolumen
Gegeben ist die Stoffmenge  und ein Molvolumen von
und ein Molvolumen von  Die Masse lässt sich berechnen mit:
Die Masse lässt sich berechnen mit:
![\(\begin{array}[t]{rll}
m &=& M \cdot n& \\[5pt]
&=& 30 \,\text g \cdot\,\text{mol} ^{-1} \cdot 1,75 \,\text{mol} \\[5pt]
&=& 52,5 \,\text g
\end{array}\)](https://www.schullv.de/resources/formulas/25e8cd23ac83099319fe7adca07af8c00fd0df72b716025e40ce906d6fb84bc9_light.svg) Für das Gasvolumen folgt:
Für das Gasvolumen folgt:
![\(\begin{array}[t]{rll}
V &=& n \cdot V_m& \\[5pt]
&=& 1,75 \,\text{mol} \cdot 22,4 \,\text L \cdot\,\text{mol} ^{-1} \\[5pt]
&=& 39,2 \,\text L
\end{array}\)](https://www.schullv.de/resources/formulas/fd3334b0e9f3786152de9b4d1d8d042fce807026a2d11a9309fb7d4a0690d783_light.svg)
1.6
Strukturformeln für die Reaktion zu einem Halbacetal
 Begründung für eine Additionsreaktion
Begründung für eine Additionsreaktion

- Es handelt sich hier um eine nucleophile Addition.
- Zuerst greift das schwache Nucleophil Ethanol das
-Atom der Carboxyl-Gruppe an. Dieses
-Atom ist aufgrund der Protonierung stark positiv polarisiert (siehe mesomere Grenzformeln).
- Hier reagieren Ethanol und Ethanal zu einem Produkt
1-Ethoxyethanol.
- Das Produkt ist ein Halbacetal.