Vorschlag B – Propan und Propanon
Propan und Propanon sind zwei Grundchemikalien der chemischen Industrie. Im Alltag kommt Propan beispielsweise als Feuerzeuggas zum Einsatz, wird aber auch zum Befeuern von Gasgrills verwendet. Propanon wird z. B. in Nagellackentfernern als Lösungsmittel eingesetzt.
Propan kann als Ausgangsstoff zur Propanon-Synthese verwendet werden. Dabei reagiert Propan über Zwischenprodukte wie 2-Chlorpropan und Propan-2-ol zu Propanon. Auch aus Propin kann Propanon hergestellt werden.
Material 1 zeigt verschiedene Reaktionen ausgehend von Propan.
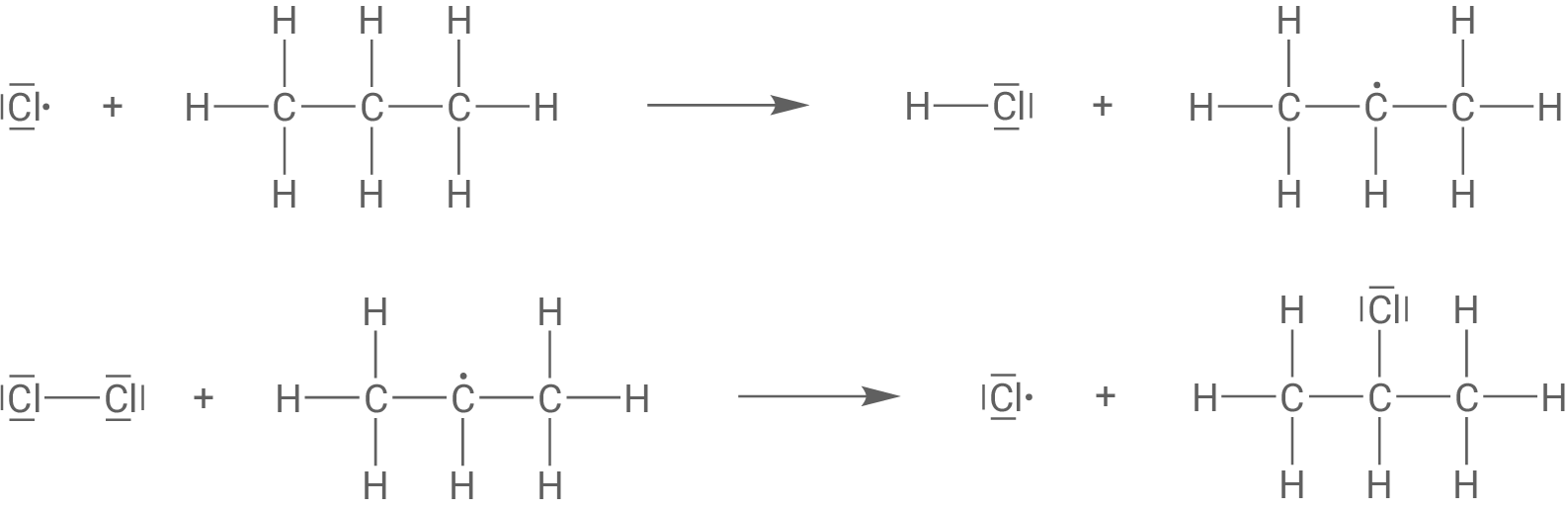
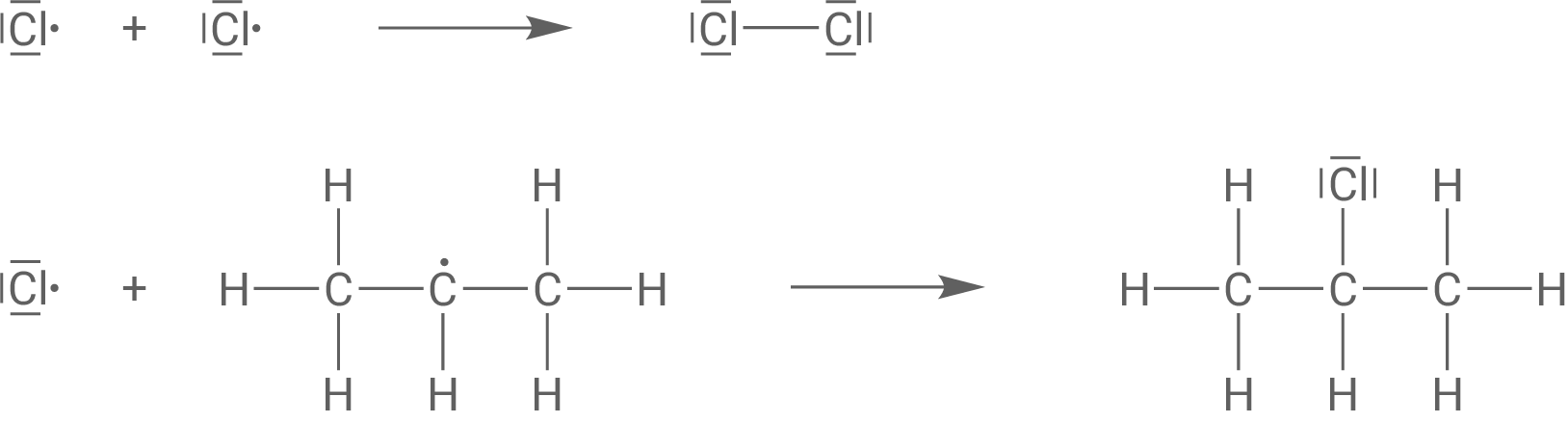
Formuliere und benenne den Reaktionsmechanismus der Reaktion von Propan mit Chlor zu 2-Chlorpropan einschließlich zweier Abbruchreaktionen.
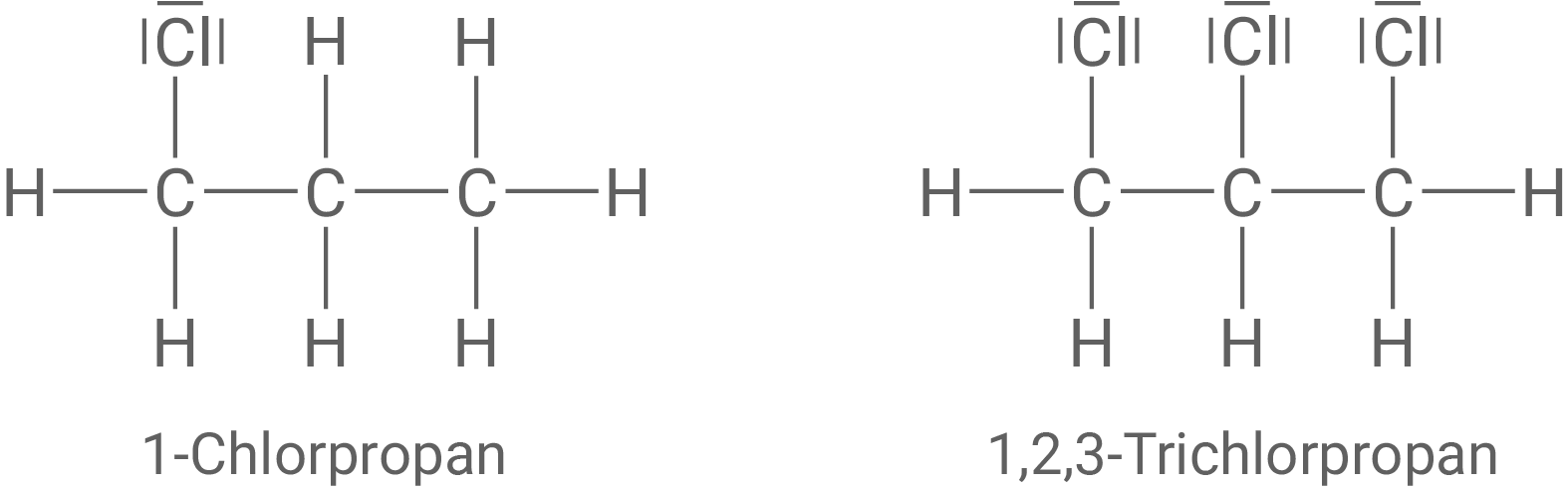
Zeichne die Strukturformeln von 1-Chlorpropan und 1,2,3-Trichlorpropan und erläutere die Entstehung dieser Nebenprodukte bei der oben beschriebenen Reaktion von Propan mit Chlor.
Formuliere eine Reaktionsgleichung für die Reaktion von 2-Chlorpropan zu Propan-2-ol in einer alkalischen Lösung und benenne den Reaktionsmechanismus.
Berechne die Konzentration (in ) einer wässrigen Lösung von 2-Chlorpropan, in der
in
gelöst vorliegen.
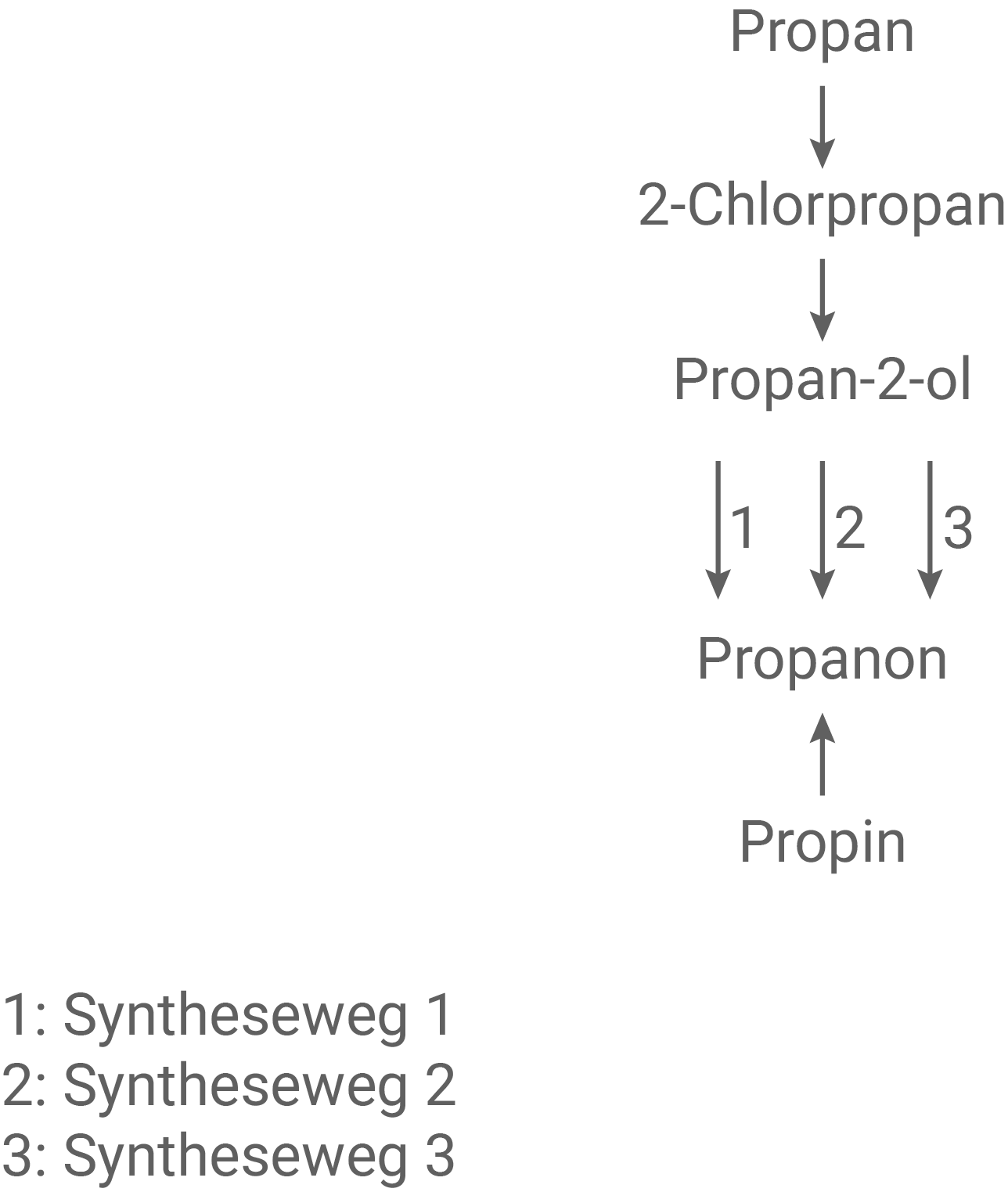
Propanon kann aus Propan-2-ol über verschiedene Reaktionswege hergestellt werden (Material 1 und 2).
Formuliere für die Reaktionen der Synthesewege 1, 2, 3 (Material 2) jeweils eine Reaktionsgleichung in Strukturformeln für die organischen Moleküle.
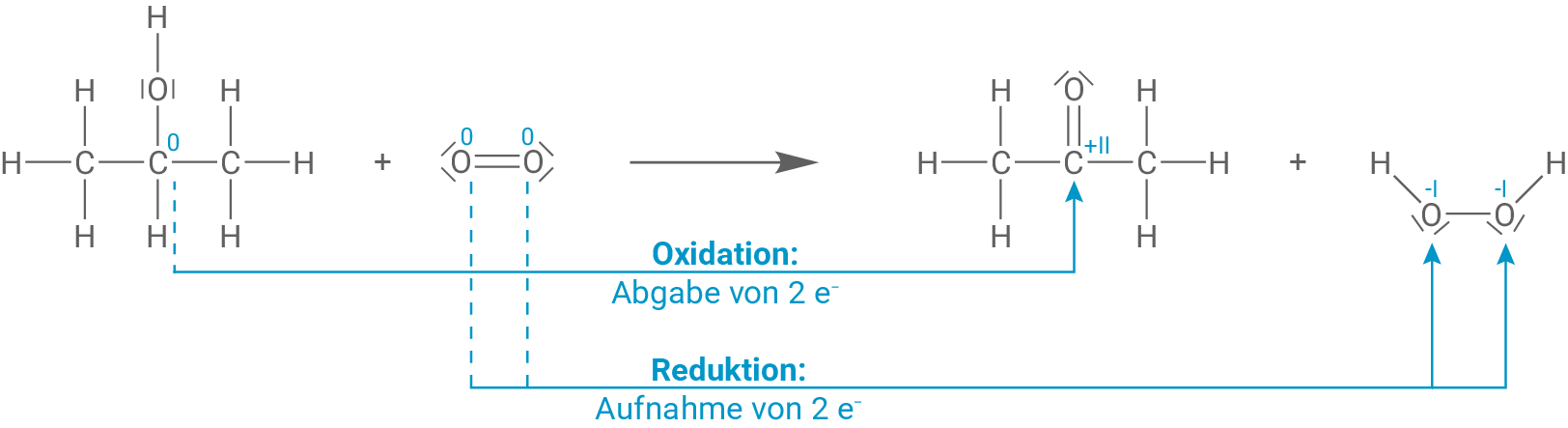
Zeige mithilfe der wesentlichen Oxidationszahlen und der Elektronenübergänge, dass es sich bei der Reaktion von Syntheseweg 3 um eine Redoxreaktion handelt.
Beschreibe die Durchführung und die Beobachtung für einen Nachweis von Wasser.
Bei allen Reaktionen der in Material 2 beschriebenen Synthesewege handelt es sich um Gleichgewichtsreaktionen. Syntheseweg 1 verläuft endotherm, Syntheseweg 2 hingegen exotherm. Zur Erhöhung der Ausbeute an Produkten wird der Vorschlag gemacht, für beide Synthesen die Temperatur zu erhöhen.
Formuliere für Syntheseweg 1 das auf der Reaktionsgleichung basierende Massenwirkungsgesetz.
Erkläre jeweils den Einfluss einer Temperaturerhöhung bei gleichbleibendem Druck auf die Ausbeute an Propanon für die Reaktionen der Synthesewege 1 und 2.
Die vier Verbindungen Propanon, Propan-2-ol, Propan und 1,2,3-Trichlorpropan unterscheiden sich in ihren Siedetemperaturen (Material 3).
Ordne Propanon, Propan-2-ol und Propan jeweils eine Siedetemperatur zu (Material 3) und begründe deine Zuordnung.
Erkläre, dass 1,2,3-Trichlorpropan die höchste Siedetemperatur der vier in Material 3 gegebenen Verbindungen hat.
Eine weitere Möglichkeit zur Herstellung von Propanon besteht in der Reaktion von Propin mit Wasser (Material 4).
Entwickle für die ersten drei in Material 4 beschriebenen Schritte einen Reaktionsmechanismus und zeige, wie in Schritt 4 die Protonenwanderung abläuft.
Benenne den Teil des Reaktionsmechanismus, der in den Schritten 1 bis 3 dargestellt ist.
Material 1
Synthesewege
Material 2
Vom Propan-2-ol zum Propanon
Syntheseweg 1: Dehydrierung
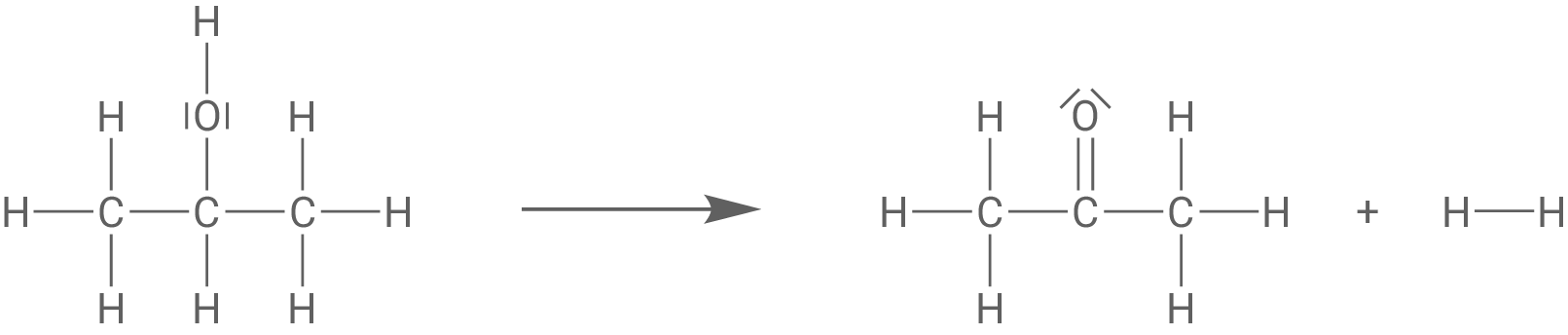
Propan-2-ol reagiert in Anwesenheit eines Katalysators zu Propanon und Wasserstoff.
(Der Katalysator soll beim Formulieren der Reaktionsgleichung nicht betrachtet werden.)
Syntheseweg 2: Oxidative Dehydrierung
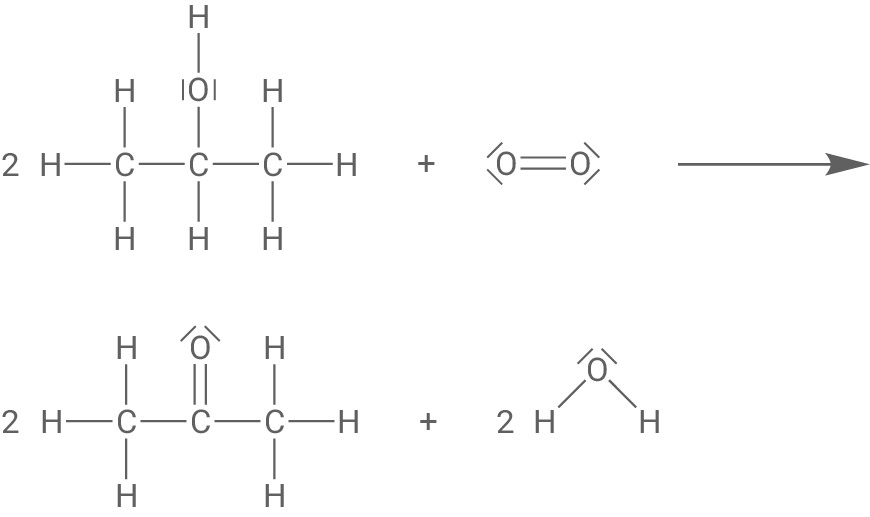
Propan-2-ol reagiert mit Sauerstoff in Anwesenheit eines Katalysators zu Propanon und Wasser.
(Der Katalysator soll beim Formulieren der Reaktionsgleichung nicht betrachtet werden.)
Syntheseweg 3: Flüssigphasen-Oxidation
Propan-2-ol reagiert mit Sauerstoff zu Propanon und Wasserstoffperoxid
Material 3
Siedetemperaturen von vier verschiedenen Verbindungen
In der Tabelle sind die Siedetemperaturen der vier Verbindungen Propanon, Propan-2-ol, Propan und 1,2,3-Trichlorpropan angegeben (nicht sortiert).| Verbindung | Siedetemperatur |
|---|---|
| A | |
| B | |
| C | |
| D 1,2,3-Trichlorpropan |
Material 4
Alternative Synthese von Propanon: Ein Reaktionsmechanismus in vier Schritten
Propanon kann auch durch die Reaktion von Propin mit Wasser gewonnen werden. Nachfolgend ist der Reaktionsmechanismus dieser Reaktion in vier Schritten beschrieben.| Schritt 1: | Am C1-Atom des Propin-Moleküls |
| Schritt 2: | Am Carbenium-Ion greift ein Wasser-Molekül an und es bildet sich ein Oxonium-Ion (Molekül mit positiv geladenem Sauerstoff-Atom) aus. |
| Schritt 3: | Durch Abspaltung eines Protons entsteht ein sogenanntes Alkenol (Alkohol mit C-C-Doppelbindung). |
| Schritt 4: | Im letzten Schritt erfolgt innerhalb des Moleküls eine Protonenwanderung, sodass aus dem Alkenol dann Propanon entsteht. |
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Startreaktion:
Ein Chlor-Molekül wird homolytisch gespalten, wobei zwei Chlor-Radikale entstehen.

Kettenreaktion:
Ein Chlor-Radikal reagiert mit einem Propan-Molekül zu einem Chlorwasserstoff-Molekül und einem Propyl-Radikal. Das entstandene Propyl-Radikal reagiert dann mit einem weiteren Chlor-Molekül zu einem 2-Chlorpropan-Molekül, wobei wiederum ein Chlor-Radikal entsteht.
Abbruchreaktionen:
Wenn zwei Radikale miteinander reagieren, kommt es zu einer Abbruchreaktion. Beispielsweise können zwei Chlor-Radikale wieder zu einem Chlor-Molekül reagieren oder ein Chlor-Radikal reagiert mit einem Propyl-Radikal zu einem 2-Chlorpropan-Molekül. (Alternativ können auch zwei Propyl-Radikale miteinander reagieren.)
Benennung des Reaktionsmechanismus
Radikalische Substitution
Strukturformeln der Nebenprodukte und Erläutern ihrer Entstehung
Reaktionsgleichung der Reaktion von 2-Chlorpropan zu Propan-2-ol in alkalischer Lösung
Benennung des Reaktionsmechanismus
Nucleophile Substitution
Berechnung der Konzentration einer wässrigen Lösung von 2-Chlorpropan
Die Konzentration wird mithilfe der Stoffmenge
und des Volumens
berechnet:
Reaktionsgleichungen mit Strukturformeln für Synthesewege 1 und 2
Syntheseweg 1: Propan-2-ol reagiert (in Anwesenheit eines Katalysators) zu Propanon und Wasserstoff.
Syntheseweg 2: Propan-2-ol reagiert (in Anwesenheit eines Katalysators) mit Sauerstoff zu Propanon und Wasser.
Reaktionsgleichung für Syntheseweg 3 und Zeigen der Redoxreaktion
Propan-2-ol reagiert zu dem Keton Propanon. Dabei ändert das Kohlenstoff-Atom der Alkohol-Gruppe (C2-Atom) seine Oxidationszahl von 0 zu +II in der Keton-Gruppe, d. h. es wird oxidiert und gibt zwei Elektronen ab. Die Sauerstoff-Atome des Sauerstoff-Moleküls ändern ihre Oxidationszahl von 0 zu −I im Wasserstoffperoxid-Molekül. Sie nehmen jeweils ein Elektron auf und werden somit reduziert.
Beschreibung der Durchführung und Beobachtung für einen Nachweis von Wasser
Man leitet das entstehende Wasser über wasserfreies Kupfersulfat. Das weiße, wasserfreie Kupfersulfat färbt sich daraufhin bei Wasserkontakt blau.
Hinweis: Auch eine andere geeignete Nachweisreaktion kann hier beschrieben werden.
Formulieren des Massenwirkungsgesetzes für die Reaktion von Syntheseweg 1
Erklärung des Einflusses einer Temperaturerhöhung auf die Ausbeute an Propanon
Syntheseweg 1: Die Reaktion von Propan-2-ol zu Propanon und Wasserstoff ist endotherm, folglich steigt bei einer Temperaturerhöhung der Umsatz der Edukte und damit die Ausbeute an Propanon. Das Gleichgewicht verschiebt sich bei einer Temperaturerhöhung auf die Produktseite. Nach dem Prinzip des kleinsten Zwangs (Le Chatelier) fördert eine Temperaturerhöhung die endotherme Hinreaktion.
Syntheseweg 2: Die Reaktion von Propan-2-ol mit Sauerstoff zu Propanon und Wasser ist exotherm, folglich sinkt bei einer Temperaturerhöhung der Umsatz der Edukte und damit die Ausbeute an Propanon. Das Gleichgewicht verschiebt sich bei einer Temperaturerhöhung auf die Eduktseite. Eine Temperaturerhöhung fördert also die endotherme Rückreaktion.
| Verbindung A: | Propan mit der Siedetemperatur −42 °C |
| Verbindung B: | Propanon mit der Siedetemperatur 56 °C |
| Verbindung C: | Propan-2-ol mit der Siedetemperatur 82 °C |
Begründung der Zuordnung
Je mehr Energie aufgewendet werden muss, um die zwischenmolekularen Interaktionen zu brechen, desto höher ist die Siedetemperatur eines Stoffes.
Propan hat die niedrigste Siedetemperatur, da zwischen den unpolaren Molekülen nur die verhältnismäßig schwachen Van-der-Waals-Kräfte wirken. Bei den zwei anderen Verbindungen wirken durch die funktionellen Gruppen noch andere intermolekulare Kräfte, wodurch sie eine höhere Siedetemperatur aufweisen.
Propanon hat eine höhere Siedetemperatur, da zwischen den Propanon-Molekülen neben den schwachen Van-der-Waals-Kräfte auch Dipol-Dipol-Kräfte durch die Keton-Gruppen wirken.
Propan-2-ol weist eine noch höhere Siedetemperatur auf, weil neben den schwachen Van-der-Waals-Kräften zusätzlich Wasserstoffbrücken zwischen den Hydroxy-Gruppen der Propan-2-ol-Moleküle ausgebildet werden können. Da Wasserstoffbrücken stärker als Dipol-Dipol-Wechselwirkungen sind, hat Propan-2-ol eine höhere Siedetemperatur als Propanon.
Erklärung der höchsten Siedetemperatur von 1,2,3-Trichlorpropan
1,2,3-Trichlorpropan hat die höchste Siedetemperatur der vier Verbindungen, weil die 1,2,3-Trichlorpropan-Moleküle durch die drei Chlor-Atome stark polarisiert werden und somit zwischen den Molekülen insgesamt starke Dipol-Dipol-Wechselwirkungen gebildet werden können. Dadurch sind die zwischenmolekularen Kräfte der 1,2,3-Trichlorpropan-Moleküle insgesamt am größten.
Hinweis: Bei der Betrachtung der vier Verbindungen im Vergleich kann alternativ auch mit der unterschiedlichen Masse argumentiert werden.
Reaktionsmechanismus für die ersten drei Schritte der Reaktion von Propin mit Wasser zu Propanon
Schritt 1:
Ein Proton lagert sich an das C1-Atom des Propin-Moleküls an, wodurch ein Carbenium-Ion mit C-C-Doppelbindung entsteht und positiv geladenem C2-Atom entsteht.
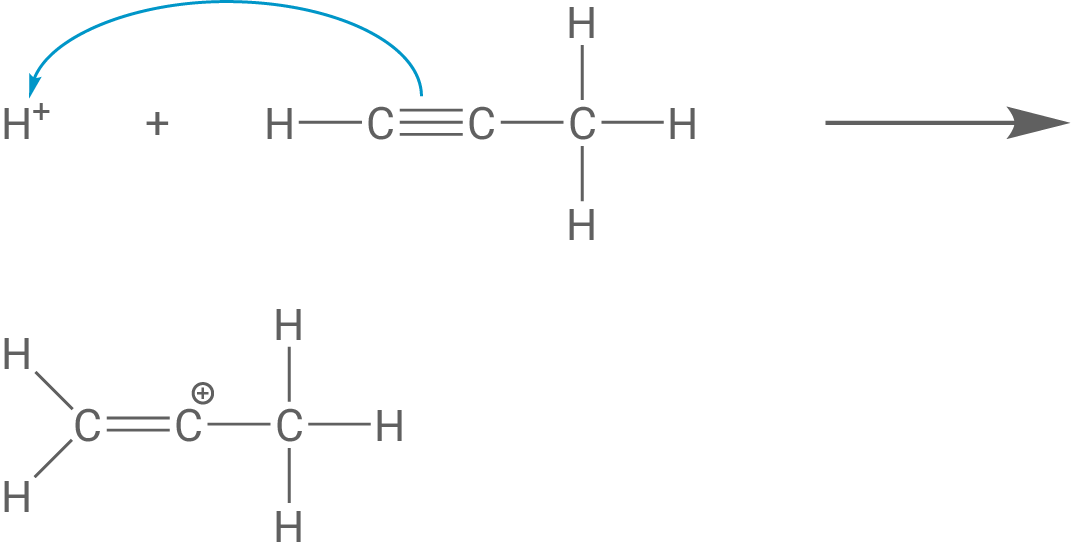
Schritt 2:
Im nächsten Schritt greift ein freies Elektronenpaar des Sauerstoff-Atoms eines Wasser-Moleküls das Carbenium-Ion nucleophil an und es bildet sich ein Oxonium-Ion.
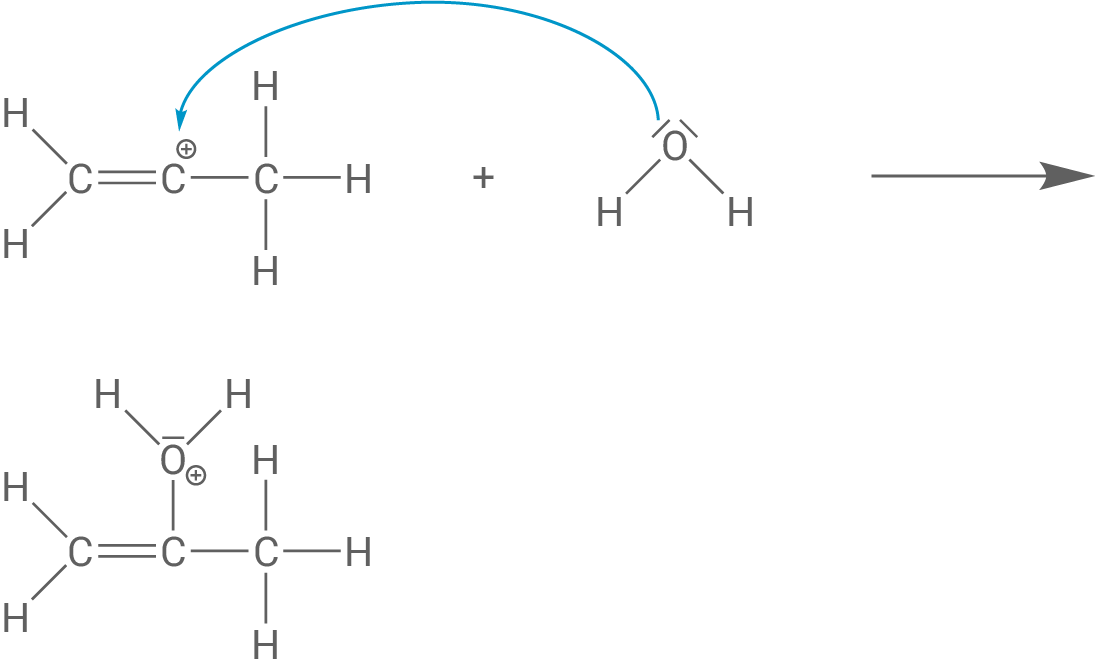
Schritt 3:
Ein an das positiv geladene Sauerstoff-Atom gebundene Proton wird abgespalten. Es entsteht ein Propen-2-ol-Molekül.
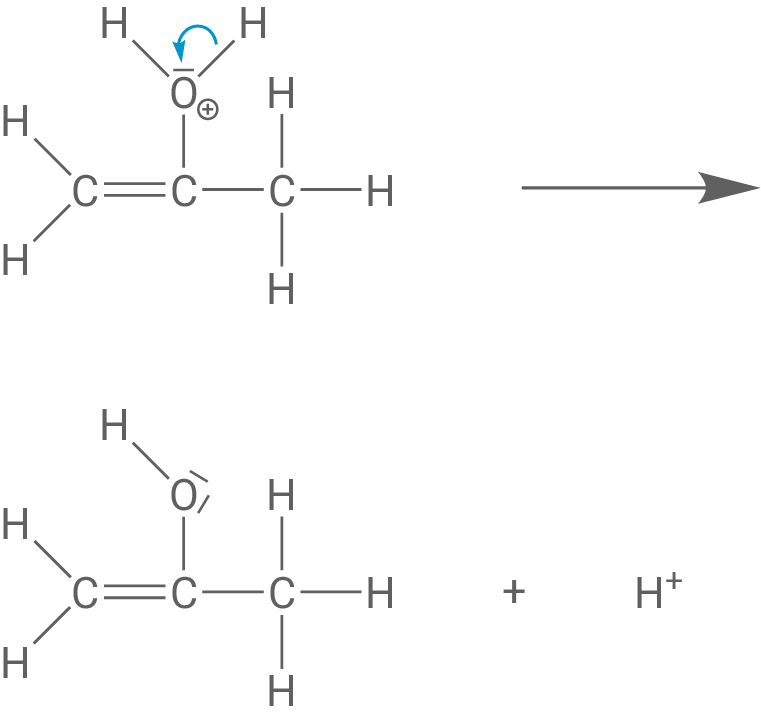
Protonenwanderung in Schritt 4
Es findet eine Umlagerung des Protons der Hydroxy-Gruppe des Propen-2-ols statt: Es lagert sich unter Auflösung der C-C-Doppelbindung an das C1-Atom um und ein freies Elektronenpaar des O-Atoms bildet die Doppelbindung zwischen dem C- und dem O-Atom des Propanons aus.
Benennung des Reaktionsmechanismus der Schritte 1-3
Elektrophile Addition