Vorschlag C – Ethenylacetat
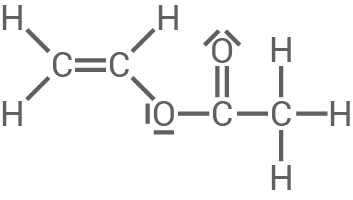
Ethenylacetat (Vinylacetat, Material 1) ist eine farblose, süßlich riechende Flüssigkeit, deren großtechnische Synthese durch die Umsetzung von Ethansäure mit Ethen in Gegenwart von Sauerstoff erfolgt.
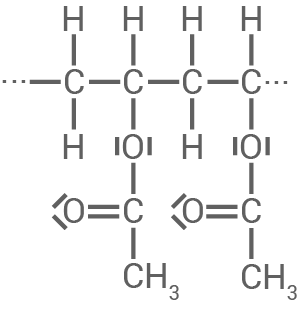
Bei Ethenylacetat handelt es sich um ein wichtiges Monomer zur Synthese des Kunststoffs Polyvinylacetat (Material 2), der unter anderem in Bastelkleber enthalten ist.
Polyvinylacetat kann weiter modifiziert werden, indem der Kunststoff z. B. mit alkalischen Lösungen versetzt wird. Dadurch können weitere Kunststoffe mit neuen Eigenschaften erzeugt werden.
Polyvinylacetat kann weiter modifiziert werden, indem der Kunststoff z. B. mit alkalischen Lösungen versetzt wird. Dadurch können weitere Kunststoffe mit neuen Eigenschaften erzeugt werden.
3.1
Ethansäure reagiert mit Ethen und Sauerstoff in einer exothermen Reaktion zu Ethenylacetat (Vinylacetat, Material 1) und Wasser.
Formuliere die Reaktionsgleichung für die oben beschriebene Gleichgewichtsreaktion und das darauf basierende Massenwirkungsgesetz.
Nenne die Aussage des Prinzips vom kleinsten Zwang.
Begründe sowohl den Einfluss einer Temperaturerhöhung als auch den Einfluss einer Konzentrationserhöhung von Ethansäure auf die Lage des chemischen Gleichgewichts und damit auf die Ausbeute an Ethenylacetat.
(12 BE)
3.2
Ethenylacetat (Vinylacetat, Material 1) reagiert mit einem Peroxid  als Starter in einer radikalischen Polymerisation zu Polyvinylacetat (Material 2).
Formuliere für diese Reaktion den Reaktionsmechanismus inklusive zweier Abbruchreaktionen.
als Starter in einer radikalischen Polymerisation zu Polyvinylacetat (Material 2).
Formuliere für diese Reaktion den Reaktionsmechanismus inklusive zweier Abbruchreaktionen.
(8 BE)
3.3
Polyvinylacetat (Material 2) kann in alkalischen Lösungen chemisch verändert werden. Nach Reaktion mit den Hydroxid-Ionen liegen ein veränderter Kunststoff und ein weiteres organisches Produkt vor.
Formuliere für die oben genannte Reaktion den Reaktionsmechanismus.
Hinweis
Für den Reaktionsmechanismus nicht relevante Molekülteile können mit und
und  abgekürzt werden.
Benenne den Reaktionsmechanismus und die funktionellen Gruppen der beiden Produkte.
Entwickle basierend auf dem Molekülausschnitt in Material 2 einen Ausschnitt des auf diese Weise entstandenen Kunststoffs.
abgekürzt werden.
Benenne den Reaktionsmechanismus und die funktionellen Gruppen der beiden Produkte.
Entwickle basierend auf dem Molekülausschnitt in Material 2 einen Ausschnitt des auf diese Weise entstandenen Kunststoffs.
Für den Reaktionsmechanismus nicht relevante Molekülteile können mit
(10 BE)
3.4
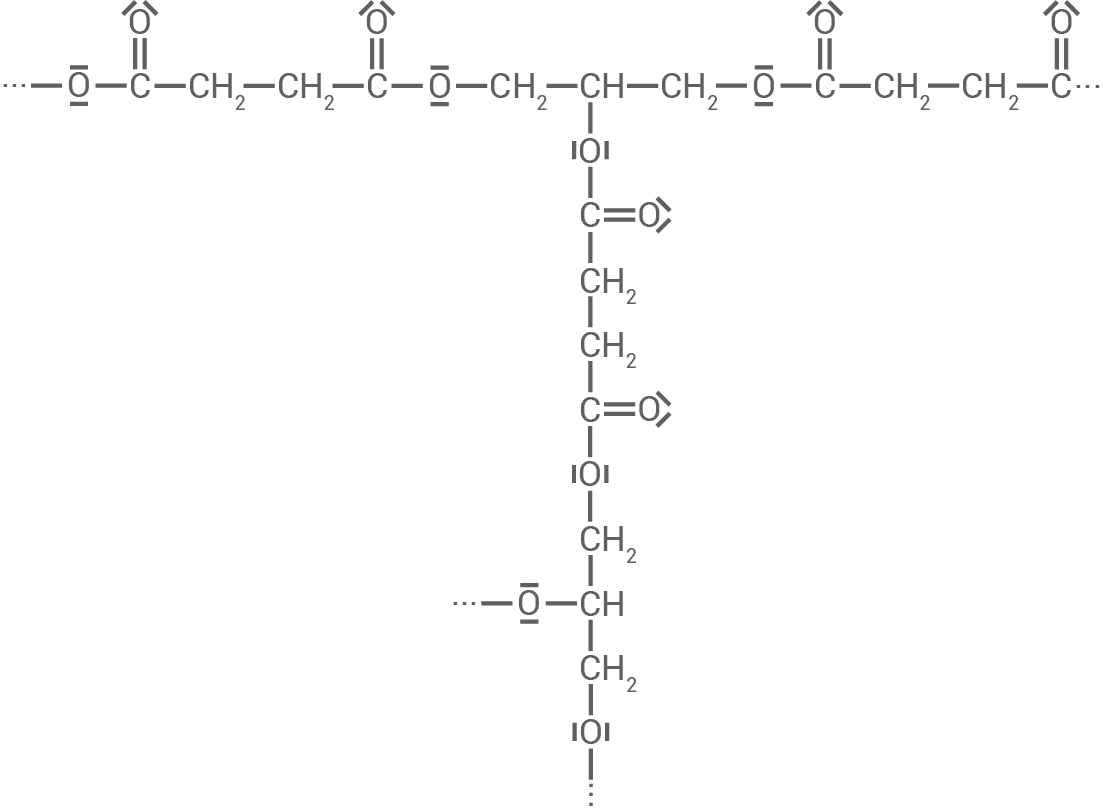
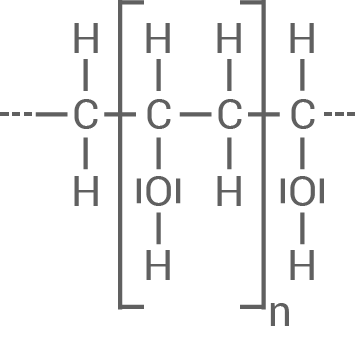
Material 3 zeigt einen Ausschnitt aus einem weiteren Kunststoff. Dieser Kunststoff unterscheidet sich in seinen Eigenschaften von Polyvinylacetat (Material 2).
Ordne die beiden Kunststoffe jeweils einer Kunststoffklasse zu und erkläre jeweils das Verhalten der Kunststoffe beim Erwärmen.
(7 BE)
3.5
Ethenylacetat (Vinylacetat, Material 1) reagiert mit Wasserstoffperoxid  im Verhältnis
im Verhältnis  zu Ethansäure und einem weiteren organischen Produkt. Dieses organische Produkt zeigt mit Fehling-Reagenz einen positiven Nachweis.
Beschreibe die Beobachtungen für einen positiven Fehling-Nachweis und gib für ein selbstgewähltes Beispiel eine Reaktionsgleichung an.
Entwickle unter Verwendung von Strukturformeln für die organischen Verbindungen die Reaktionsgleichung der Reaktion von Ethenylacetat mit Wasserstoffperoxid und benenne das weitere organische Produkt.
zu Ethansäure und einem weiteren organischen Produkt. Dieses organische Produkt zeigt mit Fehling-Reagenz einen positiven Nachweis.
Beschreibe die Beobachtungen für einen positiven Fehling-Nachweis und gib für ein selbstgewähltes Beispiel eine Reaktionsgleichung an.
Entwickle unter Verwendung von Strukturformeln für die organischen Verbindungen die Reaktionsgleichung der Reaktion von Ethenylacetat mit Wasserstoffperoxid und benenne das weitere organische Produkt.
(9 BE)
3.6
In  Wasser sind
Wasser sind  Ethenylacetat (Vinylacetat) gelöst.
Berechne die Konzentration
Ethenylacetat (Vinylacetat) gelöst.
Berechne die Konzentration  von Ethenylacetat in dieser Lösung.
von Ethenylacetat in dieser Lösung.
(4 BE)
Material 1
Ethenylacetat (Vinylacetat)

Material 2
Polyvinylacetat-Molekül (Ausschnitt)

Material 3
Polyester-Molekül (Ausschnitt)

Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
3.1
Reaktionsgleichung für die Gleichgewichtsreaktion


 Massenwirkungsgesetz
Massenwirkungsgesetz
 Aussage des Prinzips vom kleinsten Zwang
Übt man auf ein sich im Gleichgewicht befindliches chemisches System einen äußeren Zwang in Form von Temperaturveränderung, Druckveränderung oder Konzentrationsveränderung aus, so verschiebt sich das Gleichgewicht so, dass der äußere Zwang minimiert wird.
Begründung der Einflüsse
Temperaturerhöhung:
Aussage des Prinzips vom kleinsten Zwang
Übt man auf ein sich im Gleichgewicht befindliches chemisches System einen äußeren Zwang in Form von Temperaturveränderung, Druckveränderung oder Konzentrationsveränderung aus, so verschiebt sich das Gleichgewicht so, dass der äußere Zwang minimiert wird.
Begründung der Einflüsse
Temperaturerhöhung:
Nach dem Prinzip des kleinsten Zwangs begünstigen hohe Temperaturen, endotherme Reaktionen und niedrige Temperaturen die exotherme.
Da die Reaktion von Ethansäure mit Ethen und Sauerstoff exotherm ist, wird folglich die endotherme Rückreaktion (Ethenylacetat und Wasser) begünstigt.
 Die Konzentration der Edukte ist höher ist als die der Produkte.
Konzentrationserhöhung: Wird die Eduktkonzentration, also die der Ethansäure, erhöht, verschiebt sich das Gleichgewicht auf die Seite der Produkte.
Die Konzentration der Edukte ist höher ist als die der Produkte.
Konzentrationserhöhung: Wird die Eduktkonzentration, also die der Ethansäure, erhöht, verschiebt sich das Gleichgewicht auf die Seite der Produkte.
 Es wird mehr Ethenylacetat nachgebildet.
Es wird mehr Ethenylacetat nachgebildet.
Nach dem Prinzip des kleinsten Zwangs begünstigen hohe Temperaturen, endotherme Reaktionen und niedrige Temperaturen die exotherme.
Da die Reaktion von Ethansäure mit Ethen und Sauerstoff exotherm ist, wird folglich die endotherme Rückreaktion (Ethenylacetat und Wasser) begünstigt.
3.2
Reaktionsmechanismus der radikalischen Polymerisation zu Polyvinylacetat
Bildung des Startradikals:
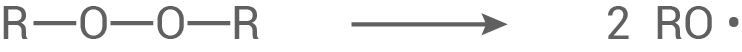 Zunächst wird das Peroxid homolytisch gespalten.
Kettenstart:
Zunächst wird das Peroxid homolytisch gespalten.
Kettenstart:
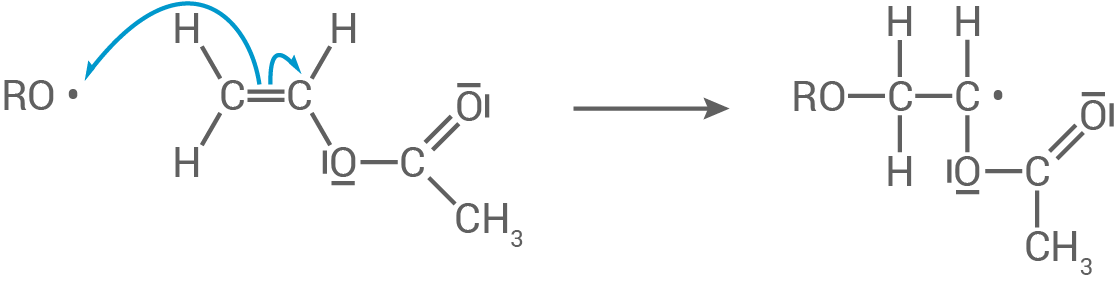 Das gebildete Radikal greift die Doppelbindung des Ethenylacetats an, wobei ein neues Radikal (Makroradikal) gebildet wird.
Kettenfortpflanzung:
Das gebildete Radikal greift die Doppelbindung des Ethenylacetats an, wobei ein neues Radikal (Makroradikal) gebildet wird.
Kettenfortpflanzung:
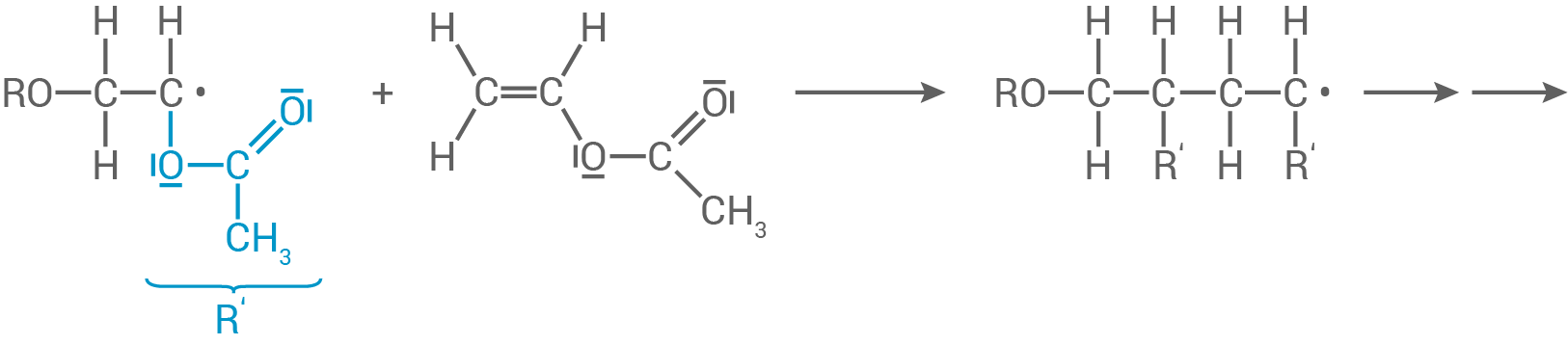 Das neue Radikal greift nun weitere Monomere an. Diese werden zum Makroradikal addiert.
Kettenabbruch:
Das neue Radikal greift nun weitere Monomere an. Diese werden zum Makroradikal addiert.
Kettenabbruch:
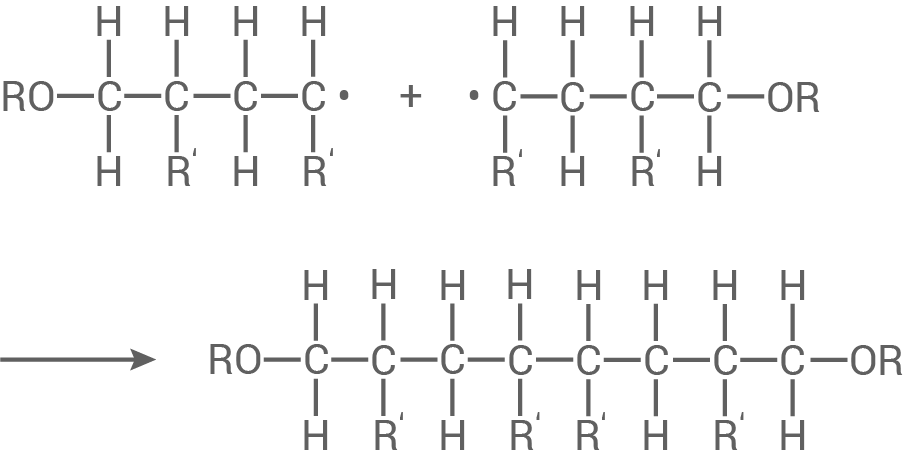 Es reagieren zwei Radikale zu einem stabilen Makromolekül.
Oder:
Es reagieren zwei Radikale zu einem stabilen Makromolekül.
Oder:
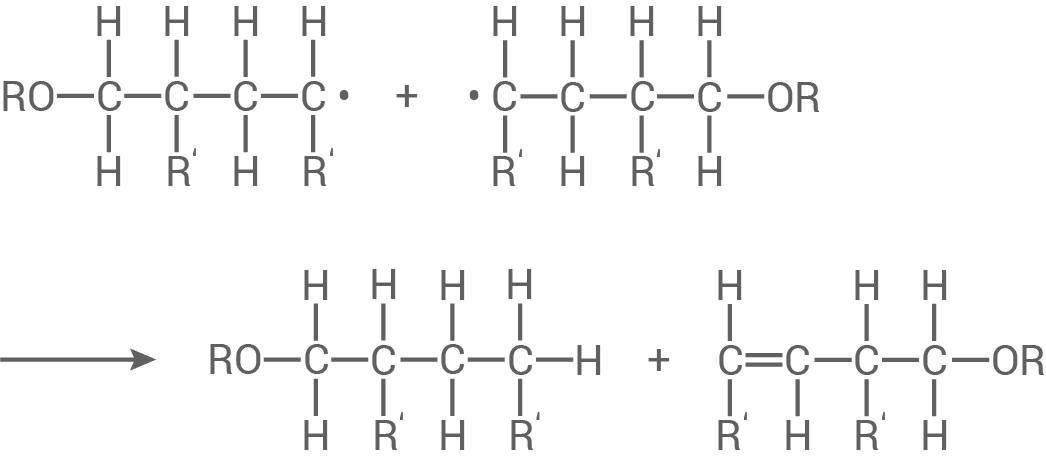 Es findet eine Disproportionierung statt.
Es findet eine Disproportionierung statt.
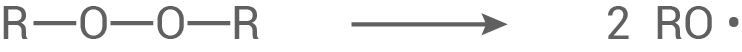




3.3
Reaktionsmechanismus
1. Schritt:
 Das Hydroxid-Ion greift nucleophil am positiv polarisierten Carbonyl-
Das Hydroxid-Ion greift nucleophil am positiv polarisierten Carbonyl- -Atom der Estergruppe an.
Schritt 2:
-Atom der Estergruppe an.
Schritt 2:
 Das Alkoholat-Ion wird unter Bildung eines Anions eliminiert.
Schritt 3:
Das Alkoholat-Ion wird unter Bildung eines Anions eliminiert.
Schritt 3:
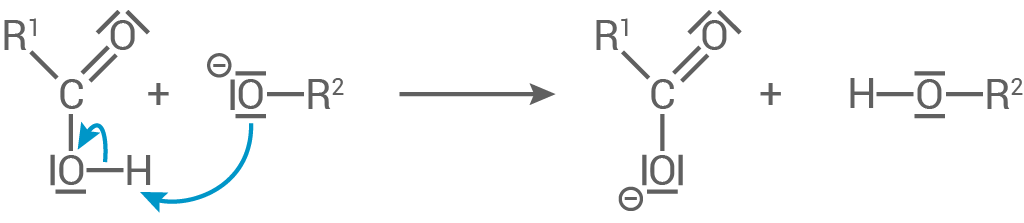 Es findet eine Protonenübertragung zwischen dem Alkoholat-Ion und der Alkansäure statt.
Reaktionsmechanismus und die funktionellen Gruppen der Produkte
Es findet eine Protonenübertragung zwischen dem Alkoholat-Ion und der Alkansäure statt.
Reaktionsmechanismus und die funktionellen Gruppen der Produkte



- Da es sich bei Polyvinylacetat um einen Polyester handelt, findet eine alkalische Hydrolyse bzw. eine Verseifung statt.
- Dabei reagiert ein Ester mit Hydroxid-Ionen.
- Die funktionellen Gruppen der beiden Produkte sind zum einen eine Hydroxygruppe und zum anderen eine Carboxylatgruppe.

3.4
Zuordnung der Kunststoffe und Verhalten beim Erwärmen
| Polyvinylacetat |
|
|---|---|
| Duroplast |
|
3.5
Beobachtungen eines positiven Fehling-Nachweises und Reaktionsgleichung
Bei einem positiven Fehling-Nachweis färbt sich die zunächst tiefblaue Lösung zu einer orange/rot-braunen Lösung. Es bildet sich außerdem ein rötlicher Niederschlag.
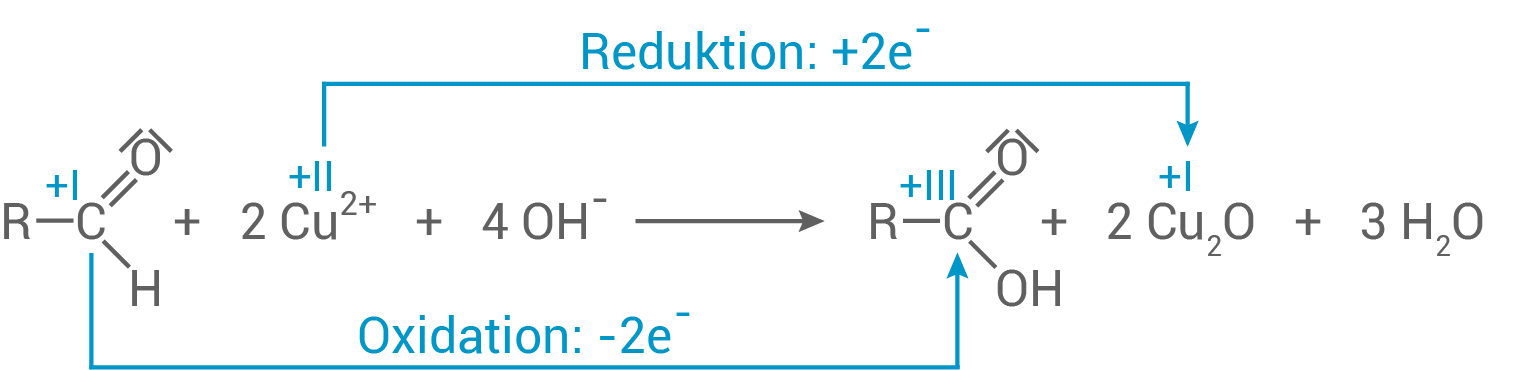 Die blauen
Die blauen  -Ionen werden zu Kupfer
-Ionen werden zu Kupfer -oxid reduziert und fallen als Niederschlag aus.
Niederschlag:
Reaktionsgleichung der Reaktion von Ethenylacetat mit Wasserstoffperoxid
-oxid reduziert und fallen als Niederschlag aus.
Niederschlag:
Reaktionsgleichung der Reaktion von Ethenylacetat mit Wasserstoffperoxid
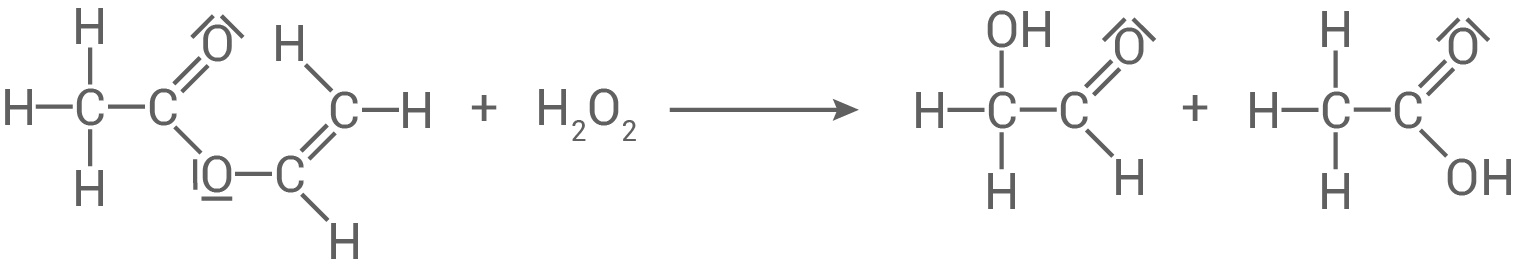 Das weitere organische Produkt ist 2-Hydroxyethanal bzw. Hydroxyethanal.
Das weitere organische Produkt ist 2-Hydroxyethanal bzw. Hydroxyethanal.


3.6
Berechnung der Konzentration von Ethenylacetat
Zunächst lässt sich mit der gegebenen Masse und der molaren Masse die Stoffmenge berechnen:
![\(\begin{array}[t]{rll}
M (C_4H_6O_2)&=& 86\,\text{g} \cdot \text{mol}^{-1}& \\[15pt]
n(C_4H_6O_2)&=& \dfrac{m}{M} & \\[5pt]
&=& \dfrac{ 4\,\text{g} }{ 86\,\text{g} \cdot \text{mol}^{-1}} & \\[5pt]
&=& 0,047\,\text{mol}
\end{array}\)](https://www.schullv.de/resources/formulas/4989bede39c532e58b42f024b636b4971a7a28f50e325c991ee46c55082e379d_light.svg) Daraus folgt:
Daraus folgt:
![\(\begin{array}[t]{rll}
c(C_4H_6O_2) &=& \dfrac{n}{V}& \\[5pt]
&=& \dfrac{0,047\,\text{mol}}{0,25\,\text{L}} & \\[5pt]
&=& 0,188\,\text{mol}\cdot \text{L}^{-1}
\end{array}\)](https://www.schullv.de/resources/formulas/5c68405c922c14c2698025b59def3bf9763d389869996e648910c0e5528667f4_light.svg) Die Konzentration von Ethenylacetat in dieser Lösung beträgt
Die Konzentration von Ethenylacetat in dieser Lösung beträgt 