Vorschlag B – Chemie rund um Chlor
Chlor ist auch heute noch eine außerordentlich wichtige Verbindung in der chemischen Industrie. Es handelt sich um ein grün-gelbes giftiges Gas mit stechendem Geruch. Früher wurde elementares Chlor großtechnisch nach dem DEACON-Verfahren hergestellt. Das DEACON-Verfahren zählt zu den bekanntesten historischen Prozessen der chemischen Industrie. Es wurde von dem englischen Chemiker Henry DEACON im Jahre 1868 zum Patent angemeldet. Dabei wird das Gas Chlorwasserstoff mit Sauerstoff zu Chlor und Wasser umgesetzt. Dieser Prozess findet bei etwa  am Katalysator statt. Die Reaktion führt zu einem chemischen Gleichgewicht.
In organischen Verbindungen ist Chlor häufig als Substituent enthalten. Diese Chlorkohlenwasserstoffe können eine Vielzahl von Reaktionen eingehen und sind aufgrund ihrer Reaktivität vielfach verwendete Ausgangsstoffe bei chemischen Synthesen, wie zum Beispiel der Kunststoffherstellung. Der Kunststoff Polyvinylidenchlorid (Kurzzeichen
am Katalysator statt. Die Reaktion führt zu einem chemischen Gleichgewicht.
In organischen Verbindungen ist Chlor häufig als Substituent enthalten. Diese Chlorkohlenwasserstoffe können eine Vielzahl von Reaktionen eingehen und sind aufgrund ihrer Reaktivität vielfach verwendete Ausgangsstoffe bei chemischen Synthesen, wie zum Beispiel der Kunststoffherstellung. Der Kunststoff Polyvinylidenchlorid (Kurzzeichen  ) wird aus 1,1-Dichlorethen mithilfe eines Peroxids
) wird aus 1,1-Dichlorethen mithilfe eines Peroxids  als Radikalstarter hergestellt. 1,1-Dichlorethen lässt sich wiederum unter bestimmten Reaktionsbedingungen aus 1,1,2-Trichlorethan herstellen, dabei entsteht als weiteres Produkt Chlorwasserstoff.
Durch die Reaktion von gasförmigem Chlorwasserstoff mit gasförmigem Ammoniak kann Ammoniumchlorid hergestellt werden. Ammoniumchlorid, auch Salmiaksalz genannt, wird aufgrund seines scharf-salzigen Geschmacks u.a. für die Herstellung von Lakritzwaren verwendet.
als Radikalstarter hergestellt. 1,1-Dichlorethen lässt sich wiederum unter bestimmten Reaktionsbedingungen aus 1,1,2-Trichlorethan herstellen, dabei entsteht als weiteres Produkt Chlorwasserstoff.
Durch die Reaktion von gasförmigem Chlorwasserstoff mit gasförmigem Ammoniak kann Ammoniumchlorid hergestellt werden. Ammoniumchlorid, auch Salmiaksalz genannt, wird aufgrund seines scharf-salzigen Geschmacks u.a. für die Herstellung von Lakritzwaren verwendet.
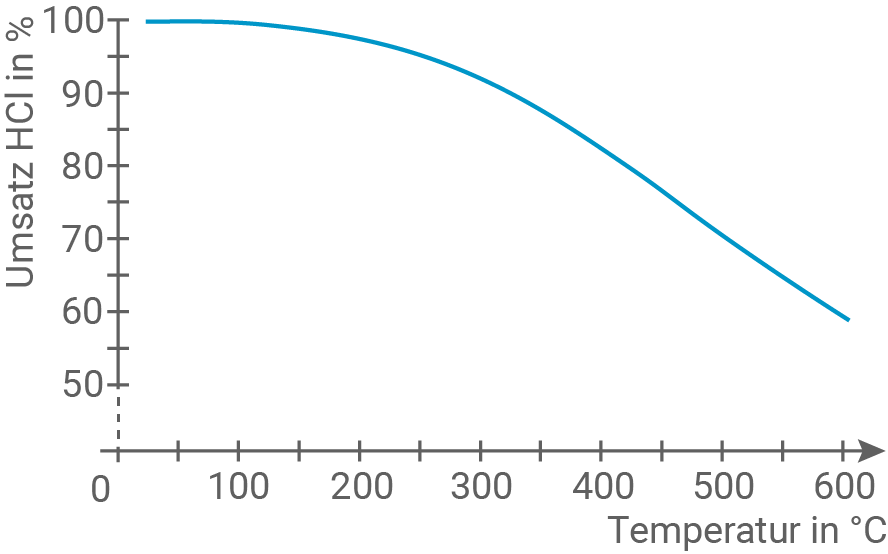 Hinweis: Der „Umsatz
Hinweis: Der „Umsatz  in
in  “ gibt den prozentualen Verbrauch an Chlorwasserstoff in Bezug auf die Ausgangsmenge an.
“ gibt den prozentualen Verbrauch an Chlorwasserstoff in Bezug auf die Ausgangsmenge an.
Tabelle der
2.1
Formuliere für die Reaktion von Chlorwasserstoff mit Sauerstoff zu Chlor und Wasser im DEACON-Verfahren die Reaktionsgleichung und das darauf basierende Massenwirkungsgesetz.
Berechne mithilfe der in Material 1 angegebenen Daten die Gleichgewichtskonstante 
(7 BE)
2.2
Material 2 liefert weitere Informationen zum DEACON-Verfahren.
Beschreibe den Kurvenverlauf in Material 2.
Erkläre jeweils den Einfluss der folgenden Maßnahmen auf das Gleichgewicht im DEACON-Verfahren:
 bei einer Temperaturerniedrigung.
bei einer Temperaturerniedrigung.
a)
Druckerhöhung bei einer konstanten Temperatur größer als 
b)
Temperaturerhöhung bei konstantem Druck
Begründe die Änderung des Zahlenwertes für
(9 BE)
2.3
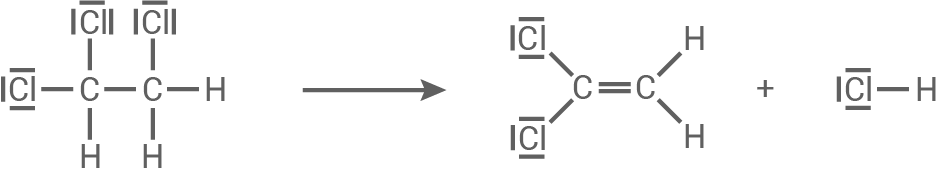
Formuliere für die Reaktion von 1,1,2-Trichlorethan zu 1,1-Dichlorethen und Chlorwasserstoff eine Reaktionsgleichung, wobei du für die organischen Verbindungen Strukturformeln verwendest.
Formuliere und benenne für die Synthese des Kunststoffs Polyvinylidenchlorid  aus 1,1-Dichlorethen mithilfe eines Peroxids
aus 1,1-Dichlorethen mithilfe eines Peroxids  als Radikalstarter den Reaktionsmechanismus.
als Radikalstarter den Reaktionsmechanismus.
(10 BE)
2.4
Bei der Reaktion von gasförmigem Chlorwasserstoff mit gasförmigem Ammoniak  entsteht der weiße Feststoff Ammoniumchlorid
entsteht der weiße Feststoff Ammoniumchlorid  Löst man eine bestimmte Menge der Ionen-Verbindung Ammoniumchlorid in Wasser, entsteht eine Lösung mit einem pH-Wert von
Löst man eine bestimmte Menge der Ionen-Verbindung Ammoniumchlorid in Wasser, entsteht eine Lösung mit einem pH-Wert von  Formuliere die Reaktionsgleichung für die Reaktion von Chlorwasserstoff mit Ammoniak zu Ammoniumchlorid.
Formuliere eine Reaktionsgleichung für die Reaktion von Ammoniumchlorid mit Wasser und gib die korrespondierenden Säure-Base-Paare an.
Berechne die Konzentration an
Formuliere die Reaktionsgleichung für die Reaktion von Chlorwasserstoff mit Ammoniak zu Ammoniumchlorid.
Formuliere eine Reaktionsgleichung für die Reaktion von Ammoniumchlorid mit Wasser und gib die korrespondierenden Säure-Base-Paare an.
Berechne die Konzentration an  -Ionen in der Lösung mit einem pH-Wert von
-Ionen in der Lösung mit einem pH-Wert von  sowie den
sowie den  -Wert.
-Wert.
(8 BE)
2.5
Propansäure, 2-Chlorpropansäure und 3-Chlorpropansäure unterscheiden sich in ihrer Säurestärke.
Gib an, was man unter dem Fachbegriff „Säurestärke“ versteht.
Zeichne die Strukturformeln der oben genannten Säuren, ordne die in Material 3 angegebenen  -Werte den einzelnen Säuren zu und begründe deine Zuordnung.
-Werte den einzelnen Säuren zu und begründe deine Zuordnung.
(9 BE)
2.6
3-Chlorpropansäure wird in einer Additionsreaktion aus Chlorwasserstoff und Propensäure hergestellt. Hierbei kann theoretisch ein weiteres, organisches Isomer als Reaktionsprodukt gebildet werden.
Entwickle zu dieser Reaktion einen möglichen Reaktionsmechanismus. Hinweis: Beachte dabei, dass im ersten Teilschritt ein -Ion an die C-C-Doppelbindung angelagert wird.
Erkläre die theoretisch mögliche Bildung eines weiteren organischen Isomers als Reaktionsprodukt.
-Ion an die C-C-Doppelbindung angelagert wird.
Erkläre die theoretisch mögliche Bildung eines weiteren organischen Isomers als Reaktionsprodukt.
Entwickle zu dieser Reaktion einen möglichen Reaktionsmechanismus. Hinweis: Beachte dabei, dass im ersten Teilschritt ein
(7 BE)
(50 BE)
Material 1
DEACON-Verfahren: Gleichgewichtskonzentration
| Verbindung | Konzentration im Gleichgewicht in |
|---|---|
| Chlor (g) | |
| Chlorwasserstoff (g) | |
| Sauerstoff (g) | |
| Wasser (g) |
Material 2
DEACON-Verfahren: Gleichgewichtsumsatz von Chlorwasserstoff mit Sauerstoff bei Normaldruck

Material 3
Tabelle der  -Werte von Propansäure, 2-Chlorpropansäure und 3-Chlorpropansäure
-Werte von Propansäure, 2-Chlorpropansäure und 3-Chlorpropansäure
| Verbindung | |
|---|---|
| Verbindung A | |
| Verbindung B | |
| Verbindung C |
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
2.1
Reaktionsgleichung zur Reaktion von Chlorwasserstoff mit Sauerstoff


 Zugehöriges Massenwirkungsgesetz
Zugehöriges Massenwirkungsgesetz
 Berechnung der Gleichgewichtskonstanten
Berechnung der Gleichgewichtskonstanten 
2.2
Beschreibung des Kurvenverlaufs
 Wird die Temperatur erniedrigt, steigt der
Wird die Temperatur erniedrigt, steigt der  -Umsatz. Damit steigt die Ausbeute an den Produkten Chlor und Wasser, womit der Zahlenwert der Gleichgewichtskonstante
-Umsatz. Damit steigt die Ausbeute an den Produkten Chlor und Wasser, womit der Zahlenwert der Gleichgewichtskonstante  größer wird.
größer wird.
- Der Graph zeigt die Auftragung des
-Umsatzes im Gleichgewichtszustand beim DEACON-Verfahren gegen die Temperatur.
- Es ist zu sehen, dass bei niedriger Temperatur am meisten
umgesetzt wird. Bei
beträgt der Umsatz
- Mit steigender Temperatur nimmt der Umsatz an Chlorwasserstoff deutlich ab.
- Wird bei einer Gleichgewichtsreaktion der Druck erhöht, versucht das System diesem äußeren Zwang entgegenzuwirken.
- Nach dem Prinzip von LE CHATELIER und BRAUN (Prinzip des kleinsten Zwangs) verschiebt sich das Gleichgewicht auf die Seite mit dem kleineren Volumen, also hier die Seite, die zu weniger gasförmigen Stoffen führt.
- Die Reaktionsgleichung zeigt auf der Eduktseite fünf gasförmige Teilchen und die Produktseite vier.
- Demnach liegt das Gleichgewicht auf der Seite der Produkte.
- Wird die Temperatur bei konstantem Druck erhöht, sinkt der
-Umsatz (siehe Kurvenverlauf).
- Demnach werden bei einer Temperaturerhöhung weniger Chlor und Wasserstoff gebildet – das Gleichgewicht liegt mehr auf Eduktseite und die Hinreaktion ist exotherm (Chlorwasserstoff und Sauerstoff zu Chlor und Wasser).
- Hier wird nach dem Prinzip von LE CHATELIER und BRAUN dieser äußere Zwang ausgeglichen, indem die endotherme Reaktion bevorzugt wird.
- Bei einer Temperaturerhöhung läuft also bevorzugt die endotherme Rückreaktion ab.
2.3
Reaktionsgleichung mit Strukturformeln
 Reaktionsmechanismus für die Synthese von
Reaktionsmechanismus für die Synthese von  1,1-Dichlorethen wird über eine radikalische Polymerisation zum Kunststoff Polyvinylchlorid
1,1-Dichlorethen wird über eine radikalische Polymerisation zum Kunststoff Polyvinylchlorid  polymerisiert.
polymerisiert.
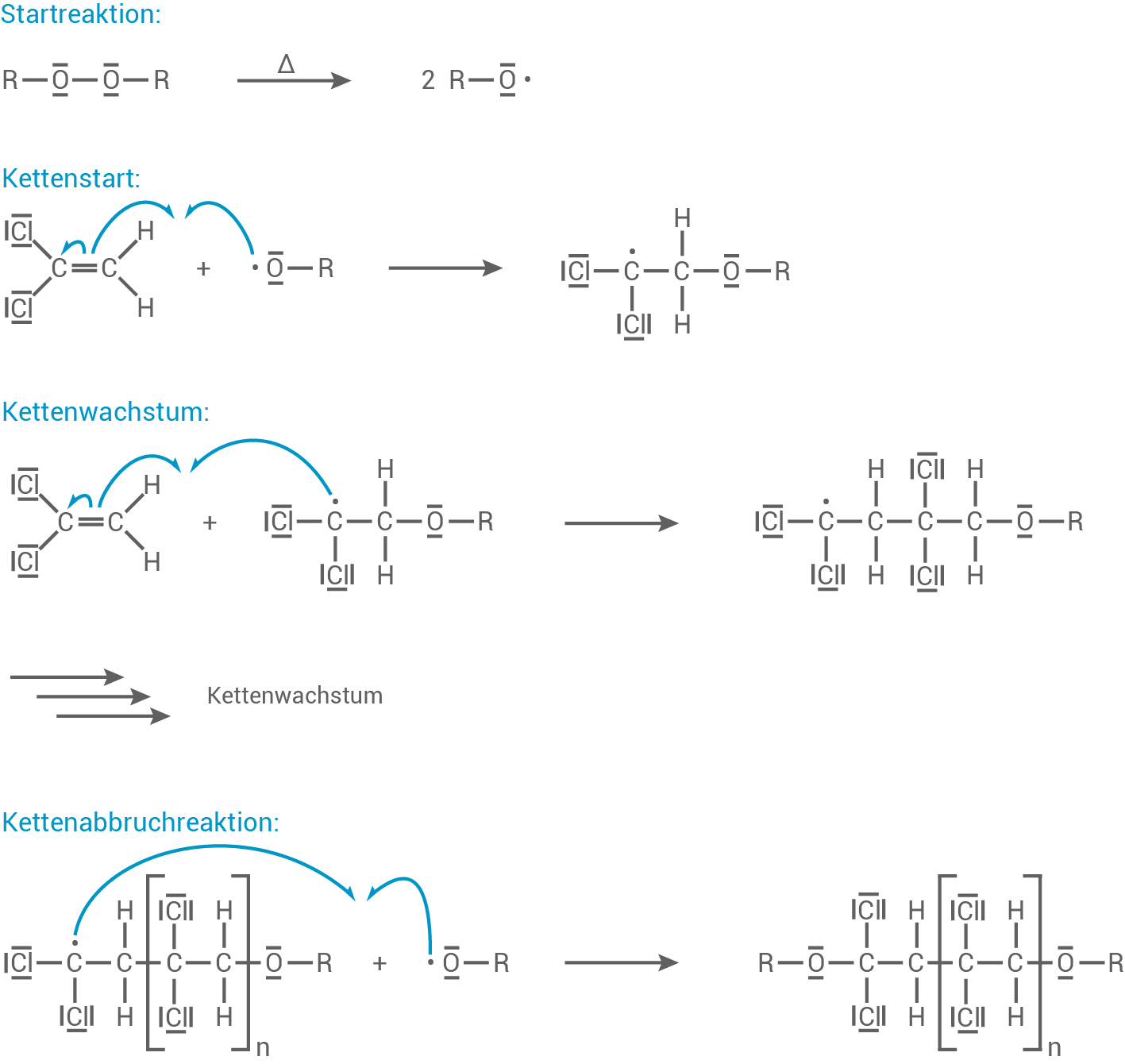
 Die Kette bricht ab, wenn zwei Radikale miteinander reagieren (mehrere Möglichkeiten)
Die Kette bricht ab, wenn zwei Radikale miteinander reagieren (mehrere Möglichkeiten)

Reaktion von 1,1,2-Trichlorethan zu 1,1-Dichlorethen und Chlorwasserstoff

2.4
Reaktionsgleichung
 Protolysereaktion von Chlorwasserstoffgas mit Ammoniakgas zu festem Ammoniumchlorid
Protolysereaktion von Chlorwasserstoffgas mit Ammoniakgas zu festem Ammoniumchlorid


 oder
oder  Reaktionsgleichung und Säure-Base-Paar
Reaktionsgleichung und Säure-Base-Paar



 Mit dem gegebenen pH-Wert von
Mit dem gegebenen pH-Wert von  erhalten wir also:
erhalten wir also:
![\(\begin{array}[t]{rll}
c(H_3O^+)&=& 10 ^{-4,5} & \\[5pt]
&=& 3,16 \cdot 10^{-5} \,\text{mol} \cdot \text{L}^{-1}
\end{array}\)](https://www.schullv.de/resources/formulas/7336a1f8324dad7426e98bd57bc5bea4f0be95c61e79441c0061438b71837228_light.svg) Berechnung des
Berechnung des  -Wertes
Es gilt:
-Wertes
Es gilt:
 Somit ergibt sich:
Somit ergibt sich:
![\(\begin{array}[t]{rll}
pOH&=& 14 - pH & \\[5pt]
&=& 14- 4,5 & \\[5pt]
&=& 9,5
\end{array}\)](https://www.schullv.de/resources/formulas/3783e2012401bd5c232b28000c579b67e5dbc981dc39ac1bda69999783d5c290_light.svg)
- In dieser Reaktion stellt das Ammonium-Ion
die Säure und Ammoniak
die Base dar. Sie sind damit ein korrespondierendes Säure-Base-Paar.
- Ein weiteres Säure-Base-Paar wird dargestellt durch das Oxonium-Ion
und Wasser
welche bei der Protolyse gebildet werden.
2.5
Der Begriff „Säurestärke“
Die Säurestärke ist die Eigenschaft eines Stoffes (einer Säure), sein Proton, also das  -Ion, abzugeben.
Strukturformeln und Zuordnung
-Ion, abzugeben.
Strukturformeln und Zuordnung
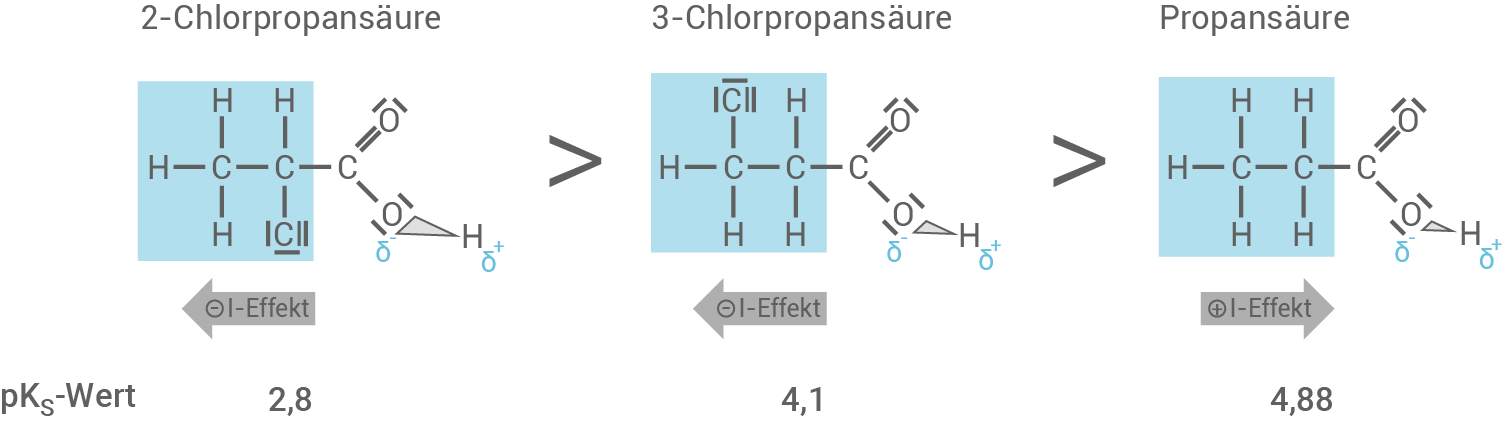

- Für die Zuordnung der verschiedenen
-Werte, werden die jeweiligen Carboxyl-Gruppen betrachtet – genauer gesagt die Sauerstoff-Wasserstoff-Bindung.
- Es gilt, je schwächer die
-Bindung, desto einfacher/ leichter wird ein Proton
abgespalten.
- Die Stärke einer
-Bindung wird beeinflusst durch induktive Effekte.
- Je nach Richtung und Stärke dieser induktiven Effekte, ist die Bindung unterschiedlich polar und damit auch unterschiedlich stark (in der Abbildung durch unterschiedlich große Keilstriche dargestellt).
- In der 2-Chlorpropansäure befindet in der Nähe der Carboxyl-Gruppe ein elektronegativeres Chlor-Atom. Dieses wirkt elektronenziehend und übt einen starken
-Effekt aus. Die
-Bindung wird polarer, also auch stärker und kann somit das Proton leichter abspalten.
- Die 3-Chlorpropansäure besitzt ebenfalls ein Chlor-Atom, welches einen
-Effekt ausübt. Bei der Betrachtung der Strukturformel sieht man aber, dass dieses weiter weg von der Carboxyl-Gruppe ist und der Einfluss deswegen im Vergleich zu 2-Chlorpropansäure schwächer ist. Deswegen ist der
-Wert höher, die Säure also schwächer.
- Der Popansäure ist der höchste
-Wert zuzuordnen. Diese Säure weist neben der Carboxyl-Gruppe nur einen Alkylrest auf, welcher elektronenschiebend wirkt und damit einen
-Effekt ausübt. Die Polarität der
-Bindung wird verringert und das Proton, also
, wird schwerer abgespalten.
2.6
Möglicher Reaktionsmechanismus
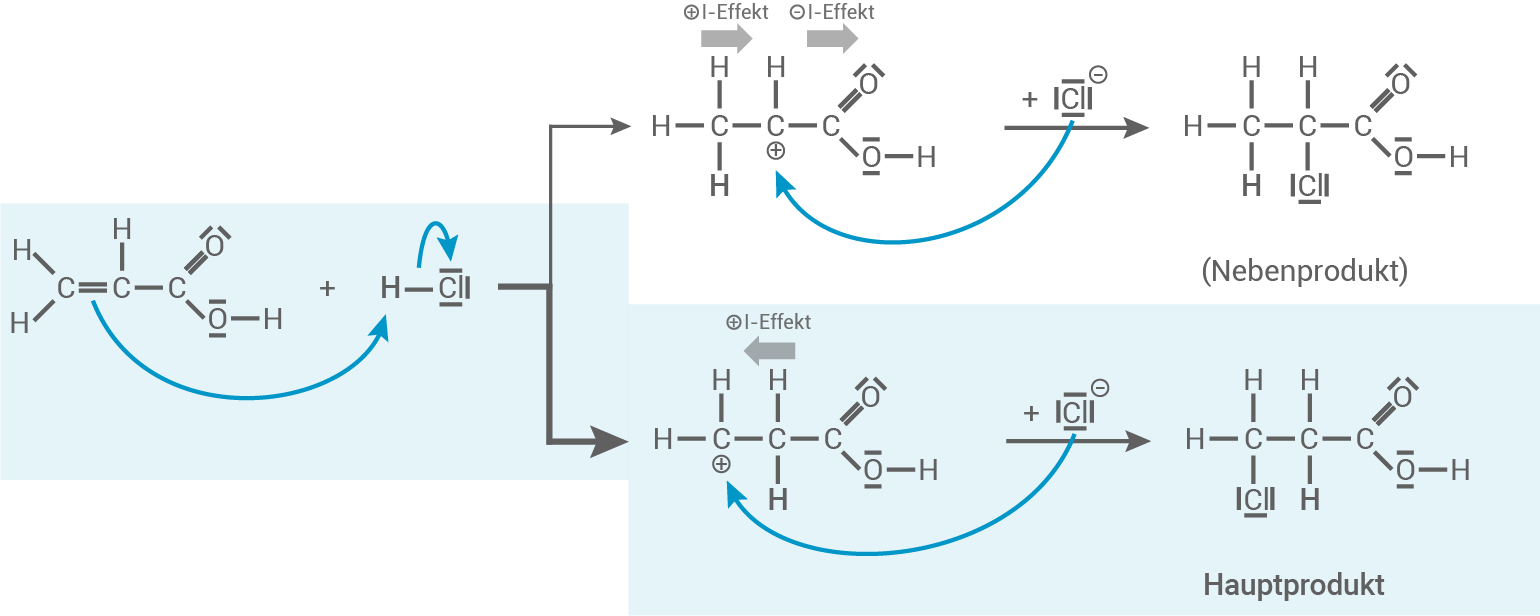 Theoretisch mögliche Bildung eines weiteren organischen Isomers
Als weiteres Reaktionsprodukt kann auch 2-Chlorpropansäure entstehen (siehe Nebenprodukt im Reaktionsmechanismus). Dafür kommt es im ersten Schritt zur elektrophilen Addition des Protons an das
Theoretisch mögliche Bildung eines weiteren organischen Isomers
Als weiteres Reaktionsprodukt kann auch 2-Chlorpropansäure entstehen (siehe Nebenprodukt im Reaktionsmechanismus). Dafür kommt es im ersten Schritt zur elektrophilen Addition des Protons an das  -Atom. Im nächsten Schritt greift dann das Chlorid-Ion nucleophil das Carbenium-Ion an, wodurch 2-Chlorpropansäure entsteht.
-Atom. Im nächsten Schritt greift dann das Chlorid-Ion nucleophil das Carbenium-Ion an, wodurch 2-Chlorpropansäure entsteht.

Additionsreaktion von Chlorwasserstoff und Propensäure zu 3-Chlorpropansäure