HT 2
Der Franck-Hertz-Versuch mit Quecksilber
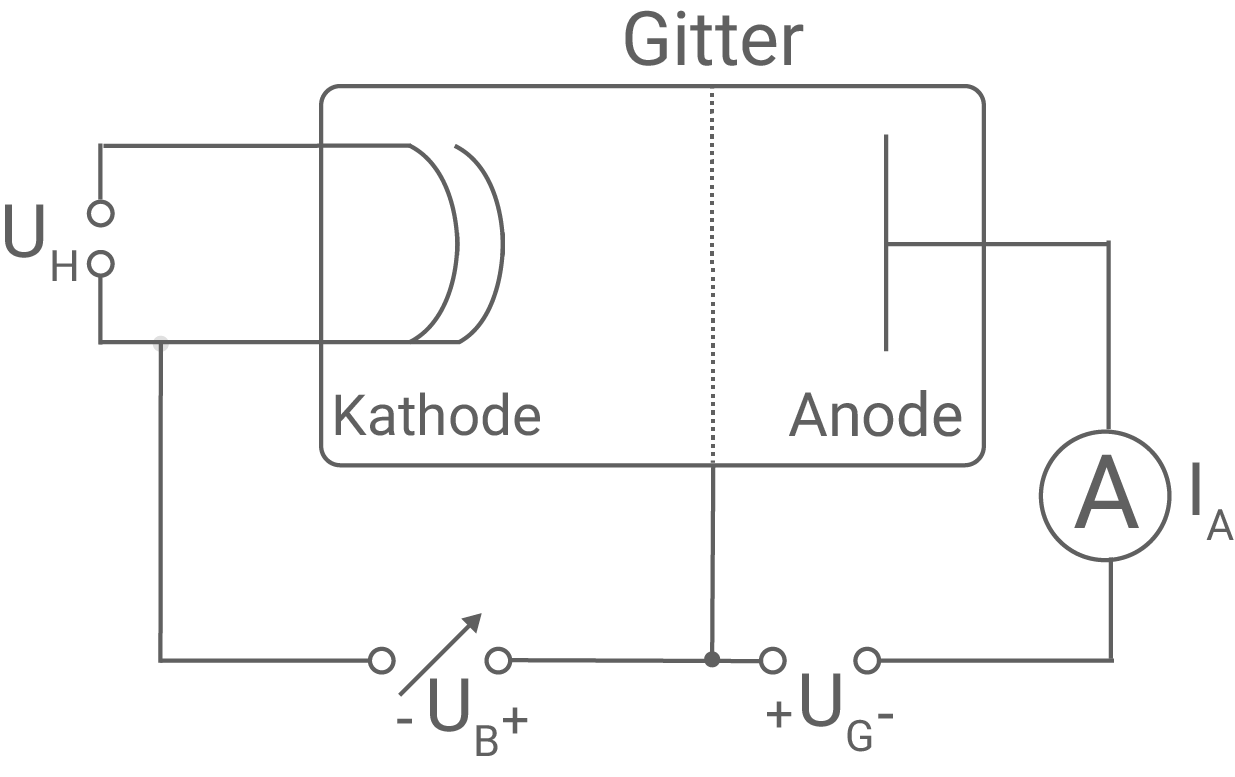
Der Franck-Hertz-Versuch liefert wichtige Erkenntnisse über den Aufbau von Atomen. Teilaufgabe 1: Aufbau des Franck-Hertz-Versuchs Abbildung 1 zeigt den schematischen Aufbau des Franck-Hertz-Versuchs mit Quecksilberdampf. Hierbei bezeichnet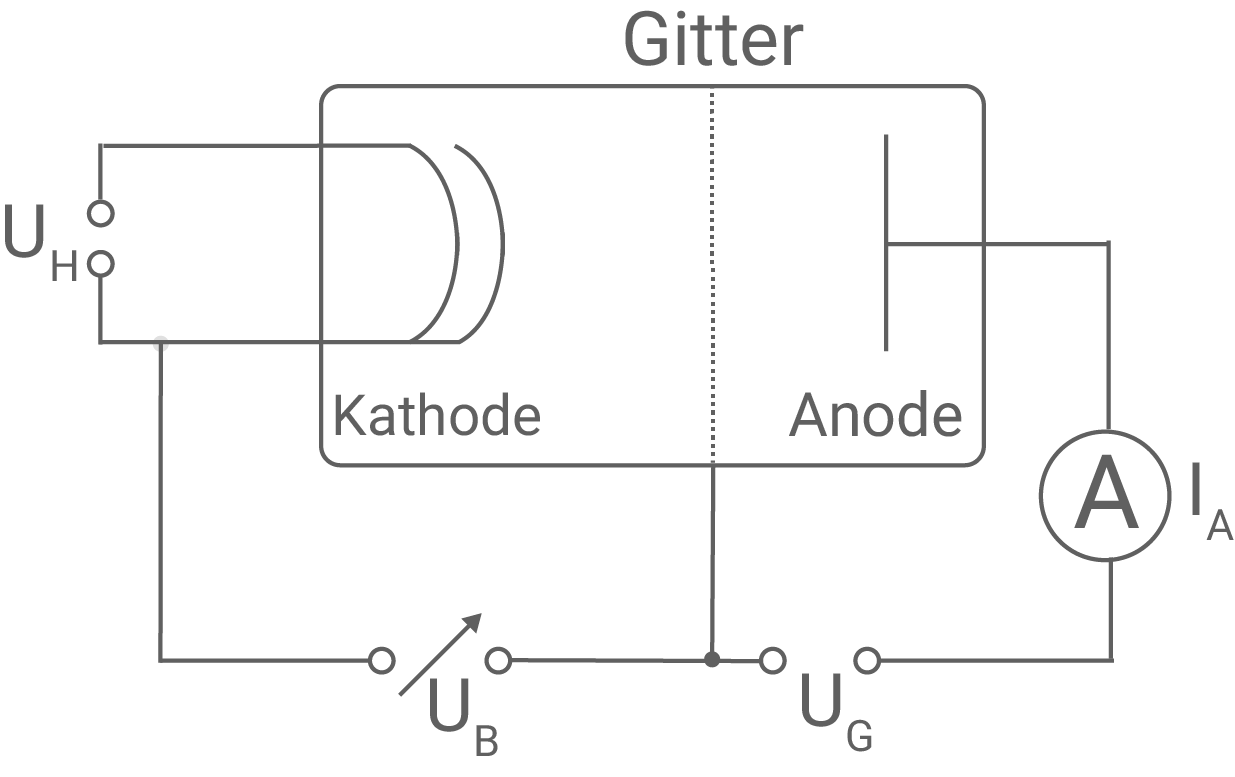
Abbildung 1: Schematischer Aufbau des Franck-Hertz-Versuchs mit Quecksilberdampf
a)
- Erläutere die Funktion der Bauelemente des Franck-Hertz-Versuchs in Abbildung 1 und die Bedeutung der Spannungen
und
- Gib für eine übliche Durchführung des Franck-Hertz-Versuchs die Polung der Spannungen
und
in Abbildung 1 an.
b)
Beschreibe die Durchführung des Franck-Hertz-Versuchs mit Quecksilber.
Teilaufgabe 2: Auswertung des Versuchs
Bei dem hier durchgeführten Versuch beträgt die Spannung
(6 + 2 Punkte)
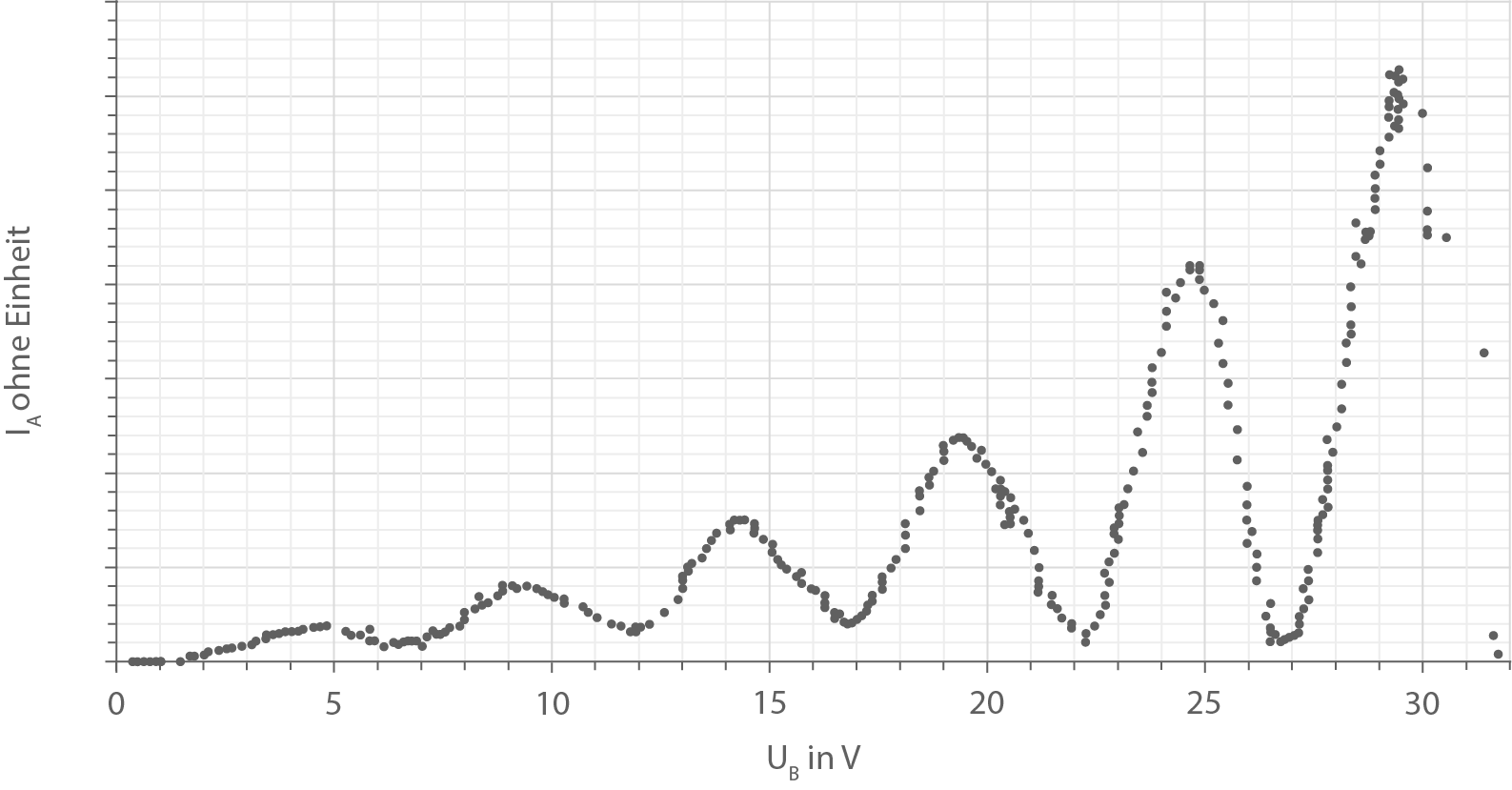
Abbildung 2:  -
- -Diagramm des Franck-Hertz-Versuchs mit Quecksilber
-Diagramm des Franck-Hertz-Versuchs mit Quecksilber
a)
- Beschreibe den Verlauf des Diagramms in Abbildung 2.
- Gib die Werte der Spannung
an, bei denen die Maxima des Anodenstroms
im Diagramm in Abbildung 2 auftreten.
b)
Begründe, weshalb ein Anodenstrom der Stärke  größer als Null nur dann gemessen wird, wenn die Spannung
größer als Null nur dann gemessen wird, wenn die Spannung  größer ist als
größer ist als 
c)
- Erkläre das erstmalige Absinken der Stromstärke
im Diagramm in Abbildung 2.
- Erläutere, weshalb die Stromstärke
im weiteren Verlauf noch weitere Male absinkt.
- Bestimme die Anregungsenergie
von Quecksilber mithilfe des Diagramms in Abbildung 2.
- Berechne die Wellenlänge
die man im Versuch feststellen müsste, wenn das angeregte Quecksilber wieder in seinen Grundzustand übergeht.
- Begründe, weshalb man die Strahlung der Wellenlänge
in diesem Versuch nicht mit dem menschlichen Auge sehen kann.
d)
In Abbildung 3 ist ein vereinfachtes Energieschema von Quecksilber dargestellt.
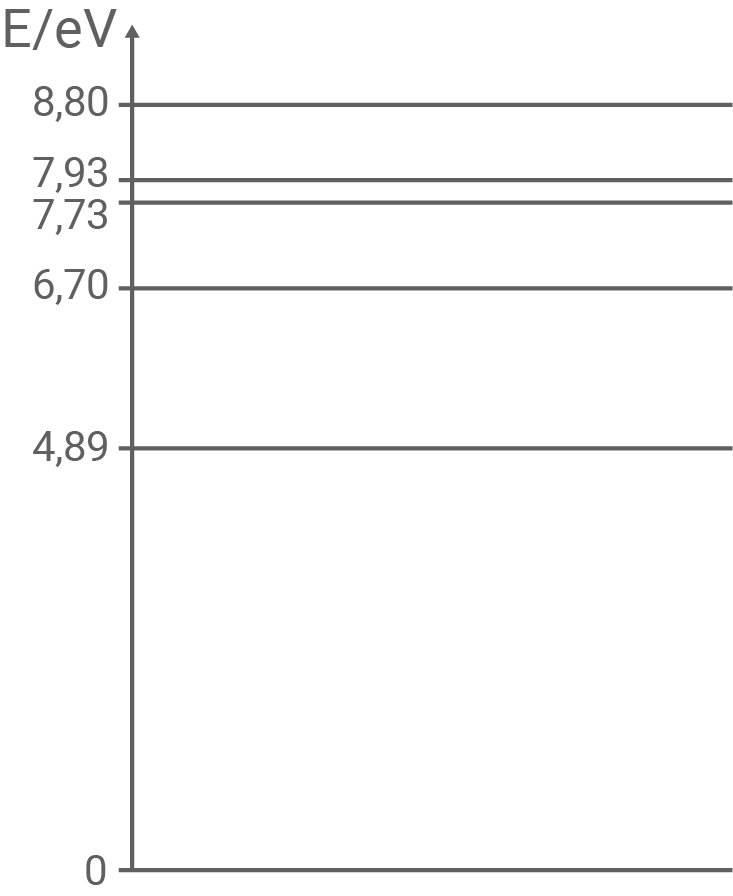 Das Spektrum einer Quecksilber-Dampflampe zeigt neben der
Das Spektrum einer Quecksilber-Dampflampe zeigt neben der  -Linie auch Spektrallinien im sichtbaren Bereich.
Erläutere mithilfe des Energieschemas in Abbildung 3, weshalb die Anregungsenergien der sichtbaren Spektrallinien von Quecksilber in dem
-Linie auch Spektrallinien im sichtbaren Bereich.
Erläutere mithilfe des Energieschemas in Abbildung 3, weshalb die Anregungsenergien der sichtbaren Spektrallinien von Quecksilber in dem  -
- -Diagramm in Abbildung 2 nicht nachgewiesen werden.
-Diagramm in Abbildung 2 nicht nachgewiesen werden.

Abbildung 3: Vereinfachtes Energieschema von Quecksilber
e)
Bestimme die Geschwindigkeit  die ein Elektron nach Abbildung 3 mindestens haben muss, um ein Quecksilberatom anzuregen.
die ein Elektron nach Abbildung 3 mindestens haben muss, um ein Quecksilberatom anzuregen.
Teilaufgabe 3: Absorption von Energieportionen
Neben dem Franck-Hertz-Versuch gibt es noch andere Versuche, bei denen Energieportionen absorbiert werden. Man kann z.B. Kochsalz, welches Natrium enthält, in der Flamme eines Bunsenbrenners verdampfen und die Flamme über Kreuz gleichzeitig mit dem Licht einer Quecksilberdampflampe und einer Natriumdampflampe beleuchten. Abbildung 4 zeigt den schematischen Aufbau und Abbildung 5 zeigt ein Bild des Versuchs. Bei dem Versuch beleuchtet die Natriumdampflampe nur den Schirm 1 und die Quecksilberdampflampe nur den Schirm 2.
(6 + 2 + 14 + 3 + 3 Punkte)
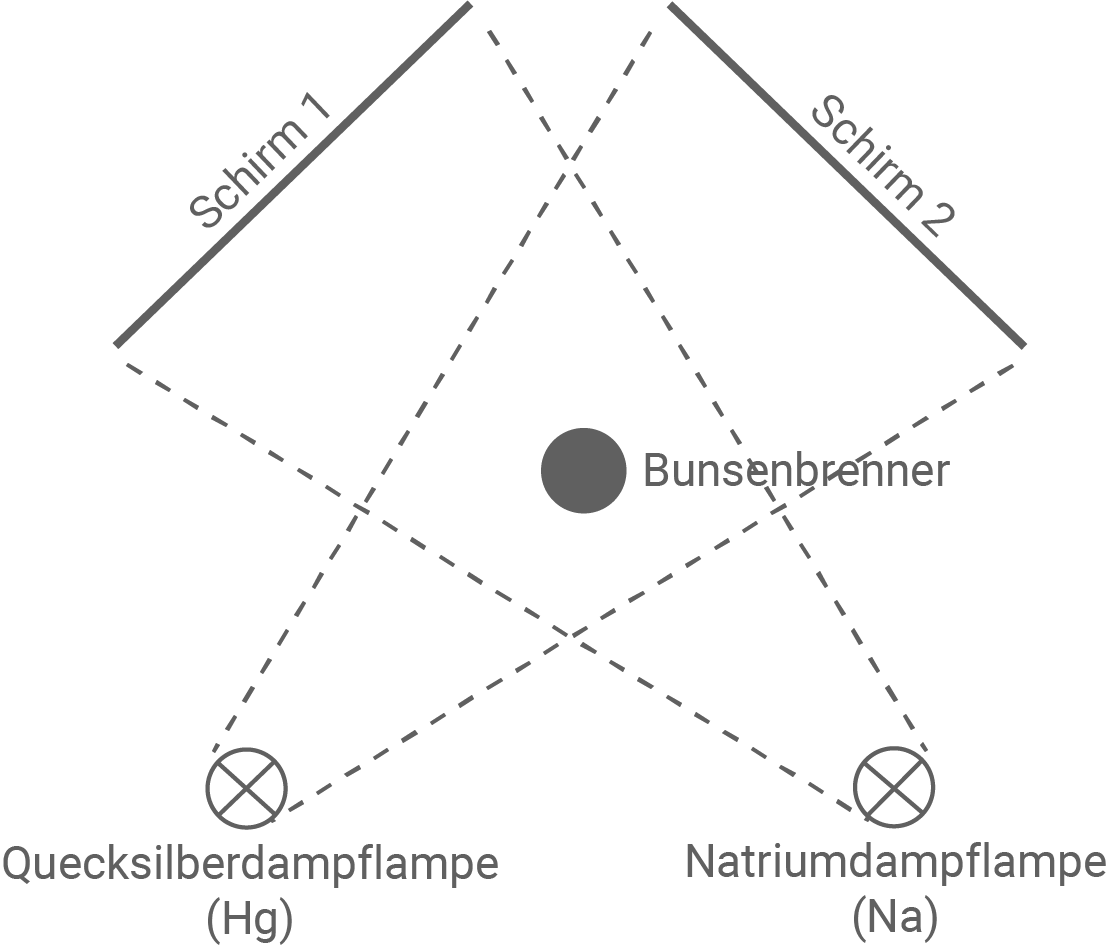
Abbildung 4: Schematischer Aufbau des Versuchs

Abbildung 5: Schattenbilder der Bunsenbrennerflamme
(Quecksilberdampflampe vorne links (Hg), Natriumdampflampe vorne rechts (Na)) (Quelle: http://www.kas.zum.de/wiki/Datei: ErgebnisKreuzprojektion.JPG (verändert; Zugriff: 26.05.2020))
(Quecksilberdampflampe vorne links (Hg), Natriumdampflampe vorne rechts (Na)) (Quelle: http://www.kas.zum.de/wiki/Datei: ErgebnisKreuzprojektion.JPG (verändert; Zugriff: 26.05.2020))
a)
- Beschreibe die Beobachtungen auf den Schirmen in Abbildung 5.
- Erläutere diese Beobachtungen.
b)
Erläutere den Unterschied bezüglich der Energieübertragung bei dem Versuch in Abbildung 5 und dem Franck-Hertz-Versuch.
E. Rutherford stellte 1911 ein für die Zeit neues Atommodell vor. Darin bewegen sich die Elektronen auf jeder beliebigen Kreisbahn um einen positiv geladenen Atomkern.
c)
Erläutere, welche grundsätzliche Erkenntnis diesem Atommodell noch fehlte, um die Ergebnisse des Versuchs in Abbildung 5 und des Franck-Hertz-Versuchs zu erklären.
(8 + 4 + 2 Punkte)
Teillösung 1: Aufbau des Franck-Hertz-Versuchs
a)
Bauelemente des Franck-Hertz-Versuchs und Bedeutung der Spannungen  und
und  Der Franck-Hertz-Versuch besteht aus einem Glaskolben, der mit Quecksilberdampf bei niedrigem Druck gefüllt ist. An der Kathode können durch Anlegen einer Heizspannung
Der Franck-Hertz-Versuch besteht aus einem Glaskolben, der mit Quecksilberdampf bei niedrigem Druck gefüllt ist. An der Kathode können durch Anlegen einer Heizspannung  Elektronen ausgelöst werden. Die Elektronen bilden eine Raumladungswolke um die Kathode. Zwischen der Kathode und dem Gitter ist die variable Beschleunigungsspannung
Elektronen ausgelöst werden. Die Elektronen bilden eine Raumladungswolke um die Kathode. Zwischen der Kathode und dem Gitter ist die variable Beschleunigungsspannung  angelegt, die die Elektronen beschleunigt. Zwischen dem Gitter und der Anode liegt die Gegenspannung
angelegt, die die Elektronen beschleunigt. Zwischen dem Gitter und der Anode liegt die Gegenspannung  an, welche ein Gegenfeld erzeugt. Nur Elektronen mit genügender kinetischer Energie, die das Gegenfeld überwinden, gelangen zur Anode und tragen zum Anodenstrom
an, welche ein Gegenfeld erzeugt. Nur Elektronen mit genügender kinetischer Energie, die das Gegenfeld überwinden, gelangen zur Anode und tragen zum Anodenstrom  bei, welcher mit einem geeigneten Amperemeter gemessen werden kann.
Angabe der Polung der Spannungen
bei, welcher mit einem geeigneten Amperemeter gemessen werden kann.
Angabe der Polung der Spannungen  und
und 

b)
Beim Franck-Hertz-Versuch wird bei konstanter Gegenspannung  die Beschleunigungsspannung
die Beschleunigungsspannung  langsam von
langsam von  vergrößert und dabei die Anodenstromstärke
vergrößert und dabei die Anodenstromstärke  gemessen.
gemessen.
Teillösung 2: Auswertung des Versuchs
a)
Im  -
- -Diagramm in Abbildung 2 erkennt man, dass ein Anodenstrom ab einer Beschleunigungsspannung von etwa
-Diagramm in Abbildung 2 erkennt man, dass ein Anodenstrom ab einer Beschleunigungsspannung von etwa  gemessen werden kann. Der Anodenstrom
gemessen werden kann. Der Anodenstrom  steigt mit der Beschleunigungsspannung bis etwa
steigt mit der Beschleunigungsspannung bis etwa  an und fällt dann bis zu
an und fällt dann bis zu  auf ein Minimum ab. Danach steigt die Anodenstromstärke wieder bis zu einem weiteren Maximum bei
auf ein Minimum ab. Danach steigt die Anodenstromstärke wieder bis zu einem weiteren Maximum bei  an, welches über dem Maximum von
an, welches über dem Maximum von  liegt. Danach fällt der Anodenstrom wieder zu einem Minimum bei
liegt. Danach fällt der Anodenstrom wieder zu einem Minimum bei  ab. Dies wiederholt sich mehrmals mit Maximalwerten des Anodenstroms bei Beschleunigungsspannungen von
ab. Dies wiederholt sich mehrmals mit Maximalwerten des Anodenstroms bei Beschleunigungsspannungen von  und
und  .
.
b)
Man kann erst einen Anodenstrom  ab einer Beschleunigungsspannung
ab einer Beschleunigungsspannung  messen, da die Elektronen zunächst die Gegenspannung von
messen, da die Elektronen zunächst die Gegenspannung von  überwinden müssen, um zur Anode zu gelangen und somit zum Anodenstrom beitragen zu können.
überwinden müssen, um zur Anode zu gelangen und somit zum Anodenstrom beitragen zu können.
c)
Erklärung des erstmaligen Absinkens der Stromstärke
Die Elektronen durchlaufen zwischen der Kathode und dem Gitter die Beschleunigungsspannung. Ist die Beschleunigungsspannung entsprechend groß, so können die Elektronen unmittelbar vor dem Gitter Quecksilberatome durch Stöße anregen. Dabei verlieren die Elektronen ihre kinetische Energie und können das Gegenfeld zwischen Gitter und Anode nicht mehr überwinden. Der Strom  beginnt zu sinken. Da dieses erstmalige Absinken bei
beginnt zu sinken. Da dieses erstmalige Absinken bei  stattfindet, deutet dies auf eine Anregungsenergie der Quecksilberatome von etwa
stattfindet, deutet dies auf eine Anregungsenergie der Quecksilberatome von etwa  hin.
Erklärung warum die Stromstärke noch weitere Male absinkt
Das Absinken der Stromstärke tritt noch vier weitere Male auf, da sich bei den ablesbaren Spannungsvielfachen zwei bzw. drei bzw. vier bzw. fünf solcher Stoßzonen zwischen der Kathode und dem Gitter ausgebildet haben, wo ein Elektron diesen Stoßprozess entsprechend mehrmals durchlaufen kann.
Bestimmung der Anregungsenergie
hin.
Erklärung warum die Stromstärke noch weitere Male absinkt
Das Absinken der Stromstärke tritt noch vier weitere Male auf, da sich bei den ablesbaren Spannungsvielfachen zwei bzw. drei bzw. vier bzw. fünf solcher Stoßzonen zwischen der Kathode und dem Gitter ausgebildet haben, wo ein Elektron diesen Stoßprozess entsprechend mehrmals durchlaufen kann.
Bestimmung der Anregungsenergie  von Quecksilber
Die Anregungsenergie der Quecksilberatome
von Quecksilber
Die Anregungsenergie der Quecksilberatome  ergibt sich aus den Beschleunigungsspannungen
ergibt sich aus den Beschleunigungsspannungen  des Anodenstroms
des Anodenstroms 
Für den Mittelwert der Spannungsdifferenzen gilt:
Damit ergibt sich für die Anregungsenergie der Quecksilberatome:  Berechnung der Wellenlänge
Berechnung der Wellenlänge  Für die ausgesandte Strahlung gilt:
Für die ausgesandte Strahlung gilt:
![\(\begin{array}[t]{rll}
E_{\text{Hg}}&=& h \cdot \dfrac{c}{\lambda_{\text{Hg}}}& \quad \scriptsize \mid\; \cdot \lambda_{\text{Hg}} \\[5pt]
E_{\text{Hg}} \cdot \lambda_{\text{Hg}}&=& h \cdot c &\quad \scriptsize \mid\; \cdot \dfrac{1}{E_{\text{Hg}}} \\[5pt]
\lambda_{\text{Hg}}&=& h \cdot \dfrac{c}{E_{\text{Hg}}} &\quad \scriptsize \\[5pt]
\end{array}\)](https://www.schullv.de/resources/formulas/ab949e56272a625b9b9512e90d63ad77580aa2caf586521b8dadb08b79a151ba_light.svg) Aus der Fomelsammlung lassen sich die Werte für die Konstanten
Aus der Fomelsammlung lassen sich die Werte für die Konstanten  und
und  entnehmen:
entnehmen:
![\(\begin{array}[t]{rll}
h&=& 6,62607015 \cdot 10^{-34} \; \text{Js}&\quad \scriptsize \\[5pt]
c&=& 2,99 792 458 \cdot 10^8 \frac{\text{m}}{\text{s}}
\end{array}\)](https://www.schullv.de/resources/formulas/75a8c4f17c9c0d01fbb99e216d86ae3403b388195704e820fafaff583120e947_light.svg) Einsetzen der Werte liefert:
Begründung der Unsichtbarkeit der Strahlung der Wellenlänge
Einsetzen der Werte liefert:
Begründung der Unsichtbarkeit der Strahlung der Wellenlänge  Licht dieser Wellenlänge ist dem UV-Bereich zuzuordnen und ist für das menschliche Auge nicht sichtbar.
Licht dieser Wellenlänge ist dem UV-Bereich zuzuordnen und ist für das menschliche Auge nicht sichtbar.
| 4,9 | |
| 9,5 | 4,6 |
| 14,4 | 4,9 |
| 19,4 | 5,0 |
| 24,8 | 5,4 |
| 29,3 | 4,5 |
d)
Aus dem Energieschema in Abbildung 3 wird deutlich, dass langwellige und damit auch sichtbare Strahlung erst dann vom Quecksilberatom emittiert werden kann, wenn zuvor Anregungen von mindestens  auftreten, da die sichtbare Strahlung erst bei Übergängen zwischen den „oberen“ Energieniveaus vorkommen. Dieser Prozess ist aber sehr unwahrscheinlich, da die Quecksilberatome im Grundzustand vorliegen und deshalb die anregenden Elektronen ab einer Energie von
auftreten, da die sichtbare Strahlung erst bei Übergängen zwischen den „oberen“ Energieniveaus vorkommen. Dieser Prozess ist aber sehr unwahrscheinlich, da die Quecksilberatome im Grundzustand vorliegen und deshalb die anregenden Elektronen ab einer Energie von  bereits ihre Energie mit hoher Wahrscheinlichkeit an die Hüllelektronen abgeben, die diese dann beim „Zurückfallen“ als
bereits ihre Energie mit hoher Wahrscheinlichkeit an die Hüllelektronen abgeben, die diese dann beim „Zurückfallen“ als  -
- -Linie abgeben.
-Linie abgeben.
e)
Nach Abbildung 3 ist die kleinste Anregungsenergie  Demnach gilt:
Demnach gilt:
![\(\begin{array}[t]{rll}
E&=& \dfrac{1}{2} \cdot m \cdot v^2 &\quad \scriptsize \mid\; \cdot\dfrac{2}{m} \\[5pt]
\dfrac{2\cdot E}{m} &=& v^2 &\quad \scriptsize \mid\; \sqrt{\;} \\[5pt]
\sqrt{\dfrac{2\cdot E}{m}}&=& v &\quad \scriptsize \\[5pt]
v &=& \sqrt{\dfrac{2\cdot E}{m}} &\quad \scriptsize \\[5pt]
\end{array}\)](https://www.schullv.de/resources/formulas/0640d83507bd8dea16770f4af32de9aed0556285bca3a87e14ecc072cdda569d_light.svg) Einsetzen der Werte liefert:
Einsetzen der Werte liefert:
![\(\begin{array}[t]{rll}
v &=& \sqrt{\dfrac{2 \cdot 4,89 \,\text{V} \cdot 1,6 \cdot 10^{-19} \,\text{C}}{9,1 \cdot 10^{-31} \text{kg}}}&\quad \scriptsize \\[5pt]
&=& 1,3 \cdot 10^6 \,\dfrac{\text{m}}{\text{s}}
\end{array}\)](https://www.schullv.de/resources/formulas/328d4fa0d63daa72f1370137fb5b59a9e55b4ba7a7eb59f7712fba8465408e18_light.svg)
Teillösung 3: Absorption von Energieportionen
a)
Beschreibung der Beobachtungen auf den Schirmen
In Abbildung 5 ist rechts ein ausgeleuchteter Schirm 2 zu erkennen. Auf dem linken Schirm 1 hingegen ist deutlich der Schatten der Bunsenbrennerflamme zu sehen.
Erläuterung der Beobachtungen
Die Natriumdampflampe emittiert Photonen, die eine genau passende Energie haben, um Natriumatome anzuregen. In der Bunsenbrennerflamme befinden sich durch das Kochsalz Natriumatome, die genau diese Photonen absorbieren und dadurch ein Schattenbild der Flamme entstehen lassen. Die Natriumatome gehen in einen angeregten Zustand über und beim Übergang in den Grundzustand emittieren sie zwar wieder Photonen, diese aber in alle Richtungen, sodass nur ein sehr kleiner Teil dieser Photonen auf den Schirm 1 trifft. Die Quecksilberdampflampe emittiert für die Natriumatome keine „passenden“ Photonen, um die Natriumatome anzuregen. Daher werden die Photonen der Quecksilberdampflampe nicht absorbiert, wodurch auf diesem Schirm 2 kein Schatten entsteht.
b)
Bei dem Versuch in Abbildung 5 werden die (Natrium-)Atome durch Photonen angeregt, welche ihre Gesamtenergie an die Atome abgeben und dadurch „vernichtet“ werden. Dabei muss die Photonenenergie genau mit der charakteristischen Anregungsenergie des Atoms übereinstimmen.
Beim Franck-Hertz-Versuch geben Elektronen durch unelastische Stöße ihre Energie an die (Quecksilber-)Atome ab. Dabei können die Elektronen einen beliebigen Teil ihrer Bewegungsenergie an die Atome übertragen. Dadurch nimmt die kinetische Energie der Elektronen dann um den übertragenen charakteristischen Energiebetrag des Atoms ab. Die Elektronen müssen demnach nur mindestens die kleinste charakteristische Anregungsenergie des Atoms haben.
c)
In dem Rutherford'schen Atommodell sind die Energien der Elektronen in der Atomhülle nicht diskret. Dies kann die quantisierte Energieübertragung in den Versuchen nicht erklären.