A1 Höhere und niedere Pilze
Höhere und niedere Pilze werden von Menschen in vielfältigen Bereichen genutzt. Sie unterscheiden sich in der Bildung ihrer Verbreitungsstadien, der Sporen.
1
Gießkannenschimmel der Gattung Aspergillus gehören zu den höheren Pilzen. Die in einigen Schimmelpilzarten wie z.B. Aspergillus oryzae vorkommende Kojisäure wird in Asien als Bestandteil von Kosmetika verwendet, da sie beim Auftragen auf die Haut zu einer Aufhellung dieser führt. Bräunlicher Teint oder auch sog. Altersflecken entstehen, da die Haut unter der Einwirkung des UV-Lichtes der Sonne das Pigment Melanin bildet, das die Haut vor schädlicher UV-Strahlung schützt. Abbildung 1 zeigt das Schema für die Melanin-Synthese aus der Aminosäure Tyrosin, an der u. a. das Enzym Tyrosinase beteiligt ist:


Abb. 1: Vereinfachtes Schema der Melanin-Synthese aus der Aminosäure Tyrosin
1.1
Erläutere eine Form von Spezifität bei Enzymen auf molekularer Ebene unter Verwendung geeigneter beschrifteter Skizzen.
(5 BE)
1.2
In einer Untersuchung mischte man unter vergleichbaren Bedingungen Lösungen von L-Dopa mit Tyrosinase. Diese Mischungen wurden mit Kojisäurelösungen verschiedener Konzentrationen versetzt. Anschließend wurde die relative Menge an gebildetem Dopachinon über die Zeit gemessen. Die Ergebnisse der Versuchsreihe sind in Abbildung 2 dargestellt:
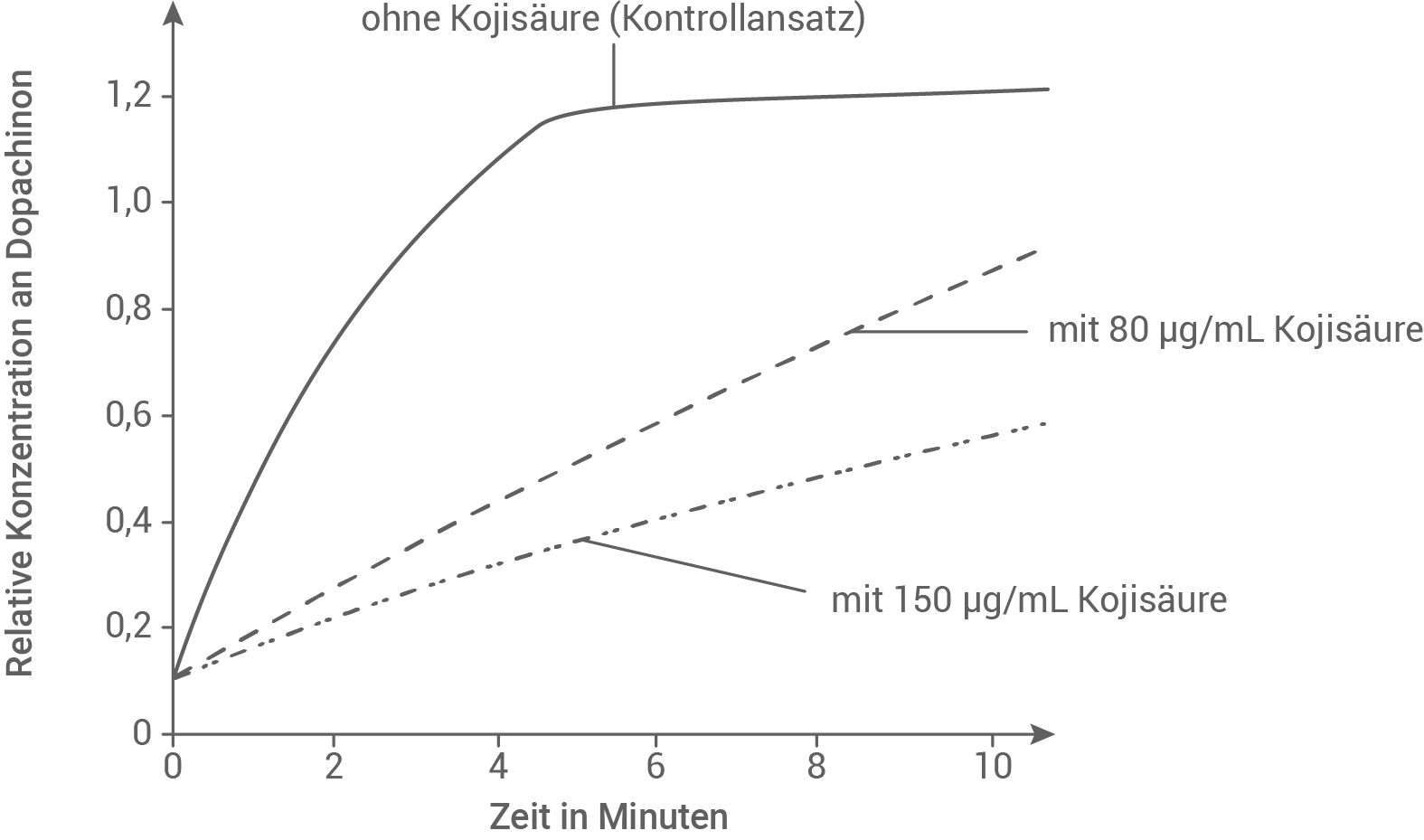

Abb. 2: Einfluss von Kojisäure auf die Bildung von Dopachinon
verändert nach: S. Jon et al.: Inhibitory effect of kojic acid on some plant and crustacean polyphenol oxidases. In: Journal of Agricultural and Food Chemistry, 39 (1991), S. 1396-1401
1.2.1
Beschreibe die in Abbildung 2 gezeigten Ergebnisse und formuliere eine begründete Hypothese zur Wirkung von Kojisäure auf den in Abbildung 1 gezeigten Reaktionsweg.
(6 BE)
1.2.2
Erkläre die Werte der relativen Dopachinon-Konzentration im Zeitraum zwischen 6 und 10 Minuten beim Ansatz ohne Kojisäure in Abbildung 2.
(3 BE)
1.3
Erkläre das mögliche Auftreten gesundheitlicher Risiken beim Einsatz von Kojisäure in Kosmetikprodukten.
(4 BE)
2
Zur Herstellung von Zitronensäure verwendet man zuckerhaltige Rüben-Melasse. Diese wird mit Sporen des Schimmelpilzes Aspergillus niger versetzt. Anschließend rührt man den Ansatz in flachen Wannen oder in einem Tank. Dabei werden große Mengen an Zitronensäure durch den Pilz abgegeben. Später kann die Zitronensäure aus dem Gemisch abgetrennt werden.
2.1
Die Abgabe der Zitronensäure aus den Pilzzellen heraus verläuft über Proteine in der Zellmembran.
Fertige eine beschriftete Skizze einer Biomembran an, die Proteine für den Stoffaustausch enthält, und erläutere einen passiven Transportmechanismus für Zitronensäure aus der Pilzzelle.
Fertige eine beschriftete Skizze einer Biomembran an, die Proteine für den Stoffaustausch enthält, und erläutere einen passiven Transportmechanismus für Zitronensäure aus der Pilzzelle.
(8 BE)
2.2
Vor wenigen Jahren zerstörten Wissenschaftlerinnen und Wissenschaftler das Gen, welches für das Membranprotein CexA codiert, mit der Genschere CRISPR/Cas bei Aspergillus niger und ließen den Pilz (CexA-Mutante) auf zuckerhaltigem Nährboden wachsen. Sie bestimmten unter vergleichbaren Bedingungen die Zitronensäure-Konzentration außerhalb der gentechnisch veränderten Zellen und außerhalb der Wildtyp-Zellen, die das funktionsfähige Gen enthalten. Abbildung 3 zeigt die Ergebnisse der Konzentrationsmessungen:
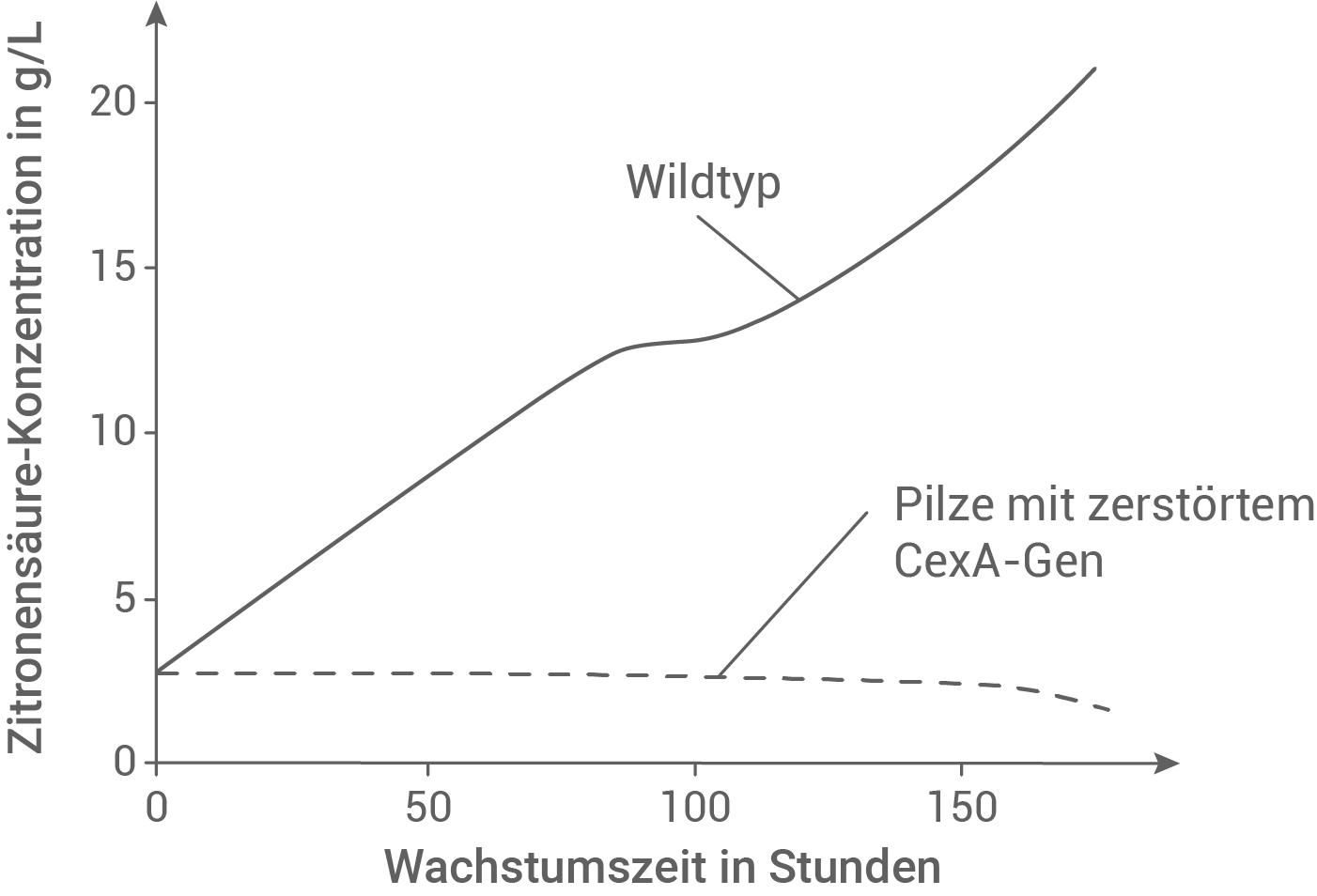 Formuliere die Hypothese, die mithilfe des Experiments überprüft werden sollte, und gib begründet an, ob diese durch das Experiment gestützt werden konnte.
Formuliere die Hypothese, die mithilfe des Experiments überprüft werden sollte, und gib begründet an, ob diese durch das Experiment gestützt werden konnte.

Abb. 3: Zitronensäure-Konzentration außerhalb der Wildtyp-Zellen sowie der CexA-Mutanten-Zellen
verändert nach: M. G. Steiger et al.: Engineering of the citrate exporter protein enables high citric acid production in Aspergillus niger. In: Metabolie Engineering, 52 (2019), S. 224-231
(4 BE)
3
Der Chytrid-Pilz Batrachochytrium dendrobatidis gehört zu den niederen Pilzen und bildet Sporen, die im Wasser beweglich sind. Er führt weltweit zu einer häufig tödlichen Hauterkrankung bei Amphibien, da sich die Sporen auf der Haut der Amphibien ansiedeln. In verschiedenen Seen in den Pyrenäen ist die Infektionsrate von Kaulquappen mit dem Chytrid-Pilz sehr unterschiedlich. So waren in einigen Seen keine Tiere infiziert und in anderen lag die Infektionsrate bei über 90 %. Forschende untersuchten die Ursachen dieser unterschiedlichen Infektionsraten in den Seen. Dabei zeigte sich, dass diese nicht durch Unterschiede in der Gewässerchemie erklärt werden konnten.
3.1
Die Forschenden untersuchten daraufhin die Zusammensetzung der Mikroorganismengemeinschaft und deren Wirkung auf die Infektionsrate in den verschiedenen Seen. Die Ergebnisse sind in den Abbildungen 4 und 5 dargestellt:
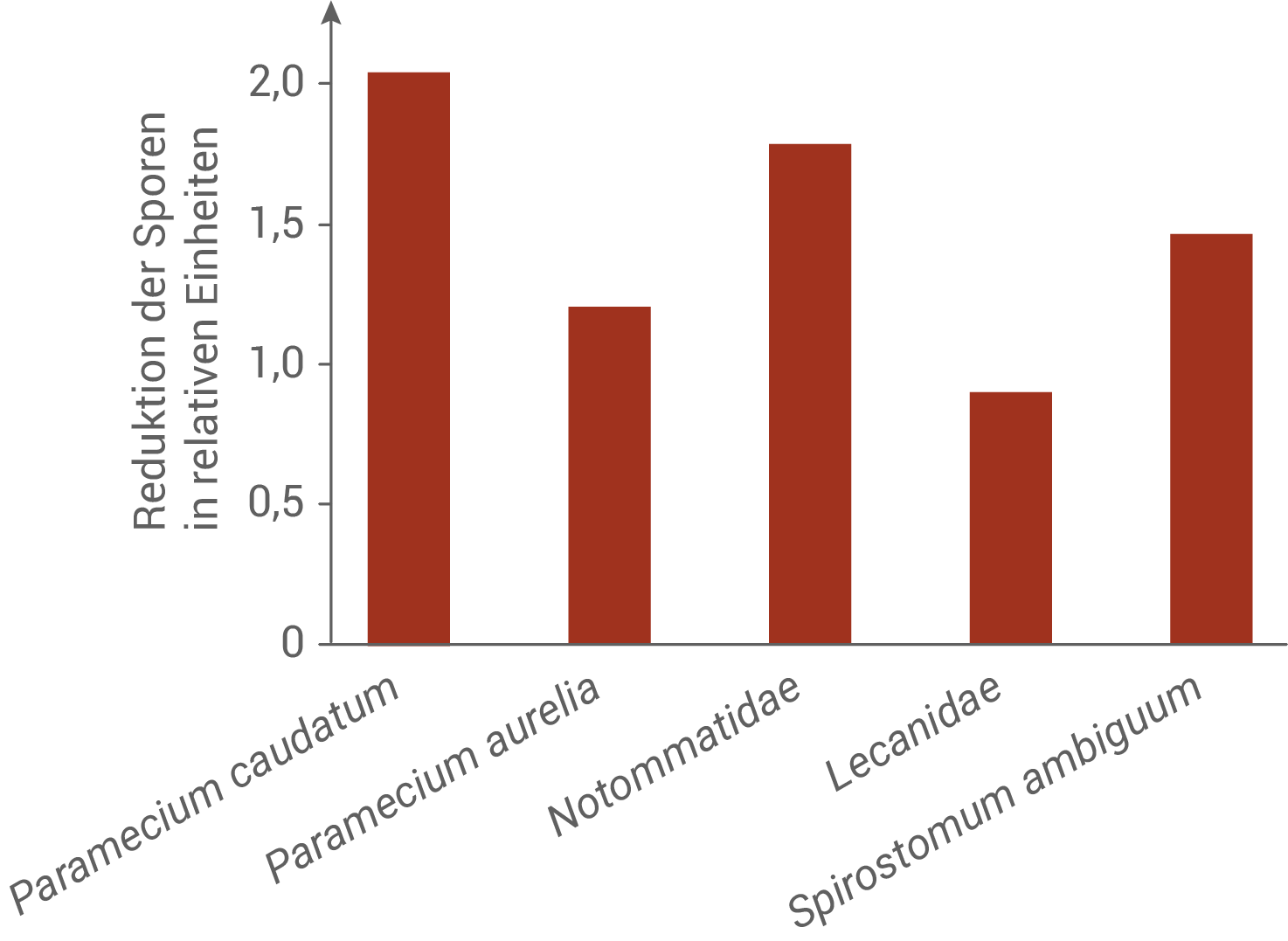
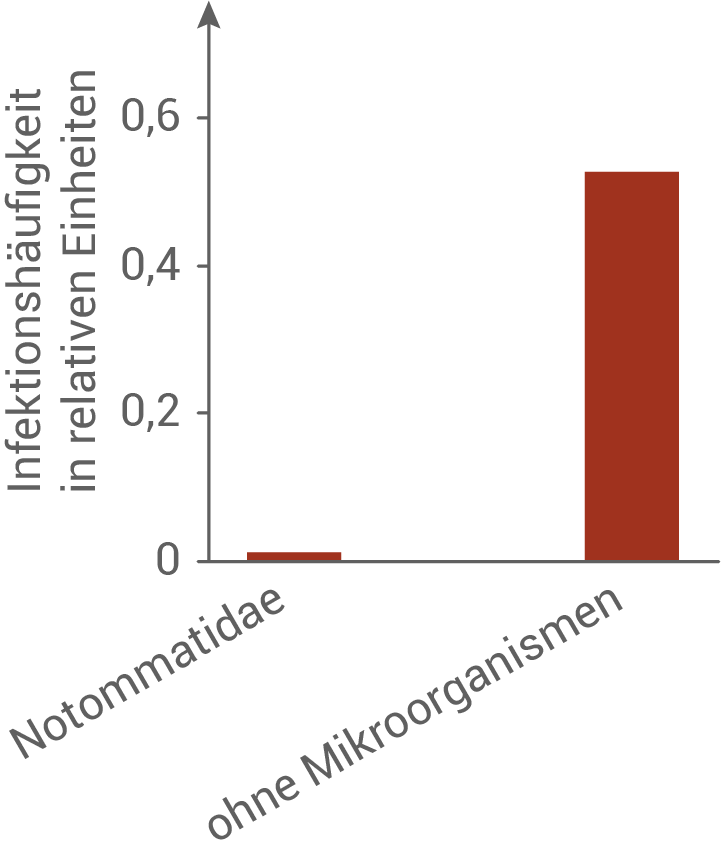 Beschreibe die in Abbildung 4 und 5 dargestellten Untersuchungsergebnisse und stelle unter Einbezug der gegebenen Informationen eine begründete Hypothese über eine mögliche Wechselwirkung von Notommatidae (Wimpernohren-Rädertiere) und Chytrid-Pilzen auf.
Beschreibe die in Abbildung 4 und 5 dargestellten Untersuchungsergebnisse und stelle unter Einbezug der gegebenen Informationen eine begründete Hypothese über eine mögliche Wechselwirkung von Notommatidae (Wimpernohren-Rädertiere) und Chytrid-Pilzen auf.

Abb. 4: Reduktion der Chytrid-Pilz-Sporen bei Anwesenheit verschiedener Mikroorganismen
verändert nach: https://www.cell.com/current-biology/fulltext/S0960-9822( 13)0 l 45 l -6?_return URL=h ttps %3A %2F%2Flinkinghu b.elsevier.com %2Fretrieve%2Fpii %2FS09609822l3014516 %3Fshowall%3Dtrue

Abb. 5: Infektionshäufigkeit bei Kaulquappen in Anwesenheit von Notommatidae bzw. ohne Mikroorganismen
verändert nach: https://www .cell.com/current-biology/fulltext/S0960-9822( l 3)0145 l -6?_return URL=https%3A %2F%2Flinki nghub.elsevier.com%2Fretrieve%2Fpii %2FS09609822130!45 l 6 %3Fshowall %3Dtrue
(5 BE)
3.2
Beschreibe eine Strategie zur Bekämpfung der weltweiten Chytrid-Pilz-Erkrankungen bei Amphibien, und diskutiere mögliche Auswirkungen der vorgeschlagenen Strategie auf Ökosysteme.
(5 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Substratspezifität bei Enzymen
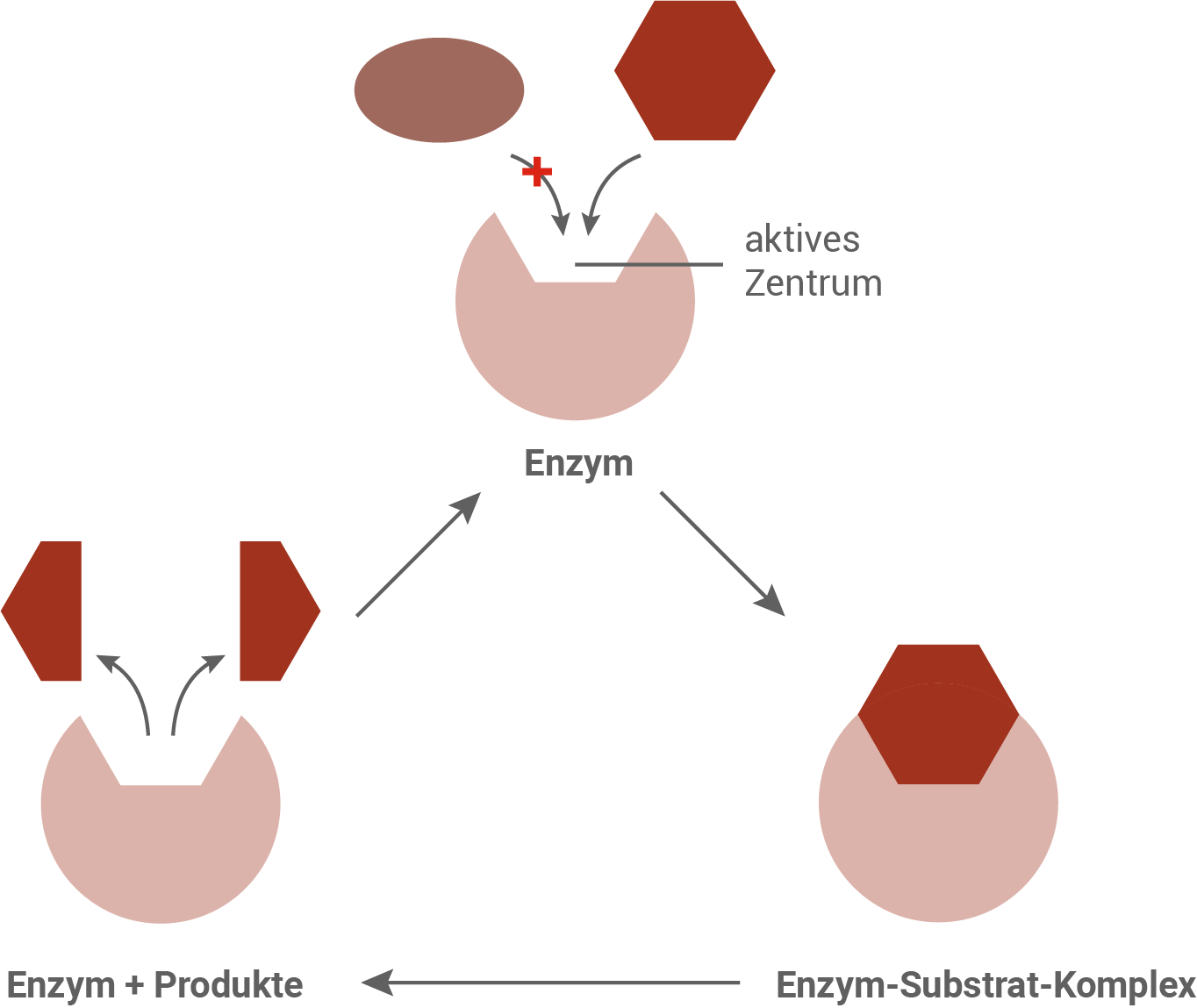 Aufgrund des Schlüssel-Schloss-Prinzips passt nur ein bestimmtes Substrat in das aktive Zentrum des Enzyms. Das gebundene Substrat wird vom Enzym umgesetzt, und die Produkte verlassen den Komplex.
Aufgrund des Schlüssel-Schloss-Prinzips passt nur ein bestimmtes Substrat in das aktive Zentrum des Enzyms. Das gebundene Substrat wird vom Enzym umgesetzt, und die Produkte verlassen den Komplex.

1.2.1
Wirkung von Kojisäure auf den Reaktionsweg
In Abbildung 2 ist die relative Konzentration an Dopachinon gegen die Zeit in Minuten aufgetragen. Im Ansatz ohne Kojisäure läuft der Reaktionsweg unter Normalbedingungen ab. Am zugehörigen Graph lässt sich erkennen, dass die relative Konzentration an Dopachinon in den ersten Minuten stark ansteigt, und nach etwa sechs Minuten konstant bei einer relativen Konzentration von 1,2 bleibt. Die Zugabe von Kojisäure einer Konzentration von 80 µg/mL führt zu einer deutlichen Abflachung der Kurve. Nach sechs Minuten ist die relative Konzentration an Dopachinon erst bei einem Wert von 0,6 relativen Einheiten. Wird 150 µg/mL Kojisäure der Reaktion zugesetzt, so ist die Kurve noch flacher. Hier beträgt die relative Konzentration nach sechs Minuten nur etwa 0,4.
Aus dem Diagramm kann abgelesen werden, dass die Synthese von Dopachinon bei steigender Konzentration der Kojisäure im Vergleich zum Kontrollansatz sinkt. Je höher die Konzentration der Kojisäure ist, desto weniger Dopachinon wird produziert.
Eine mögliche Erklärung für diese Beobachtung ist die kompetitive Hemmung. Dabei wird angenommen, dass Kojisäure eine ähnliche Struktur wie L-Dopa aufweist. Die beiden Substrate L-Dopa und Kojisäure konkurrieren um das aktive Zentrum des Enzyms Tyrosinase. Bindet Tyrosinase Kojisäure, dann entsteht bei dieser Reaktion kein Dopachinon. Folglich sinkt die Dopachinonkonzentration bei Zugabe von Kojisäure.
Alternativ könnte es sich auch um eine allosterische Hemmung handeln. Kojisäure bindet als Hemmstoff an ein allosterisches Zentrum der Tyrosinase. Dadurch verändert sich die räumliche Struktur des Enzyms. Die Bindungsaffinität für L-Dopa an das aktive Zentrum ist herabgesetzt (oder ein Teil der Enzymmoleküle ist vorübergehend inaktiviert), und es wird weniger Dopachinon gebildet.
1.2.2
Relative Dopachinonkonzentration zwischen 6 und 10 Minuten im Kontrollansatz
Nach etwa 6 Minuten bleibt die relative Konzentration an Kojisäure im Kontrollansatz konstant, und steigt nicht mehr weiter an. Der Grund dafür ist, dass das Substrat L-Dopa ab diesem Zeitpunkt schon fast vollständig zu dem Produkt Dopachinon umgesetzt wurde.
1.3
Gesundheitliche Risiken bei Einsatz von Kojisäure in Kosmetikprodukten
Kojisäure verhindert die Melaninsynthese indem das am Reaktionsweg beteiligte Enzym Tyrosinase gehemmt wird. Melanin ist jedoch ein wichtiges Pigment, das die Haut vor gefährlicher UV-Strahlung schützt. Bei dem Einsatz von Kojisäure in Kosmetika wird dieser Schutz zerstört. UV-Strahlung schädigt in zu hohen Dosen die DNA in den Hautzellen, und steigert damit beispielsweise das Risiko für Hautkrebs.
2.1
Skizze einer Biomembran
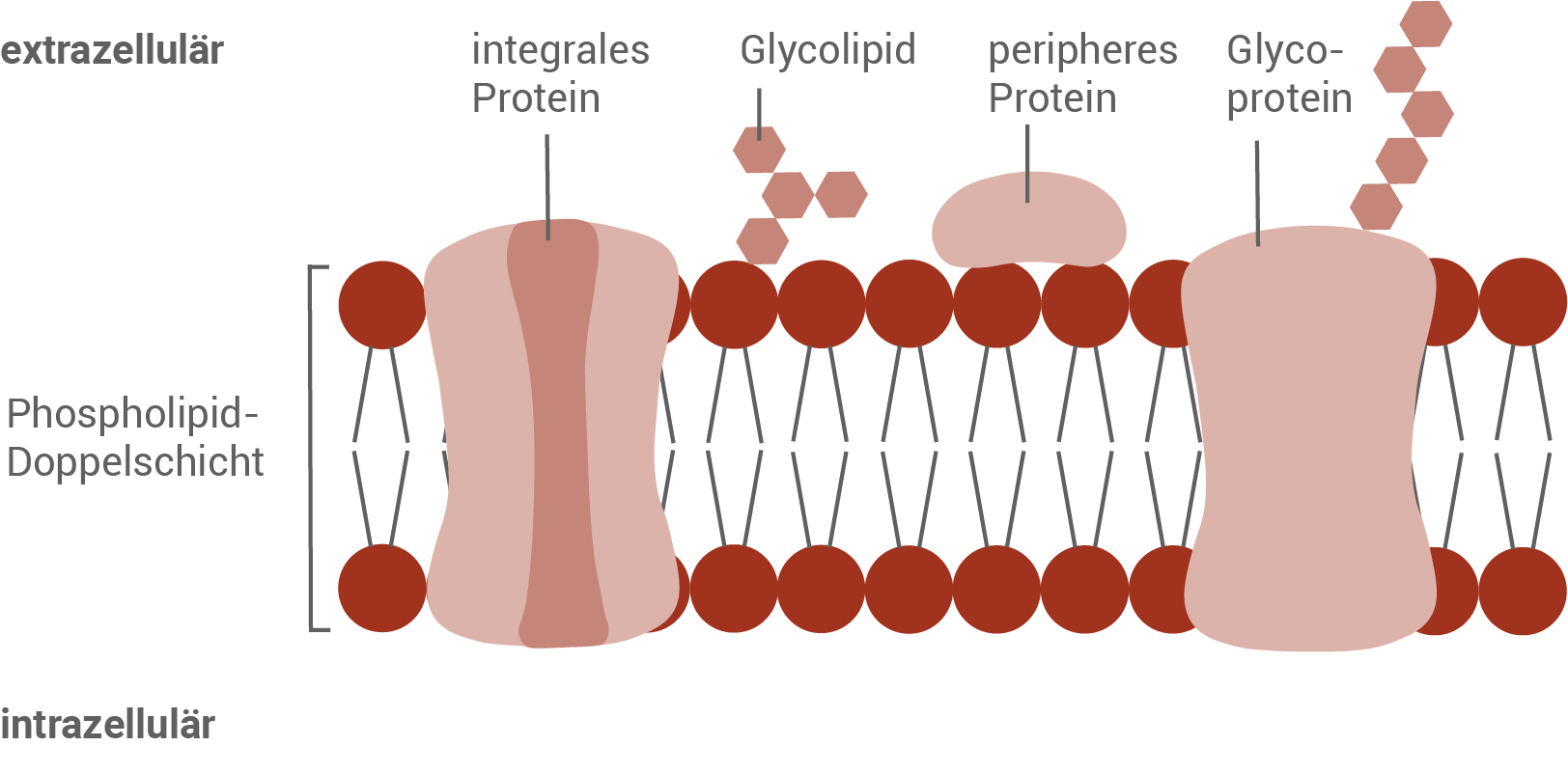 Passiver Transportmechanismus für Zitronensäure aus der Pilzzelle
Über integrale Membranproteine kann die Zitronensäure aus dem Zellinneren nach außen diffundieren. Die Zitronensäure folgt dabei ihrem Konzentrationsgefälle, und es wird keine zusätzliche Energie für den Transport benötigt.
Passiver Transportmechanismus für Zitronensäure aus der Pilzzelle
Über integrale Membranproteine kann die Zitronensäure aus dem Zellinneren nach außen diffundieren. Die Zitronensäure folgt dabei ihrem Konzentrationsgefälle, und es wird keine zusätzliche Energie für den Transport benötigt.

2.2
Hypothese, die mithilfe des Experiments überprüft werden sollte
Eine mögliche Hypothese könnte lauten: „Das Membranprotein CexA ist für den Transport der Zitronensäure notwendig.“
Im Experiment wurde die Zitronensäurekonzentration in g/L gegen die Wachstumszeit in Stunden aufgetragen. Es wurden Wildtyp-Pilze und Pilze mit zerstörtem CexA-Gen untersucht. Bei den Wildtyppilzen steigt die Zitronensäurekonzentration dabei über den gesamten Zeitraum an. Bei den Pilzen mit zerstörtem CexA-Gen bleibt die Zitronensäurekonzentration über den gesamten Zeitraum konstant, und geht gegen Ende des Experimentes sogar ein wenig zurück. Der Versuch zeigt, dass die Konzentration an Zitronensäure in Abwesenheit des CexA-Membranproteins konstant bleibt. Es wird also keine Zitronensäure nach außen transportiert. Damit bestätigt das Experiment die Hypothese.
3.1
Untersuchungsergebnisse aus Abbildung 4 und 5
In Abbildung 4 ist die Reduktion der Chytrid-Pilz-Sporen bei Anwesenheit verschiedener Mikroorganismen dargestellt. Alle untersuchten Mikroorganismen reduzieren die Pilzsporen, bei den Arten Paramecium caudatum, Notommatidae und Spirostomum ambiguum ist der Effekt allerdings besonders signifikant.
In Abbildung 5 ist die Infektionshäufigkeit bei Kaulquappen in Anwesenheit von Notommatidae und ohne Mikroorganismen dargestellt. Dabei ist zu erkennen, dass die Infektionshäufigkeit ohne Mikroorganismen bei etwa 0,5 relativen Einheiten liegt. Sind Notommatidae im Gewässer anwesend, so liegt die Infektionshäufigkeit der Kaulquappen jedoch nahezu bei null.
Hypothese über mögliche Wechselwirkungen von Notomatidae und Chytrid-Pilzen
Aus Abbildung 4 und 5 geht hervor, dass ein Zusammenhang zwischen der Anwesenheit von Mikroorganismen wie Notomatidae und der Infektionshäufigkeit der Kaulquappen besteht. Eine mögliche Hypothese ist, dass Mikroorganismen die Sporen reduzieren, indem sie diese fressen. Die Reduktion der Sporen führt zu einer verringerten Ausbreitung der Chytrid-Pilze und die Infektionsrate sinkt.
3.2
Strategie zur Bekämpfung der weltweiten Chytrid-Pilz-Erkrankungen bei Amphibien
Eine Möglichkeit, die Chytrid-Pilz-Erkrankungen bei Amphibien zu reduzieren, wäre ein Ausbringen von Notomatidae-Kulturen in Gewässer, die den Amphibien als Lebensraum dienen. Dadurch wird die Anzahl der Chytrid-Pilze sinken und das Infektionsrisiko für Amphibien verringert. So kann die Amphibienpopulation auf Dauer gesteigert werden. Der Eingriff in das Ökosystem kann aber auch negative Folgen haben. Möglicherweise wird durch diese Maßnahme die Biodiversität verringert, da Notommatidae in Konkurrenz zu anderen Mikroorganismen stehen. Die Veränderung der Zusammensetzung der Mikroorganismen in einem Gewässer kann bisher unentdeckte Probleme mit sich bringen.