Gleichgewichts- und Nichtgleichgewichtsreaktion
Gleichgewichtsreaktionen
Unterschied zur Nichtgleichgewichtsreaktion
Was sind Gleichgewichtsreaktionen eigentlich? Diese Frage wollen wir in diesem Kapitel klären, damit wir im Nachhinein verstehen, über was wir reden. Am besten können wir das vergleichend tun, indem wir uns Reaktionen anschauen, die nicht im chemischen Gleichgewicht stehen.
Eine relativ einfache chemische Reaktion wäre durch folgende Reaktionsgleichung beschrieben:
Hier reagieren zwei Edukte A und B zu einem Produkt C. Der Reaktionspfeil verdeutlich uns, dass am Ende der Reaktion nur das Produkt C vorhanden ist; die Edukte sind vollständig umgesetzt worden.
Jetzt könntest du dich natürlich Fragen, was passieren würde, wenn Edukte und Produkt gleichzeitig anteilig vorhanden wären. Dabei sprechen wir nicht davon, einen Überschuss des einen Edukts zu verwenden, welches dann einfach auf Grund der Stöchiometrie nicht umgesetzt werden kann, sondern dass in einer solchen Reaktion neben dem Produkt auch noch Edukte vorliegen. Dies ist dann eine so genannte Gleichgewichtsreaktion. Dieses System befindet sich im chemischen Gleichgewicht.
Diese Reaktionsgleichung sieht vergleichsweise einfach aus, dennoch passiert in unserer Reaktion noch eine ganze Menge, was das chemische Gleichgewicht ausmacht. Ein chemisches Gleichgewicht hat die Eigenschaft, dass sich im System makroskopisch nichts mehr ändert. Wenn sich das Gleichgewicht eingestellt hat, ändert sich an der Menge der Edukte und Produkte im weiteren zeitlichen Verlauf nichts mehr. Die Konzentrationen der Reaktanden bleiben konstant.
Auf mikroskopischer Ebene reagieren weiterhin die Moleküle der Edukte zum Produkt, während das Produkt wieder in die Edukte zerfällt. Hin- und Rückreaktionen halten sich dabei die Waage. Das chemische Gleichgewicht kann also als dynamisches Gleichgewicht verstanden werden.
Wird die Reaktion gestartet, bedarf es erst einer gewissen Zeit, bis sich der Gleichgewichtszustand einstellt.
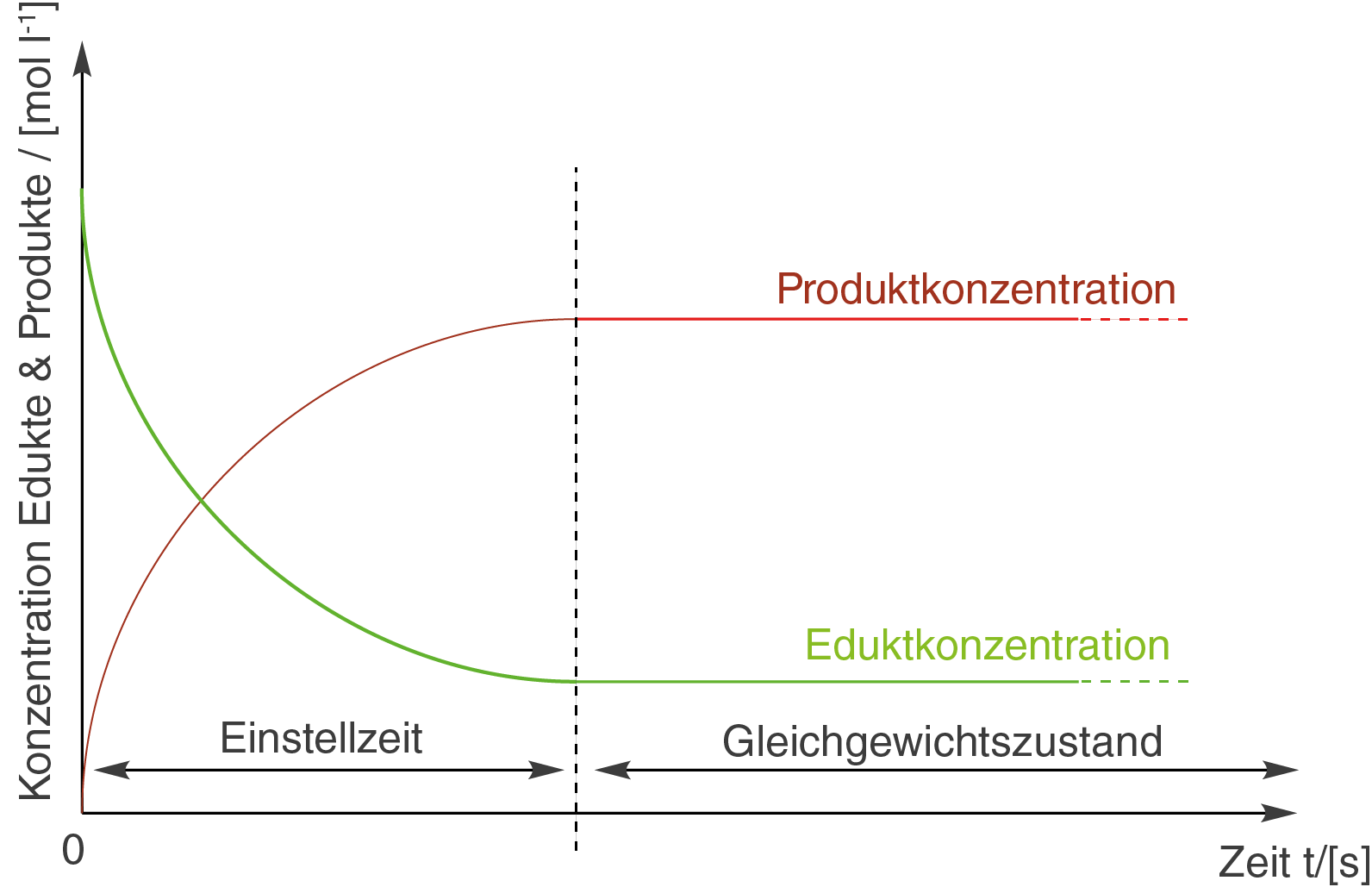
Der Gleichgewichtszustand ist genau dann erreicht, wenn die Reaktionsgeschwindigkeiten der beiden Reaktionspfade, also Hin- und Rückreaktion, gleich sind. Das heißt, dass sich die Konzentrationen der Reaktanden nicht mehr ändern. Den Begriff der Reaktionsgeschwindigkeit greifen wir später wieder auf.
Thermodynamische Betrachtung der Gleichgewichtsreaktion
Hier wollen wir Gleichgewichtsreaktionen unter energetischen (thermodynamischen) Gesichtspunkten betrachten. Dazu müssen wir an dieser Stelle bereits auf die Grundlagen der chemischen Energetik (Thermodynamik) zurückgreifen. Aus diesem Grund wirst du an dieser Stelle die wichtigsten Zusammenhänge zwar kennen lernen, ausführlich werden diese aber im Kapitel der Chemischen Energetik (Thermodynamik) behandelt.
Wir beginnen mit der Einführung der Reaktionsenthalpie , die sich aus der Differenz der Summen von Standardbildungsenthalpien der Produkte und Edukte zusammensetzt:
Weiterhin benötigen wir die Definition der Reaktionsentropie :
Nun haben wir alle Größen beisammen, um im nächsten Schritt die Gibbs-Helmholtz-Gleichung zu formulieren, welche uns erlaubt das chemische Gleichgewicht energetisch (thermodynamisch) zu formulieren.
Die Größe wird freie Reaktionsenthalpie (auch: Gibbs-Helmholtz-Energie) genannt. Damit bist du z.B. in der Lage in Abhängigkeit von der Temperatur zu bestimmen, ob eine chemische Reaktion freiwillig
oder nicht freiwillig
ablaufen wird.
Du hast nun die beiden Fälle gesehen, dass die freie Enthalpie größer bzw. kleiner als null ist. Wenn wir uns jetzt wieder unserem chemischen Gleichgewicht zuwenden, dann betrachten wir den noch möglichen, dritten Fall:
Wenn diese Gleichung gilt, dass heißt wenn die Änderung der freien Enthalpie gleich null ist, dann ist das betrachtete System im chemischen Gleichgewicht.
Was könntest du mit diesem Wissen nun anfangen? Du könntest beispielsweise die Temperatur berechnen, bei der sich eine Reaktion im chemischen Gleichgewicht befindet. Dazu kannst du
nach umformen:
Nun setzt du noch die Terme für die Standardreaktionenthalpie und die Standardreaktionsentropie ein:
Die Werte für die reaktionsspezifischen und
kannst du Tabellen entnehmen und somit die Gleichgewichtstemperatur ausrechnen.