Polymersynthese II: Polykondensation
Polykondensation
Einführung
Polymere können auf unterschiedlichen Wegen gewonnen werden, die sowohl vom Produkt als auch von den eingesetzten Edukten abhängen. Wir wollen uns in diesem Skript mit der Polykondensation beschäftigen. Diese Art der Polymersynthese erlaubt uns verschiedene Monomere mit charakteristischen funktionellen Gruppen zu Polymeren zu verknüpfen. Diese Gruppe der Polymere nennen wir Polykondensate. In diesem Zusammenhang werden wir dann auch wieder auf die Struktur-Eigenschafts-Beziehungen zu sprechen kommen (vgl. ChemieLV - Skript Makromoleküle - Struktur und Eigenschaft). Die mechanischen Eigenschaften des Polymers werden nämlich durch die Struktur der Monomere und intermolekulare Wechselwirkungen zwischen den Polymerketten bestimmt. Im Rahmen dieses Skripts wirst du lernen, wie Polyester gebildet werden, also die Verbindung, die du vor allem aus der Kleidungsindustrie kennen wirst, wo sie neben Baumwolle standardmäßig eine große Anwendung findet.
Wir werden damit beginnen, den Begriff der Stufenreaktion zu besprechen, sodass wir die Polykondensation von Polymerisationsreaktionen mit Kettenwachstum, wie sie im Fall der Radikalischen Polymerisation vorliegt (vgl. ChemieLV - Skript Polymersynthese I: Radikalische Polymerisation), abgrenzen können. Im nächsten Schritt betrachten wir das Prinzip der Kondensationsreaktionen. Hieran werden wir erst einmal im Kleinen nachvollziehen, was bei diesem Reaktionstyp überhaupt passiert und welche charakteristischen Eigenschaften dieser aufweist. Anhand dieser Informationen kannst du eine Kondensationsreaktion dann auch sehr gut erkennen. Damit haben wir eine gute Grundlage erarbeitet, um im Anschluss in die Polymersynthese einzusteigen. Du wirst sehen, dass du mit deinem Wissen dann bereits verschiedene Polykondensate aus ihren Monomeren aufbauen kannst. Zum Abschluss des Skripts betrachten wir eine Reihe prominenter Vertreter der Polykondensate sowie ihre Verwendung im Alltag.
Stufenreaktionen
Stufenreaktionen zeichnen sich dadurch aus, dass hier Monomere mit mindestens zwei funktionellen Gruppen reagieren. Wir können nun zwischen den Monomeren unterscheiden, welche zwei identische funktionelle Gruppen und solchen, die zwei unterschiedliche funktionelle Gruppen aufweisen (vgl. Abb. 1).
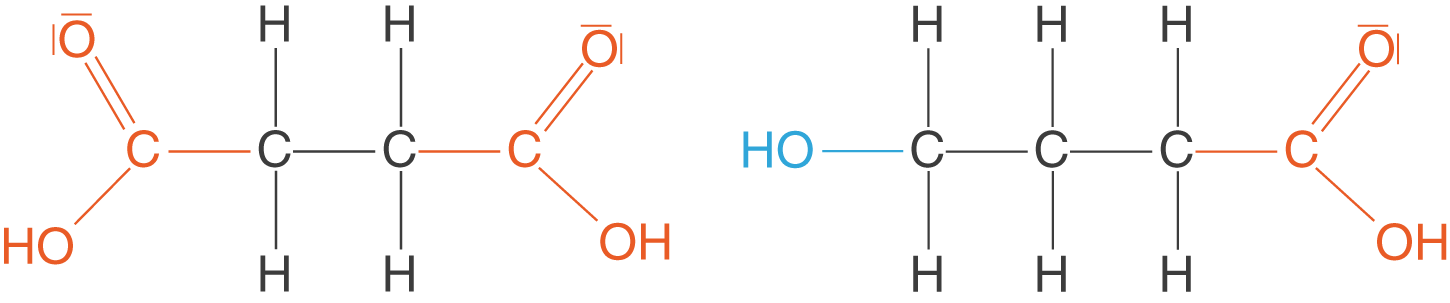
4-Butandisäure weist hier zwei identische funktionelle Gruppen auf: Je eine Carboxygruppe. Das zweite Beispiel ist 4-Hydroxybutansäure. Hier liegen zwei unterschiedliche funktionelle Gruppen vor: Eine Hydroxygruppe und eine Carboxygruppe.
Der entscheidende Punkt bei einer Stufenreaktion ist die Reaktion der Monomere bei der Polymerisation über die angesprochenen funktionellen Gruppen. Zunächst werden fast ausschließlich Dimere gebildet (hier durch Polykondensation), also eine Verbindung, die sich aus zwei Monomeren zusammensetzt. Im nächsten Schritt können die Dimere dann weiter reagieren. Ein wichtiger Unterschied zum Radikalkettenmechanismus (vgl. ChemieLV - Skript Polymersynthese I: Radikalische Polymerisation) besteht darin, dass so eine Reaktion nicht zum Abbruch des Kettenwachstums führt. Diese Tatsache führt uns auch schon zum nächsten Schritt. Eine solche Stufenreaktion, wie die Polykondensation, läuft nicht einfach von sich aus ab. Wir müssen die Reaktanden aktivieren. Wie das genau funktioniert, sehen wir etwas später. Das Polymer baut sich folglich nach und nach aus unterschiedlich langen Ketten bzw. anderen Monomeren auf (vgl. Abb. 2).
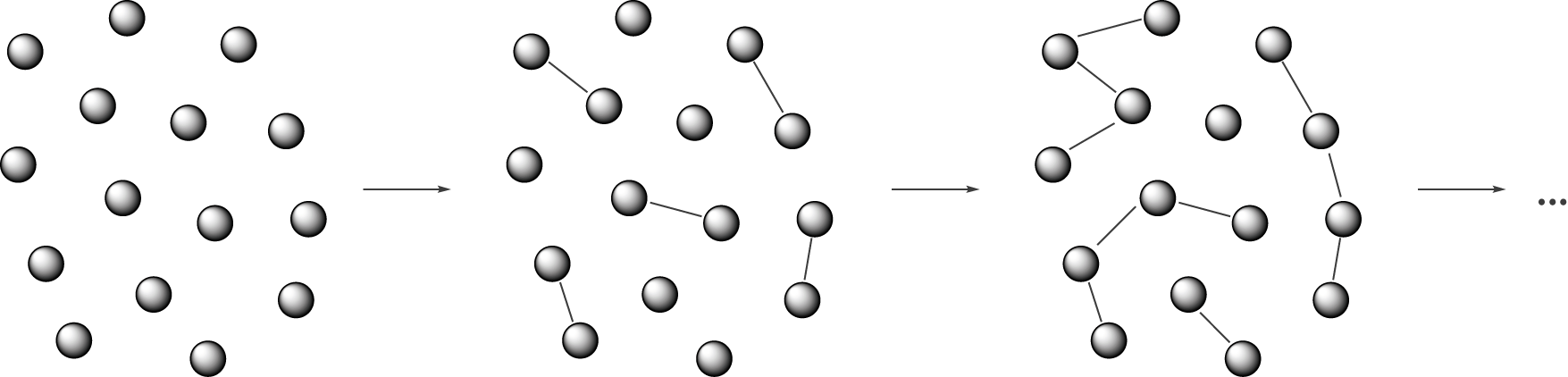
Wir wollen uns nun im nächsten Schritt mit dem Begriff der Kondensationsreaktion beschäftigen. Hier interessiert uns, wie diese Reaktion (der Mechanismus) überhaupt abläuft, welche Erkennungsmerkmale zu finden sind und natürlich welche Produkte entstehen. Wenn du diese Inhalte verstanden hast, dann ist es kein großer Schritt mehr hin zum Aufbau von Polymeren.
Kondensationsreaktionen
Kondensationsreaktionen zeichnen sich dadurch aus, dass eine solche Reaktion unter Abspaltung eines niedermolekularen Spaltprodukts verläuft. Hierunter kannst du dir ein relativ kleines Molekül vorstellen, welches während der Reaktion zusätzlich zum gewünschten Produkt gebildet wird. Beispiele, die du dir in diesem Zusammenhang merken solltest, sind Wasser (), Salzsäure (
) und Ammoniak (
).
Wir schauen uns hier zwei Beispiele für Kondensationsreaktionen an, die wir später genau so auch auf unsere Polykondensation übertragen können. Die Kondensation stellt den Reaktionstyp dar, durch welchen wir zwei bestimmte Monomere verknüpfen können. Das Hauptaugenmerk liegt hier auf der Reaktion, die zu der neuen Bindung führt. Im Fall der Polykondensation verwenden wir diese Möglichkeit der Verknüpfung von Monomeren dann dazu, kettenförmige Polymere zu synthetisieren. Wir lassen also viele ausgewählte Monomere in sehr viele Kondensationsreaktionen zu einem Kunststoff, dem Polymer, reagieren.
Esterbildung bzw. Veresterung
Polyester sind ein bedeutendes Beispiel für ein Polykondensat.
Die Esterbildung verläuft über eine Kondensationsreaktion, die wir uns hier detaillierter anschauen wollen. Dabei wird die Esterbindung () ausgebildet. Können wir mehrere Veresterungen an verschiedenen Enden unserer Monomere durchführen, so ist es möglich, mehrere Monomere über Esterbindungen zu einem Polymer zu knüpfen.
Die Spaltung von Esterverbindungen verläuft unter Anlagerung von Wasser, was zur Spaltung der Esterbindung führt. Diese Reaktion wird Hydrolyse genannt und stellt die Umkehrreaktion zur Veresterung dar.
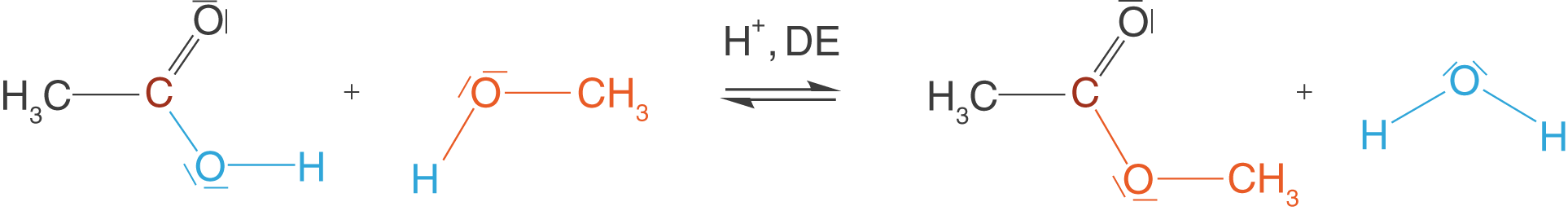
Abbildung 4 sehen wir, wie aus Ethansäure durch eine säurekatalysierte Reaktion (Verwendung von ) mit Methanol ein Ethansäuremethylester entsteht. Wir können hier interessante Eigenschaften dieser Reaktion erkennen: Die
-Gruppe der Ethansäure wird komplett durch den Alkoholat-Rest des Alkohols ersetzt. Wir tauschen also nicht das nur
-Atom der Carboxygruppe gegen die
-Gruppe aus. Der zweite Aspekt liegt auf der Bildung von Wasser. Bei Kondensationsreaktionen werden neben den Hauptprodukten niedermolekulare Verbindungen gebildet. Dieses Spaltprodukt liegt hier in Form von Wasser vor. Dieses Merkmal ist sehr charakteristisch und daran kannst du Kondensationsreaktionen relativ gut erkennen. Du musst hierbei aber immer im Hinterkopf behalten, dass auch Verbindungen wie beispielsweise Salzsäure oder Ammoniak abgespalten werden können und es nicht immer Wasser sein muss!
Die nachfolgende Betrachtung brauchst du nicht für dein Abitur! Wir wollen an dieser Stelle einen Blick über den Tellerrand wagen und uns den Mechanismus der Veresterung detaillierter anschauen. Diese Zusatzinformation soll dir aufzeigen, was tatsächlich geschieht, wenn ein Ester gebildet wird. Damit erhältst du einen kleinen Einblick in die Welt der organischen Chemie.
Bedenke: Für dein Abitur musst du nur die Reaktion in Abbildung 4 kennen, die nachfolgenden Details sind für ein erfolgreiches Bestehen nicht relevant!
(1) Aktivierung der Carboxygruppe
Der Begriff der Aktivierung bezeichnet einen Vorgang, der beispielsweise eine funktionelle Gruppe so modifiziert, dass sie reaktiv wird. In diesem Fall wird die Aktivierung durch eine Säure bewerkstelligt, indem die Carboxygruppe protoniert wird. Unter Protonierung verstehen wir die Anlagerung eines Protons () an eine funktionelle Gruppe, die ein freies Elektronenpaar zur Verfügung stellen kann.
Wenn wir hier von Säure reden, dann führen wir nur das Proton (
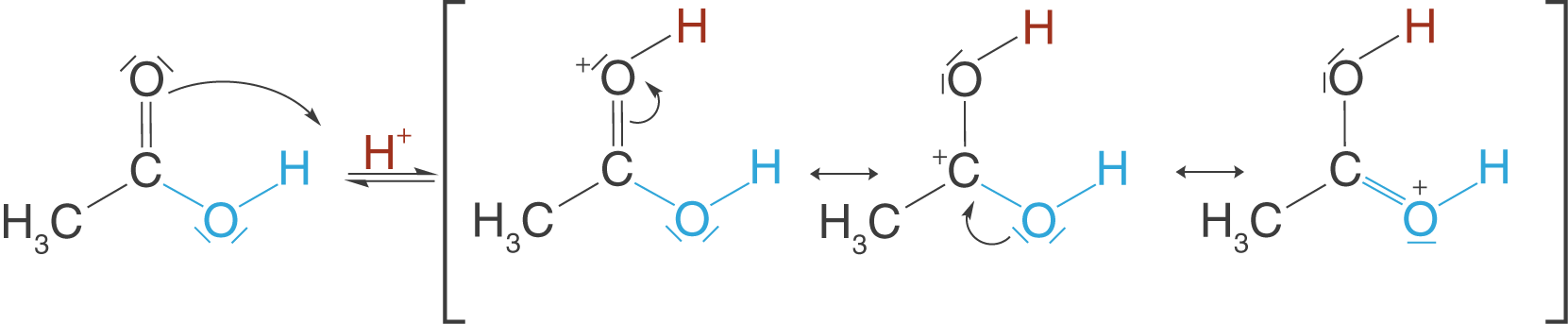
Nachdem wir die Carboxygruppe mithilfe des Protons aktivieren konnten, erhalten wir ein Molekül-Ion, für welches wir mesomere Grenzformeln zeichnen können. Die wahre Gestalt des Moleküls können wir nicht mit einer einzigen Strukturformel darstellen, sondern nur bestimmte Formen: die Grenzformeln. Die Realität liegt irgendwo zwischen diesen dreien.
Theoretisch könnte das Proton auch am Sauerstoffatom der Hydroxygruppe angreifen. Warum das so nicht passiert, kannst du mithilfe der mesomeren Grenzformeln erklären. Wird das Sauerstoffatom mit der Doppelbindung protoniert, dann ist das resultierende Molekül mesomeriestabilisiert. Wenn dahingegen die Hydroxygruppe protoniert wird, können wir weitaus weniger mesomere Grenzformeln aufstellen - das Molekül ist nicht so stabil und deshalb nicht zu beobachten. Es gilt: Je mehr mesomere Grenzformeln für ein Molekül möglich sind, desto stabiler ist es.
(2) Angriff des Methanols
Nun bringen wir unseren Alkohol ins Spiel. Aufgrund der Aktivierung kann das Methanol mit dem gebildeten Molekül-Anion reagieren. Dieser Schritt wird auch als Angriff des Methanols bezeichnet.
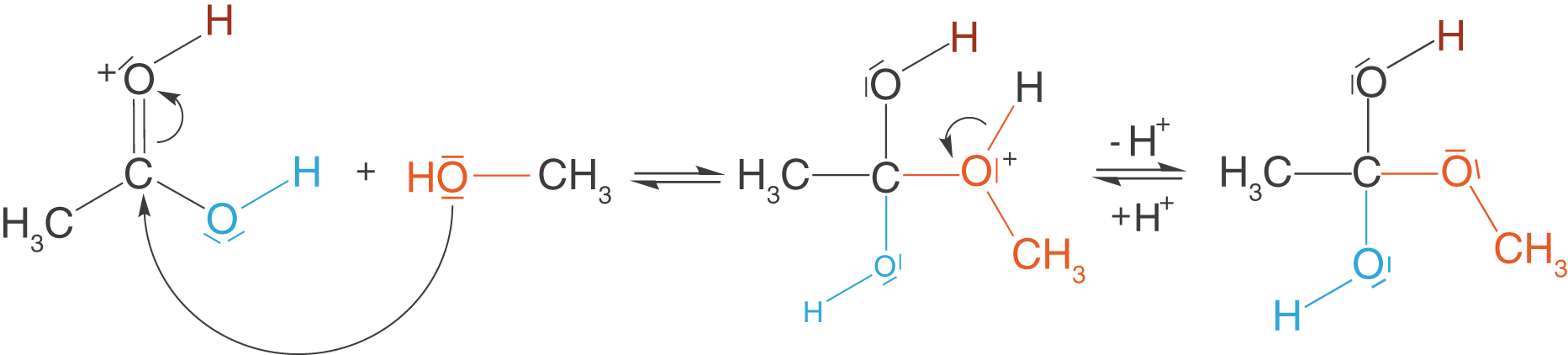
Im ersten Schritt passiert hier das, was wir als Angriff bezeichnen: Das Methanolmolekül lagert sich über sein O-Atom an das zentrale C-Atom des zuvor gebildeten Molekül-Ions an. Anschließend wird das Proton abgespalten (Deprotonierung), welches dem ehemaligen Alkohol angehörte. Wir haben nun ein ungeladenes Zwischenprodukt der Reaktion vorliegen.
(3) Abspaltung von Wasser
Erst im dritten und letzten Schritt kommt es zur Abspaltung von Wasser (zur besseren Darstellung hier ), wodurch du diese Reaktion als Kondensationsreaktion identifizieren kannst.
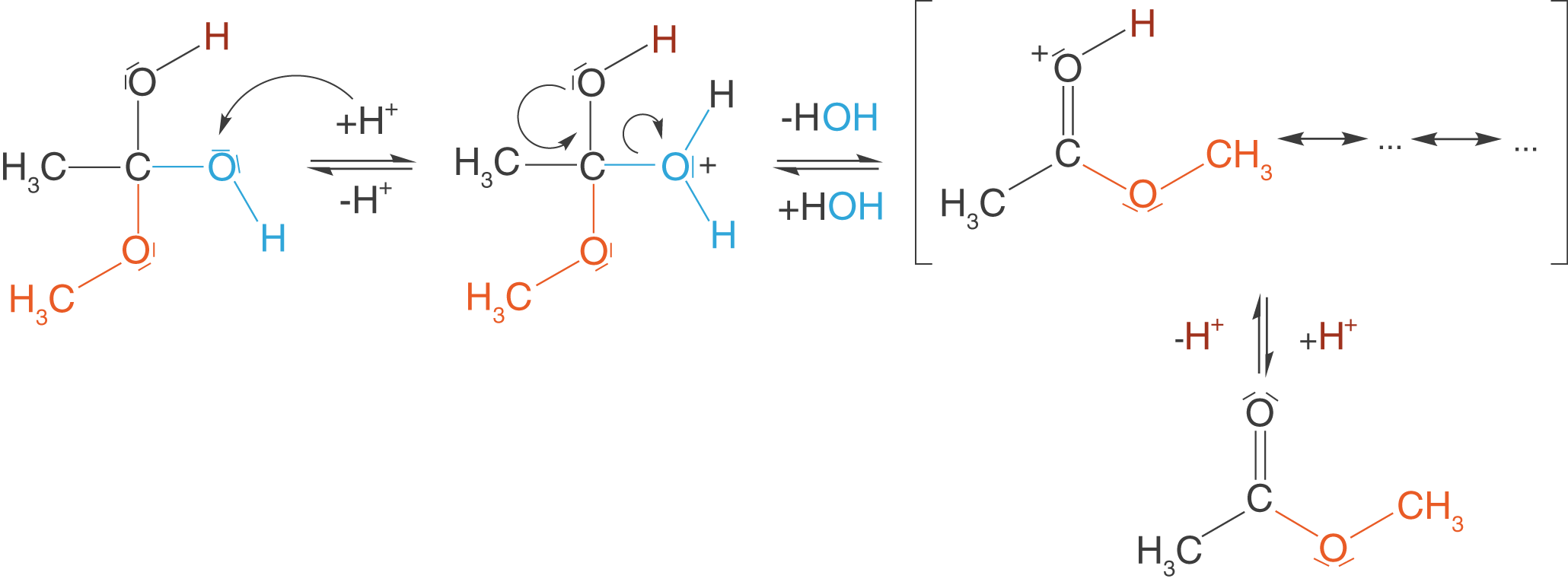
Die Hydroxygruppe des Zwischenprodukts wird nun zunächst protoniert und anschließend kann sich diese in Form von Wasser abspalten. Im letzten Schritt muss nur noch das Proton (hier rot eingefärbt), welches am Anfang die Carboxygruppe aktiviert hat, wieder abgespalten werden. Damit geht auch der Katalysator unverändert aus der Reaktion hervor. Die mesomeren Grenzformeln, die wir für das Molekül zeichnen können, das nach der Wasserabspaltung vorliegt, sind die gleichen, welche wir schon in Schritt eins kennen gelernt haben.
Du konntest hier sehen, dass eine ganze Menge passiert, was wir aber mit unserer ersten Reaktionsgleichung (vgl. Abb. 4) nicht darstellen konnten.
Amidbildung
Neben den Estern, die wir gerade besprochen haben, gibt es noch eine zweite wichtige Stoffklasse, die wir uns im Rahmen der Polykondensation anschauen wollen: die Amide. Amide sind Carbonsäure-derivate, das heißt, dass sie strukturell mit Carbonsäuren vergleichbar sind. In Abbildung 8 siehst du ein beispielhaftes Amid sowie die Amidgruppe an sich.
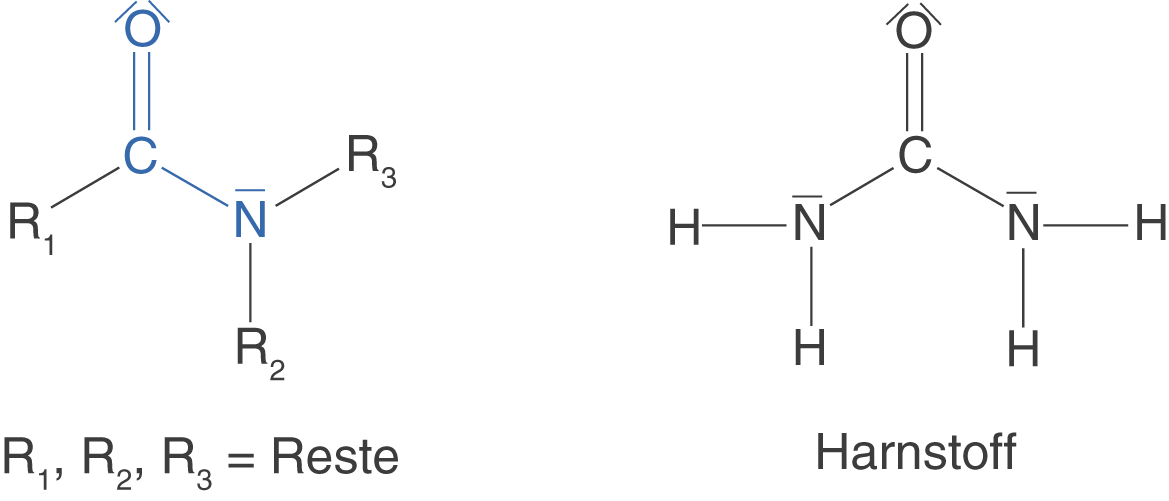
Neben den Polyestern, die wir über die Esterbindung miteinander verknüpfen wollen, lernen wir hier die Amidbindung kennen, welche ebenfalls den Aufbau von Polymeren ermöglicht - die Polyamide.
Wir wollen nun dazu übergehen, diese Bindung aus ausgewählten Monomeren zu knüpfen. Dazu benötigen wir eine zweite Stoffklasse, von welcher du mindestens einen Vertreter bereits kennen dürftest: die Amine. Amine sind Derivate des Ammoniaks (). Dabei können wir formal zwischen primären, sekundären und tertiären Aminen unterscheiden (vgl. Abb. 9).
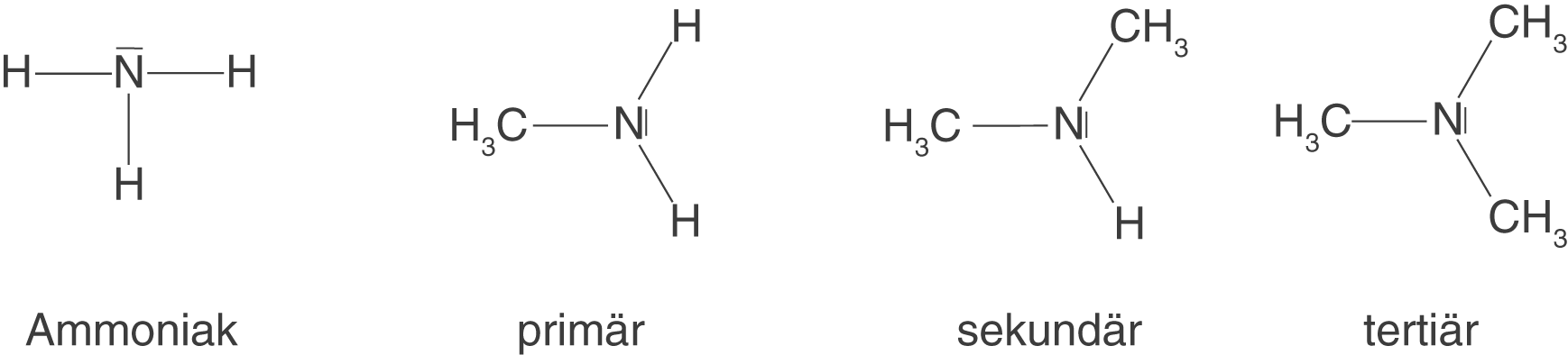
Wir benötigen nun diese Amine, um die Amidbindung (Peptidbindung) zu knüpfen. Wir beschränken uns an dieser Stelle, wie bereits bei der Esterbindung, auf das Knüpfen der Bindung. Wenn wir nachher zu den Polymeren kommen, dann wenden wir das hier erarbeitete Wissen nur noch an. Amide erhalten wir aus der Reaktion zwischen Carbonsäuren und Aminen. Beispielhaft lassen wir hier wieder die Essigsäure (Ethansäure) und ein primäres Amin, Methylamin, reagieren.
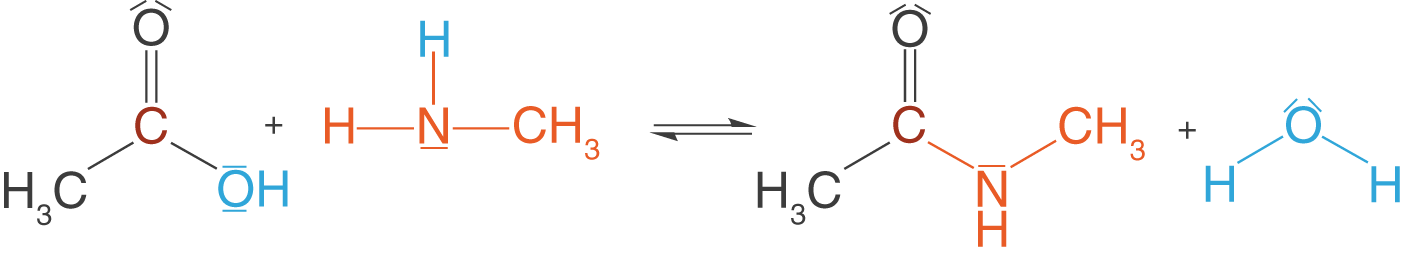
Im Folgenden gehen wir analog zur Veresterung auch kurz auf die Details der Amidbildung ein. Dieser Mechanismus ist deutlich übersichtlicher. Diese Informationen sind aber dennoch wieder nur als Blick über den Tellerrand zu verstehen. Für das erfolgreiche Bestehen deines Abiturs sind sie nicht relevant!
(1) Angriff des Amins
Am Stickstoffatom des Amins, in unserem Fall des Methylamins, befindet sich ein freies Elektronenpaar, welches am C-Atom der Carboxygruppe angreifen kann.
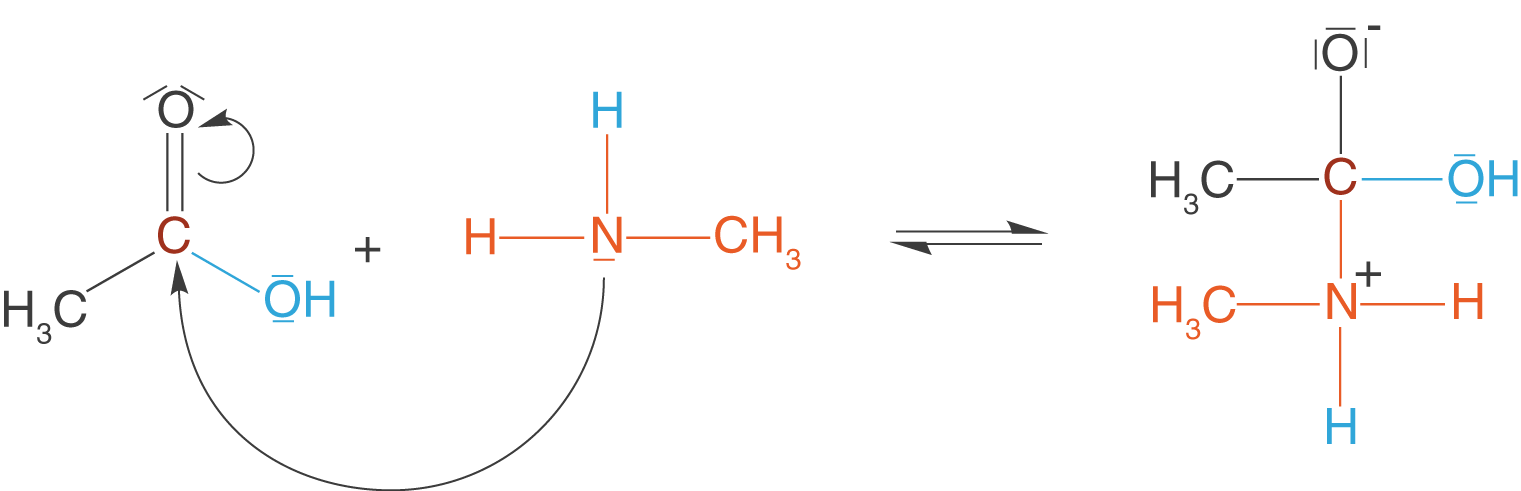
Wir erhalten ein Zwischenprodukt, welches im nächsten Schritt weiter reagieren wird.
(2) Protonenübertragung
Im zweiten Schritt wandert ein Proton des ehemaligen Amins zur Hydroxygruppe der ehemaligen Carbonsäure.
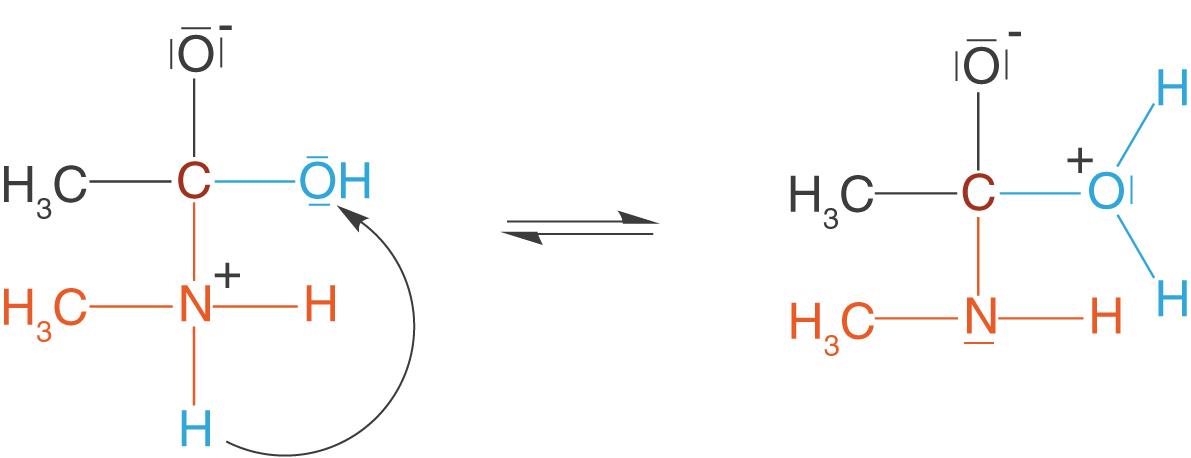
Damit sind wir fast fertig und können bereits erkennen, an welcher Stelle Wasser abgeschieden wird.
(3) Wasserabspaltung
Im letzten Schritt spaltet sich das Wassermolekül ab und das Amid liegt als Produkt vor.
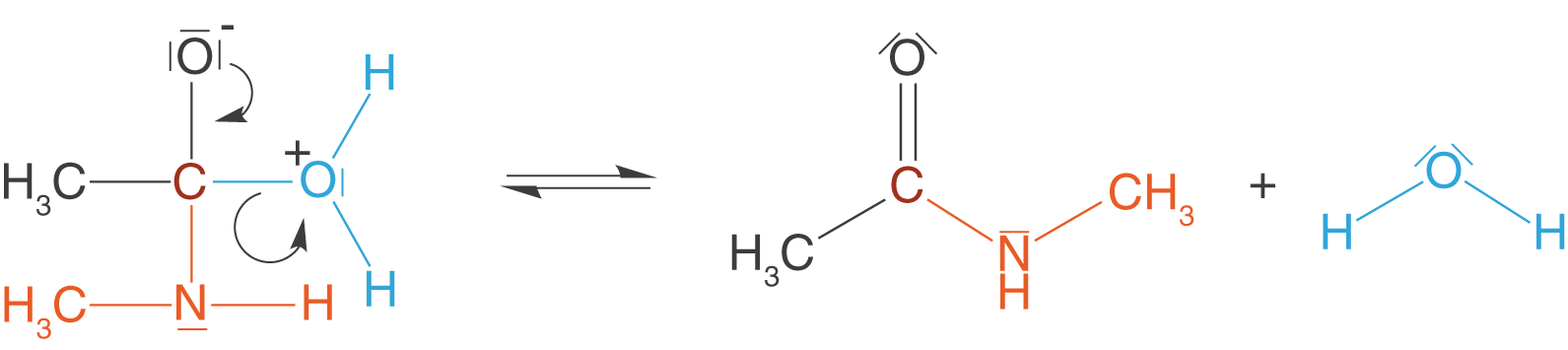
Du kannst hier sehen, dass wiederum Wasser das Spaltprodukt darstellt. Trotzdem ist der Mechanismus im Vergleich zur Veresterung wesentlich übersichtlicher.
Wir wollen nun kurz zusammenfassen, was wir bisher erarbeitet haben und uns dann der Polykondensation zuwenden. Wir haben die Kondensationsreaktion kennen gelernt und das Merkmal des niedermolekularen Spaltprodukts. In diesem Zusammenhang haben wir zwei Reaktionen betrachtet, bei welchen wir im Rahmen der Kondensationsreaktion Esterbindungen und Amidbindungen knüpfen konnten.
- Esterbildung: Veresterung von Carbonsäuren (Carboxygruppe) mit Alkoholen (Hydroxygruppe).
- Amidbildung: Reaktion von Carbonsäuren (Carboxygruppe) mit Aminen (Ammoniakderivat).
Polymersynthese - Polykondensation
Lineare Polymere
Polyester
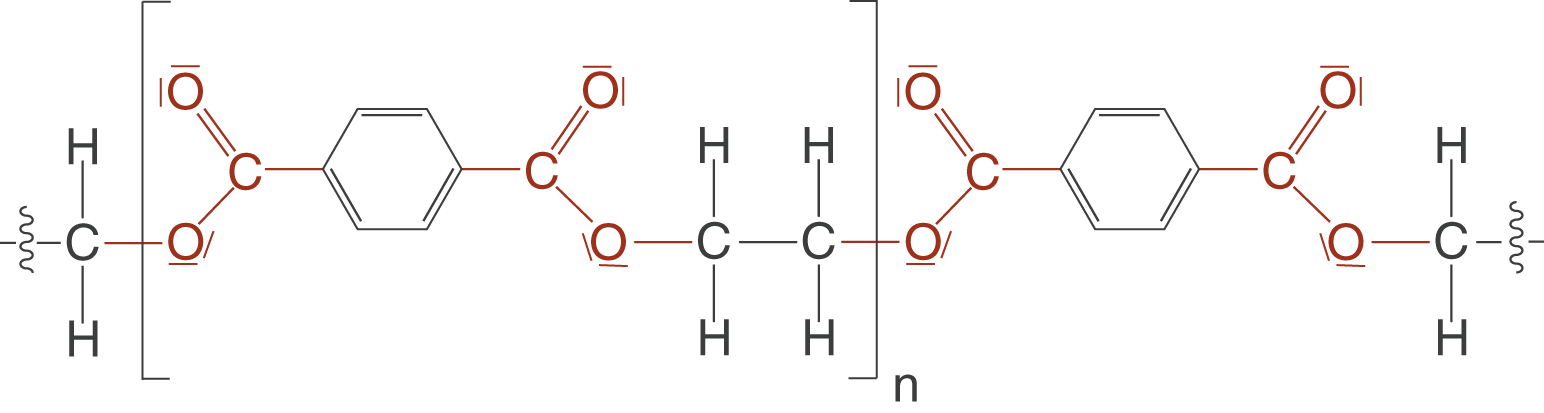
Nun geht es daran, Polymere mithilfe der bis hierhin vorgestellten Konzepte aufzubauen. Dazu beginnen wir damit, passende Monomere zu suchen, die unser Polymer aufbauen werden. Wenn wir eine Polymerkette aufbauen wollen, dann benötigen wir solche Monomere, die sich als Kettenglied eignen. Das bedeutet, dass wir an beiden Enden reaktive Gruppen benötigen, die für eine Kondensationsreaktion in Frage kommen. An dieser Stelle kommen wir jetzt auf den Ester zurück, den du bereits in Abbildung 3 kennen gelernt hast: Polyethylenterephthalat oder kurz PET. Die Monomere siehst du in Abbildung 14.
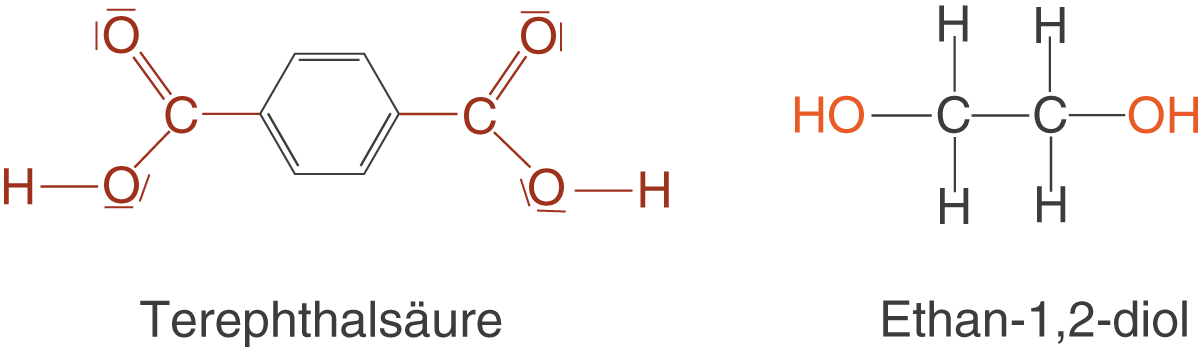
Diese beiden Monomere werden nun in einer säurekatalysierten Kondensationsreaktion über Esterbindungen verbunden. Da beide Monomere jeweils zwei identische funktionelle Gruppen aufweisen, kann eine Kondensationsreaktion an beiden Enden stattfinden und zum Aufbau von Polykondensaten führen.
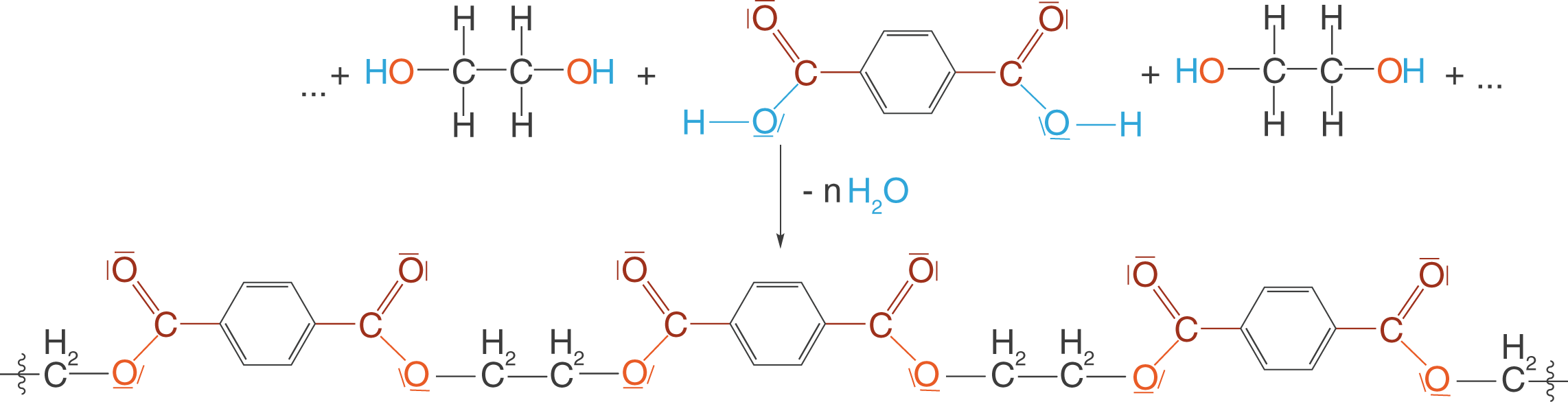
Hier siehst du nun das Polykondensat, welches als PET bekannt ist. Die Bestandteile der Abgangsgruppe, in diesem Fall Wasser, sind blau eingefärbt. Die Carbonylgruppe ist rot und das Sauerstoffatom, dass am Ende Bestandteil der Esterbindung ist, ist orange eingefärbt. Während der Polykondensation werden so viele Moleküle Wasser frei, wie Esterbindungen geknüpft wurden.
Polyamide
Auch im Zusammenhang mit den Polyamiden wollen wir uns die Synthese eines sehr bekannten Polymers anschauen: Nylon. Nylon ist ein kettenförmiges Polymer, welches sich aus den Monomeren 1,6-Diaminohexan und Sebacinsäuredichlorid (Decandisäuredichlorid) zusammensetzt.
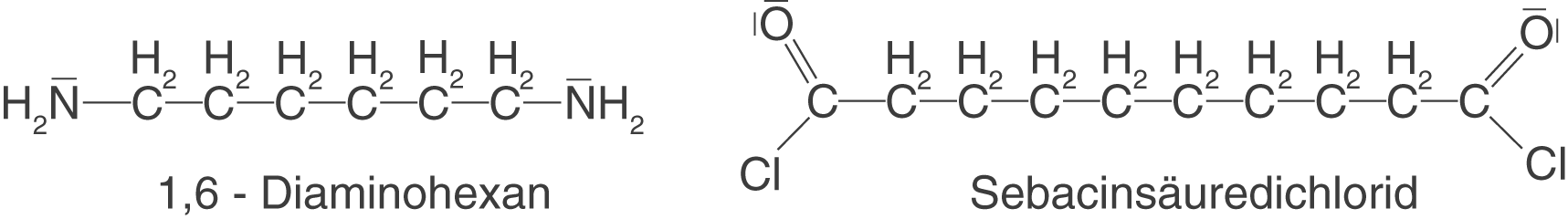
Diese Monomere wollen wir nun in einer Kondensationsreaktion zu einem Polymer verknüpfen. Du kannst hier wieder sehen, dass wir zwei funktionelle Gruppen vorliegen haben, über welche wir das kettenförmige Polymer aufbauen können. Weiterhin werden wir hier einen interessanten Unterschied zu den bisher dargestellten funktionellen Gruppen erkennen können.
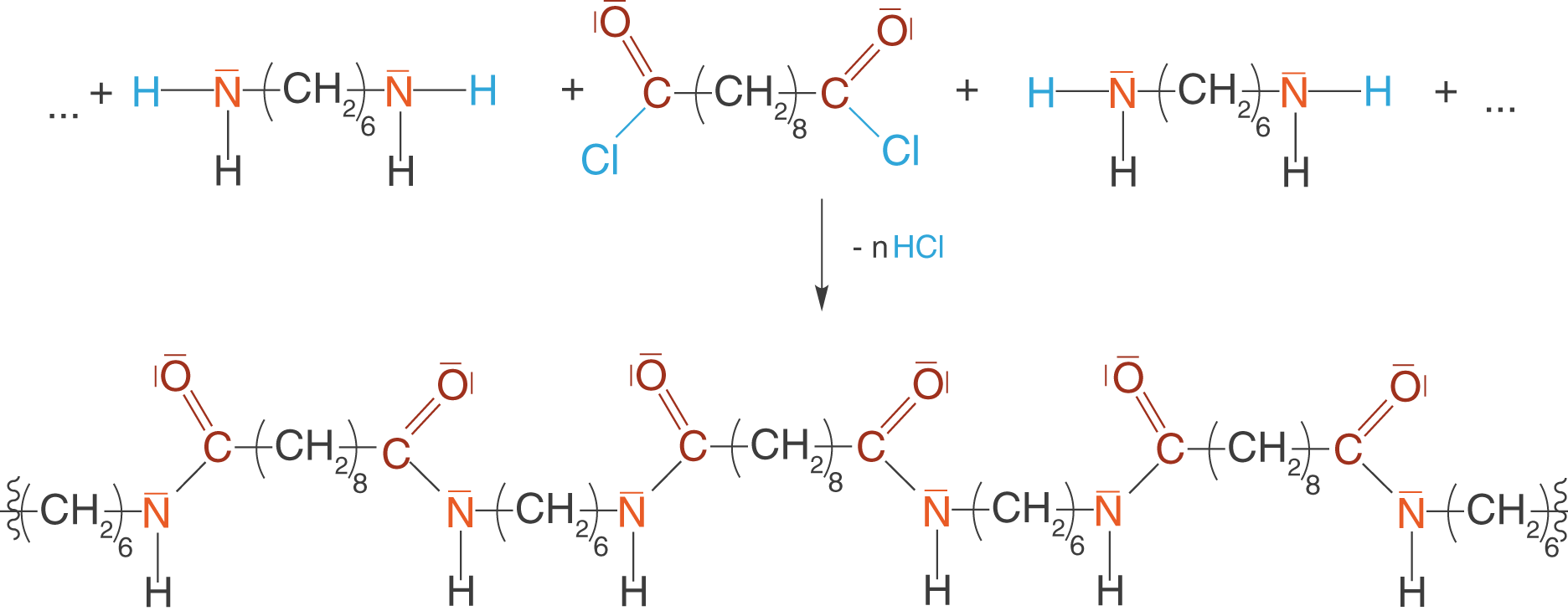
Zunächst zum interessanten Teil: Unser niedermolekulares Spaltprodukt liegt hier nun in Form von Salzsäure () vor. Auch an dieser Stelle sei noch einmal darauf hingewiesen, dass es eben nicht immer Wasser sein muss! Hier reagiert ein Disäurechlorid mit einem Diamin. Die Stickstoffatome des Diamins sind orange eingefärbt. Im Gegensatz zu den Carbonsäuren haben wir hier keine Carboxygruppe vorliegen, sondern eine chlorierte Carbonylgruppe (
). Da das Chloratom an der Abgangsgruppe beteiligt ist, ist es ebenso blau eingefärbt wie das zugehörige Wasserstoffatom des Diamins. Die Carbonylgruppe ist rot hervorgehoben.
Die Amidbindung tritt insbesondere im Zusammenhang mit Proteinen auf. Hier wird sie auch Peptidbindung genannt und stellt die Bindung dar, über welche die Aminosäuren miteinander verknüpft sind.
Vernetzte Polymere
Triole und Triamine
Wir haben uns bisher nur kettenförmige Polymere angeschaut. Nun wollen wir dazu übergehen, auch vernetzte Polymere in unsere Betrachtung mit einzubeziehen. Den einzigen Schritt, den wir hier tun müssen, ist wieder das passende Monomer suchen. Prinzipiell benötigen wir solche, die als „ Kreuzung“ dienen, und solche, die die Maschenränder aufspannen.
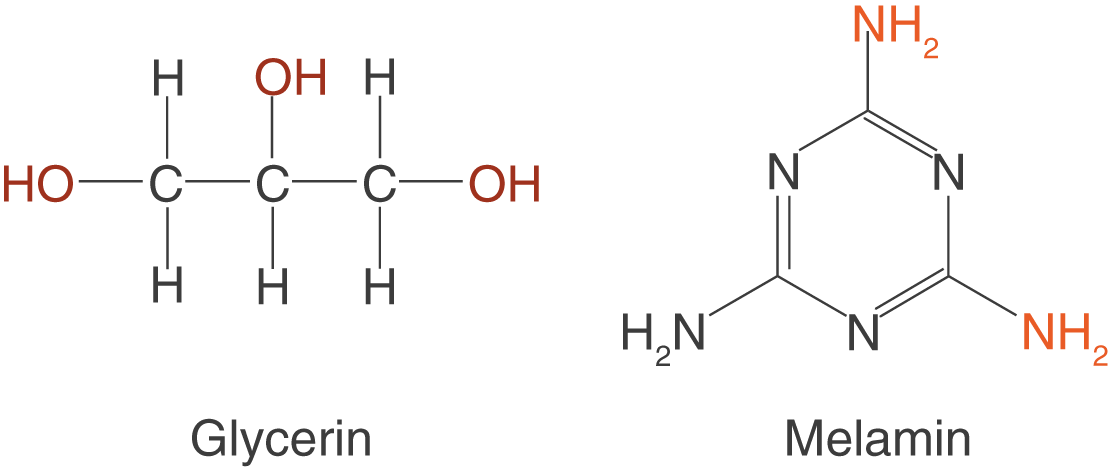
Die in Abbildung 18 dargestellten Monomere können an drei Stellen reagieren und sind somit in der Lage durch Polykondensationsreaktionen mit anderen Monomeren ein Polymernetzwerk aufzubauen.
Polyesterharze
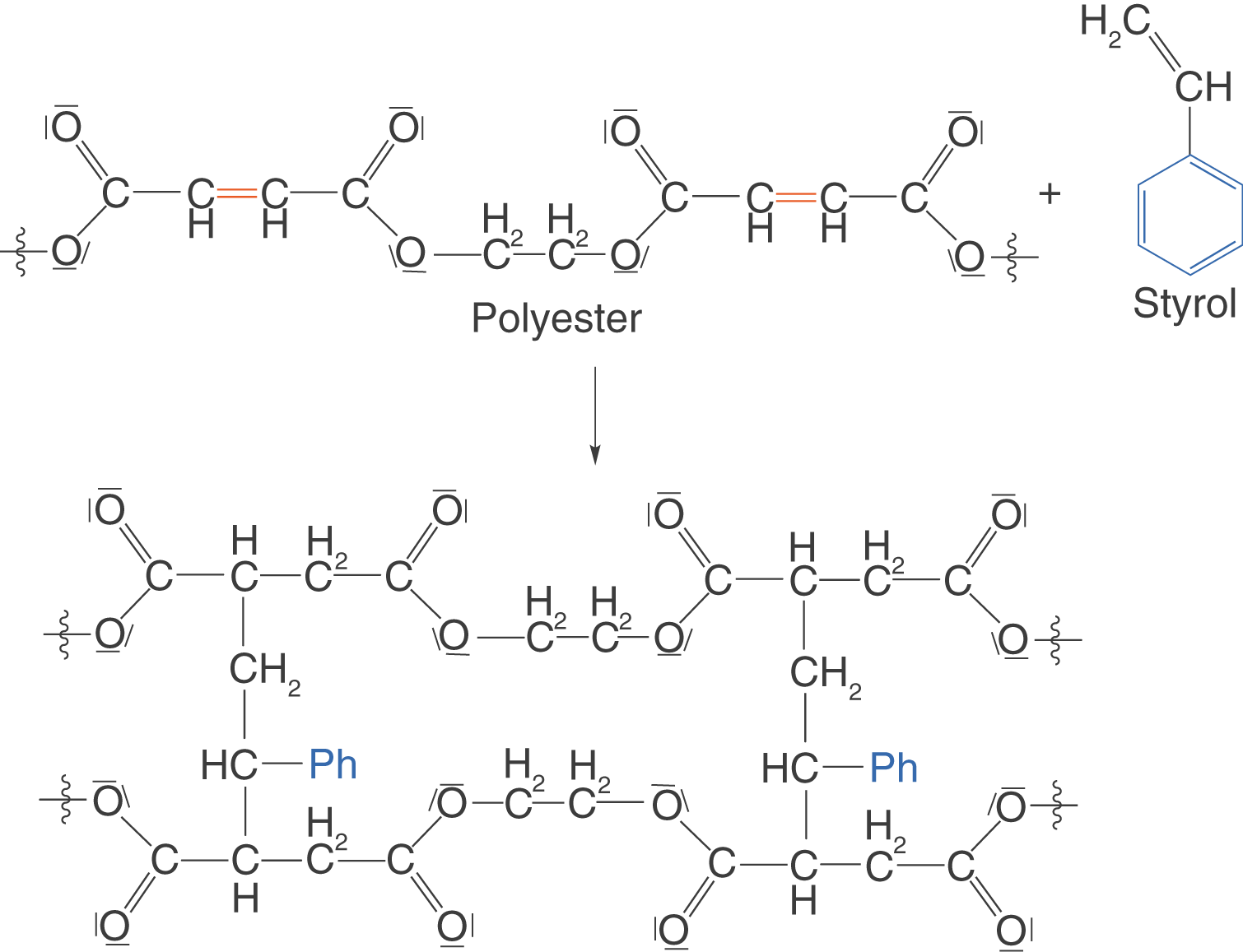
Ein etwas spezielleres Beispiel sind Polyesterharze. Diese bestehen aus Polykondensaten, die Doppelbindungen aufweisen. Diese Doppelbindungen sind anfällig gegenüber Radikalen. In einer radikalischen Polymerisation können somit verschiedene Ketten über die ehemaligen Doppelbindungen radikalisch verknüpft werden (vgl. ChemieLV-Skript Polymersynthese I: Radikalische Polymerisation). Im Falle des Harzes entspricht dies einem Aushärten bei Zugabe eines Radikalstarters. Styrol dient in diesem Fall als Verknüpfung.
Hydrolyse - Spaltung von Polykondensaten
Polykondensate können durch die Reaktion mit Wasser wieder gespalten werden. Dieser Reaktionstyp nennt sich Hydrolyse. Hierbei können sowohl Ester als auch Amide gespalten werden.
Beispiel: Esterhydrolyse
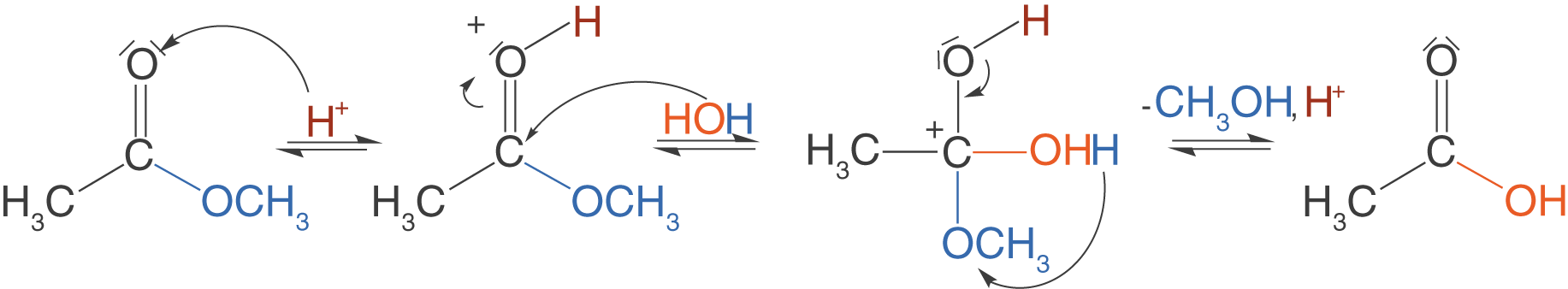
Die Esterhydrolyse ist säurekatalysiert und verläuft in drei Schritten:
- Aktivierung durch Protonierung der Carbonylgruppe.
- Angriff von Wasser an das Kohlenstoffatom der Carbonylgruppe.
- Protonenwanderung und anschließende Abspaltung des Methanols.
Produkte der Polykondensation
Nun zum abschließenden Kapitel dieses Skripts. Nachdem wir die Polykondensate erfolgreich synthetisiert haben, interessiert uns jetzt, welche Eigenschaften sie aufweisen und wo sie Verwendung finden. Wir wollen im Folgenden sowohl die Polyester als auch die Polyamide unter diesen Aspekten betrachten. Zum Schluss lernen wir noch einige andere Polymere kennen, die dir auch bekannt vorkommen können.
Polyester
Polyester sind wohl am bekanntesten in Form von Fasern. Diese finden sich in dutzenden Kleidungsstücken wieder und werden auch als Mikrofasern bezeichnet. Polyester treten dahingehend auch oft in Zusammenhang mit Funktionskleidung auf. Sie bestehen aus langen Ketten, die einen aromatischen Anteil besitzen können und relativ unpolar sind. Ersteres führt zu einer relativ hohen Stabilität des Polymergefüges, wohingegen letzteres dazu führt, dass Polyester eben insbesondere auch in Kleidung Verwendung finden, da sie wasserabweisend sind. Eine andere Verwendung ist PET. Da die wenigsten Leute wissen, was sich hinter dieser Abkürzung verbirgt, wissen auch die wenigstens, dass sich hier ein Polyester versteckt. Wir haben das Molekül des Polyethenterephthalats bereits bei der Polykondensation kennen gelernt, die zur Bildung von Esterbindungen geführt hat. Hierbei handelt es sich um einen Thermoplasten (vgl. ChemieLV-Skript Makromoleküle-Struktur und Eigenschaft), der insbesondere in Form der PET-Flaschen Bekanntheit erlangt hat.


Polyamide
Ein Beispiel für ein Polyamid ist eine sehr bekannte Faser: Nylon. Polyamide sind ebenfalls thermoplastische Kunststoffe und finden sowohl in Form von Fasern als auch in Form nicht-fasriger (kompakter) Kunststoffe ihre Anwendung. Aufgrund langer aliphatischer Kohlenstoffketten fallen die zwischenmolekularen Kräfte deutlich geringer aus als in vergleichbaren Molekülen mit aromatischen Anteilen.

Weitere Polykondensate
An letzter Stelle stehen zwei weitere Polykondensate, die dir vielleicht vom Namen schon einmal untergekommen sind. Dabei handelt es sich um die Gruppen der Silikone und der Polycarbonate.


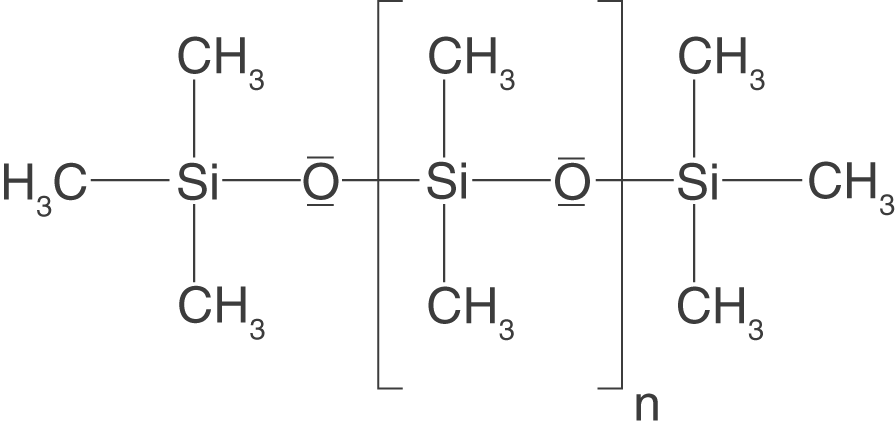
Silikone (Polysiloxane) sind in der Hinsicht besonders, da die die Hauptketten aus Silizium und nicht aus Kohlenstoff aufgebaut sind (vgl. Abb. 24).
https://goo.gl/7zgxYT - CD-Rohling aus Polycarbonat, Luis Fernández García CC-BY-SA 2.1 es