Säuren- und Basenstärke
In diesem Kapitel wollen wir uns mit dem Begriff der Säuren- bzw. Basenstärke beschäftigen. Dazu wollen wir Fragen klären, wie beispielsweise:
- Was ist die Bedeutung des Begriffs Stärke im Kontext zu Säuren und Basen?
- Welche Bedeutung hat der Begriff der Stärke für die Chemie von Säuren und Basen?
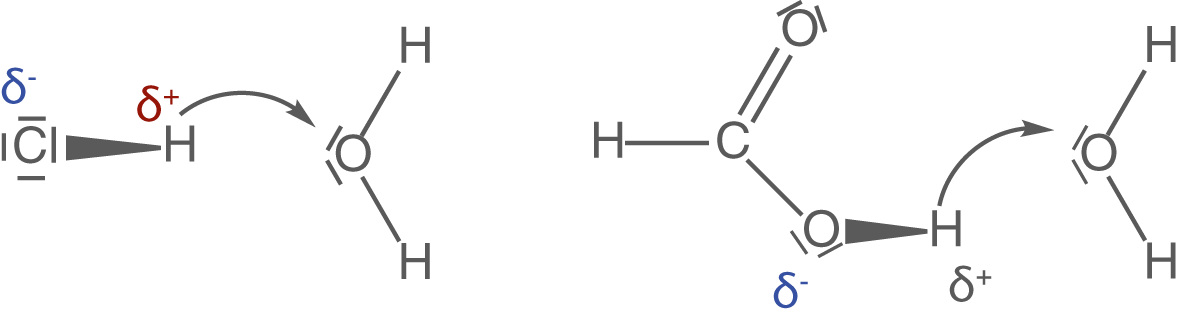
Ein Beispiel zu unterschiedlich starken Säuren liefern die folgenden Protonenübertragungsreaktionen:
Links siehst du Salzsäure, eine sehr starke und aggressive Säure, welche in wässriger Lösung nahezu komplett dissoziiert. Rechts siehst du die weitaus schwächere organische Ameisensäure oder auch Methansäure, welche ihr Proton weitaus weniger leicht abgibt.
Es gilt nun dieses Bestreben ein Proton abzugeben irgendwie zu quantifizieren, um somit Aussagen über die Stärke der Säure treffen zu können. Wichtig ist an dieser Stelle, dass dieses Konzept im Allgemeinen auch auf funktionelle Gruppen oder ganze Moleküle angewendet werden kann, welche ein oder mehrere Protonen abgeben können. Es geht also nicht nur um Säuren, wie du sie aus dem Unterricht kennst.
Wir werden an dieser Stelle zunächst wieder die Säuren behandeln, da die Basenstärken im Anschluss ganz analog abgehandelt werden können.
Die Säurenkonstante KS und die Basenkonstanten KB
Die Reaktionen von Säuren und Basen sind Gleichgewichtsreaktionen. Das bedeutet, dass wir das Massenwirkungsgesetz zu Rate ziehen können.
Wir betrachten dazu die folgende Säure-Base-Reaktion einer Säure HAc mit Wasser, wobei letzteres hier als Base fungiert:
Für diese Reaktion können wir das Massenwirkungsgesetz formulieren:
Bereits bei der Autoprotolyse des Wassers hatten wir so ein ähnliches MWG, in welchem die Konzentration des Wassers im Nenner vorkam. Wir hatten dort gesagt, dass sich diese Konzentration kaum ändert, da nur ein sehr geringer Anteil an Wasser wirklich protoniert wird. Diese Vereinfachung können wir an dieser Stelle auch wieder verwenden und die Konzentration des Wassers in die Gleichgewichtskonstante ziehen:
Dem Produkt der Gleichgewichtskonstanten und der Wasserkonzentration geben wir eine neue Bezeichnung: die Säurekonstante
Ganz analog dazu können wir auch einen -Wert definieren, welcher als Basenkonstante bezeichnet wird. Dazu betrachten wir folgendes Gleichgewicht mit der Base B und Wasser, welches jetzt die Rolle der Säure einnimmt.
Beim Massenwirkungsgesetz können wir die Wasserkonzentration wieder in die Gleichgewichtskonstante ziehen:
Wir erhalten die Basenkonstante .
Mithilfe dieser beiden speziellen Gleichgewichtskonstanten können wir nun bereits Aussagen über die Stärken von Säuren und Basen treffen:
- Säuren: je stärker eine Säure ist, desto größer ist die Säurekonstante; für sehr starke Säuren gilt
- Basen: je stärker eine Base ist, desto größer ist die Basenkonstante; für sehr starke Basen gilt
Ganz analog ist auch die Basenstärke zu erklären: je mehr Hydroxid-Ionen in der Lösung vorkommen, desto weiter liegt das Gleichgewicht auf der Produktseite der betreffenden Gleichgewichtsreaktion.
pKS- und pKB-Werte
Sehr oft wird statt der Säure- bzw. Basenkonstante der negative dekadische Logarithmus dieser Größen angegeben. Im Falle von Säuren wird in diesem Fall der -Wert verwendet und im Falle von Basen der
-Wert.
Formal müssen wir wieder darauf achten, dass im Argument des Logarithmus (in der Klammer) keine Einheit steht, da wir aus Einheiten keinen Logarithmus ziehen können.
Bevor wir den -Wert definieren schauen wir uns in zwei Beispielen an, worin der Unterschied zur eben eingeführten Säurekonstanten besteht:
Beispiel A
Beispielhaft wollen wir hier annehmen, dass . Nun berechnen wir den
-Wert.
Beispiel B
Beispielhaft wollen wir hier annehmen, dass . Nun berechnen wir den
-Wert.
Je stärker die Säure, desto größer die Säurekonstante
Durch Umformen der Gleichungen kannst du bei gegebenem -Wert bzw.
-Wert natürlich auch die zugehörige Säure- bzw. Basekonstante berechnen.
Zum Abschluss wollen wir uns nun noch den Zusammenhang zwischen - und
-Wert anschauen. Dafür nehmen wir die äure- und Basenkonstante zur Hilfe:
Durch Kürzen von und
erhalten wir die Gleichung, die wir bereits als das Ionenprodukt des Wassers kennen:
Nun wenden wir den negativen dekadischen Logarithmus auf diese Gleichung an:
Denke daran, dass sowohl der
Jede Säure hat demnach ihren zugehörigen -Wert und die korrespondierende Base ihren
-Wert. Weiterhin wird hieran auch deutlich, dass sehr starke Säuren sehr schwache korrespondierende Basen haben und umgekehrt. Dies folgt daraus, dass diese beiden Werte in der Summe 14 ergeben müssen.