Standardwasserstoffelektrode
Galvanische Elemente und die elektrochemische Spannungsreihe
In diesem Skript beschäftigen wir uns mit der Standardwasserstoffelektrode und der Messung und Bestimmung von Standardpotentialen. Bevor wir diese ausführlich betrachten, wiederholen wir kurz das Konzept des Galvanischen Elements. Dieses stellt nämlich die experimentelle Grundlage dar, mithilfe derer wir die unbekannten Standardpotentiale gegen die Standardwasserstoffelektrode bestimmen werden. Zusätzlich werfen wir in diesem Zusammenhang noch einen Blick auf die elektrochemische Spannungsreihe und das Problem des Referenzpotentials für Redoxpotentiale, also quasi den „Nullpunkt“ der elektrochemischen Spannungsreihe (vgl. Skript Das Standardpotential und die elektrochemische Spannungsreihe).
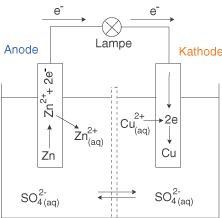
(A) Galvanische ElementeEin Galvanisches Element ist eine Vorrichtung, die die spontane Umwandlung von chemischer in elektrische Energie erlaubt. Es besteht aus zwei Halbzellen, welche im Normalfall (Konzentrationselemente lassen wir außen vor) jeweils unterschiedliche Redox-Paare enthalten. Dabei liegt die reduzierte Form des Redox-Paares in Form der Elektrode und die oxidierte Form in Form von Kationen in einer wässrigen Lösung vor. Eines der bekanntesten Galvanischen Elemente ist das Daniell-Element, welches wir im Folgenden betrachten:
Die Halbzellen des Daniell-Elements werden durch folgende Redox-Paare gebildet: und
. Kupfer besitzt in diesem Fall das höhere Standardpotential (
), ist also das edlere Metall und wird aus diesem Grund an der Kathode reduziert. Zink ist das unedlere Metall (
), wird an der Anode oxidiert und stellt somit die Elektronen für die Reduktion von Kupfer bereit. Die Redox-Reaktion lautet dann:
Diese Reaktion kann jedoch erst dann ablaufen, wenn die Elektronen von der Anode zur Kathode fließen können. Ist dieser Fluss nicht gewährleistet, z.B. wenn die Verbindung zwischen Anode und Kathode gekappt wird, dann baut sich aufgrund der unterschiedlichen Lösungstension von Kupfer und Zink eine Spannung zwischen diesen beiden Elementen auf. Unter Lösungstension verstehen wir das Bestreben von Metallen, in wässrigen Lösungen Kationen auszubilden. Je größer die Lösungstension, also je stärker dieses Bestreben, desto mehr Kationen werden von dem Metall in Lösung abgegeben, bis sich ein chemisches Gleichgewicht zwischen Metalloberfläche und Lösung eingestellt hat. Hier kommt es auf sehr kleinen Raum effektiv zu einer Ladungstrennung, welche eine charakteristische Potentialdifferenz bzw. Spannung für das jeweilige Redox-Paar nach sich zieht (vgl. Skript Galvanische Elemente).
(B) Elektrochemischen Spannungsreihe
Mit dem letzten Satz des vorherigen Abschnitts gehen wir zur elektrochemischen Spannungsreihe über. Diese stellt eine Anordnung von Redox-Paaren auf der Basis ihrer unterschiedlichen Standardpotentiale dar. Um jedoch eine solche Gliederung durchführen zu können, ist es nötig, einen Nullpunkt im Bezug auf die Standardpotentiale zu wählen. Hier kommt erstmalig die Standardwasserstoffelektrode ins Spiel. Es wurde sich darauf geeinigt, dass das Standardpotential des Redox-Paares die Aufgabe des Nullpunkts übernehmen soll.
Diese Defintion ist rein willkürlich gewählt und entspricht somit einer Konvention, auf die sich international geeinigt wurde. Bevor wir uns nun der Standardwasserstoffelektrode zuwenden, wollen wir die wichtigsten, gerade dargestellten Aspekte kurz zusammenfassen:
- Die charakteristische Lösungstension von Metallen führt durch Kationenbildung in wässriger Lösung zu einer kleinräumigen Ladungstrennung, was je nach Redox-Paar zu einer anderen Potentialdifferenz führt. Diese ist demnach ebenfalls für jedes Redox-Paar charakteristisch.
- Die Standardpotentiale der elektrochemischen Spannungsreihe werden im Bezug auf das Redox-Paar
gegliedert, wobei dieses als Nullpunkt definiert wurde.
Wir gehen nun dazu über die Standardwasserstoffzelle als spezielle Halbzelle eines Galvanischen Elements zu besprechen. Wenn wir diese mit einer anderen Halbzelle kombinieren, wobei letztere ein Redox-Paar mit unbekanntem Standardpotential enthält, werden wir dieses unbekannte Standardpotential in Form der Potentialdifferenz zwischen den beiden Halbzellen messen kouml;nnen. Führen wir diese Prozedur mit so vielen Redox-Paaren durch, wie uns bekannt sind, dann erhalten wir am Ende die elektrochemische Spannungsreihe.
Die Standardwasserstoffelektrode
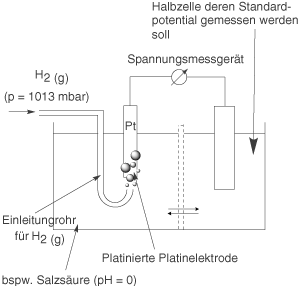
Die Standardwasserstoffelektrode erlaubt die experimentelle Bestimmung von Standardpotentialen von Redox-Paaren. Dazu betrachten wir zunächst den Aufbau dieser speziellen Halbzelle.
Links siehst du die Standardwasserstoffelektrode und rechts die Halbzelle, deren Redoxpotential bestimmt werden soll. Dieses Experiment wird bei Standardbedingungen durchgeführt:
Da wir hier gasförmigen Wasserstoff betrachten, müssen wir uns auch für den Druck interessieren, da die Spannung bei Gasen auch in Abhängigkeit zum Druck steht. Wir verwenden hier eine Platinelektrode, die mit dem Adjektiv platiniert beschrieben wird. Dabei handelt es sich um eine spezielle Elektrode, deren Oberfläche zusätzlich mit Platin strukturiert wurde. Damit wird die effektvie Oberfläche der Elektrode um ein Vielfaches erhöht und somit auch die Reaktivität. Weiterhin ist Platin ein Material, welches als inert bezeichnet werden kann, das bedeutet, dass es chemisch unreaktiv ist. Den gasförmigen Wasserstoff leiten wir direkt an dieser platinierten Platinelektrode in eine saure Lösung mit pH = 0 ein. Dies entspricht nach der Definition des pH-Wert genau einer Lösung mit einer Konzentration von
. An der Platinelektrode läuft folgende Reaktion ab:
Hier wird elementarer Wasserstoff () formal zu zwei Protonen (
) oxidiert. In wässriger Lösung gibt es jedoch keine freien Protonen, sondern nur Oxonium-Ionen (
).
Anmerkung: Es kann sein, dass du in diversen Büchern solche Reaktionsgleichungen in der Form findest, dass nur angegeben sind. Dies ist eine Vereinfachung, die so nicht der Realität entspricht. In der Schule solltest du dich daran halten, in jedem Fall Oxonium-Ionen in der Reaktionsgleichung aufzuführen!
Das Standardpotential dieser Reaktion setzen wir nun nach einer internationalen Konvention gleich null.
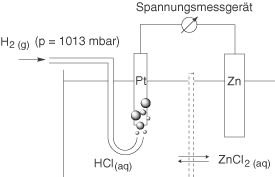
Nun schalten wir eine andere Halbzelle mit der Standardwasserstoffelektrode zusammen. Als Beispiel können wir hier das Redox-Paar verwenden:
An der Zink-Elektrode, hier in der rechten Halbzelle, wird sich aufgrund der Lösungstension von Zink eine Potentialdifferenz aufbauen. Diese charakteristische Potentialdifferenz können wir nun mithilfe eines Spannungsmessgeräts (Voltmeter) gegen die Standardwasserstoffelektrode messen. Da letztere laut Definition gleich null ist, erhalten wir so die charakteristische Potentialdifferenz an der Zinkelektrode. Diese entspricht dem Standardpotential des Redoxpaares . Was wir also eigentlich messen, ist die Differenz zweier Potentialdifferenzen! Wenn wir nur eine Elektrode betrachten, dann erhalten wir hier eine Potentialdifferenz auf Grundlage der Lösungstension. Diese zieht eine kleinräumige Ladungstrennung nach sich, was eben diese Potentialdifferenz zur Folge hat. Das kannst du daran erkennen, dass auch die Standardpotentiale die Einheit einer Potentialdifferenz aufweisen. Wenn wir nun zwei Halbzellen kombinieren, dann betrachten wir zwei Elektroden, an welchen aufgrund der vorher genannten Prozesse jeweils eine charakteristische Potentialdifferenz auftritt, die wir gegeneinander messen.
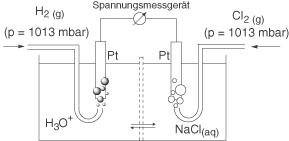
Nicht-metallische Redox-Paare
Ist ein Redox-Paar nicht metallisch, dann kann es sein, dass die reduzierte Form beispielsweise in Form eines Gases vorliegt. Beispielhaft wollen wir hier Chlor und Chlorid betrachten: . Die Messung des Standardpotentials dieses Redox-Paares erfolgt mit Hilfe einer Platinelektrode, welche mit dem entsprechenden Gas umspült wird: In diesem Fall Chlorgas. Ein solcher experimenteller Aufbau könnte so aussehen: