B2 Widerstandsfähigkeit gegen HI-Viren
Hinweis: In der Prüfung musst du von den Aufgabenblöcken A, B und C jeweils einen der beiden Vorschlägen 1 oder 2 bearbeiten.
Es gilt als gesichert, dass bereits Anfang des 20. Jahrhunderts ein Urtyp des HI-Virus (Human immunodeficiency virus) von Affen auf Menschen übertragen wurde. In Deutschland waren im Jahre 2023 ca. 96.700 Menschen mit dem HI-Virus infiziert. Bei 96 % dieser Menschen kann das HI-Virus aufgrund einer rechtzeitig begonnen HIV-Therapie im Blut nicht mehr nachgewiesen werden.
Eine Infektion mit dem Virus zieht eine schleichend zunehmende Schwächung des Immunsystems nach sich und führt in der Folge meist zu AIDS (acquired immunodeficiency syndrome), welches durch eine Kombination von Symptomen gekennzeichnet ist. Unbehandelt führt eine Infektion mit dem HI-Virus innerhalb einiger Jahre zum Tod.
Das HI-Virus ist ein Retrovirus, d. h. die Erbsubstanz liegt in Form von RNA vor. Vergleiche DNA und RNA bezüglich ihres Aufbaus unter Mitverwendung beschrifteter Skizzen.
Für die Herstellung von Medikamenten gegen das HI-Virus werden unter anderem gentechnische Methoden verwendet. Hierzu werden Bakterien eingesetzt, die mittels gentechnisch modifizierter Plasmide bestimmte Wirkstoffe produzieren können. Zusätzlich besitzen diese modifizierten Plasmide Gene, deren Produkte zur Synthese von Fluoreszenzfarbstoffen nötig sind (Abb. 1).

In einem Versuch soll ein bestimmter proteinbasierter Wirkstoff durch Bakterien hergestellt werden. Abbildung 2 zeigt das Ergebnis nach Vermehrung der gentechnisch behandelten Bakterien auf einem Nährmedium unter optimalen Bedingungen.
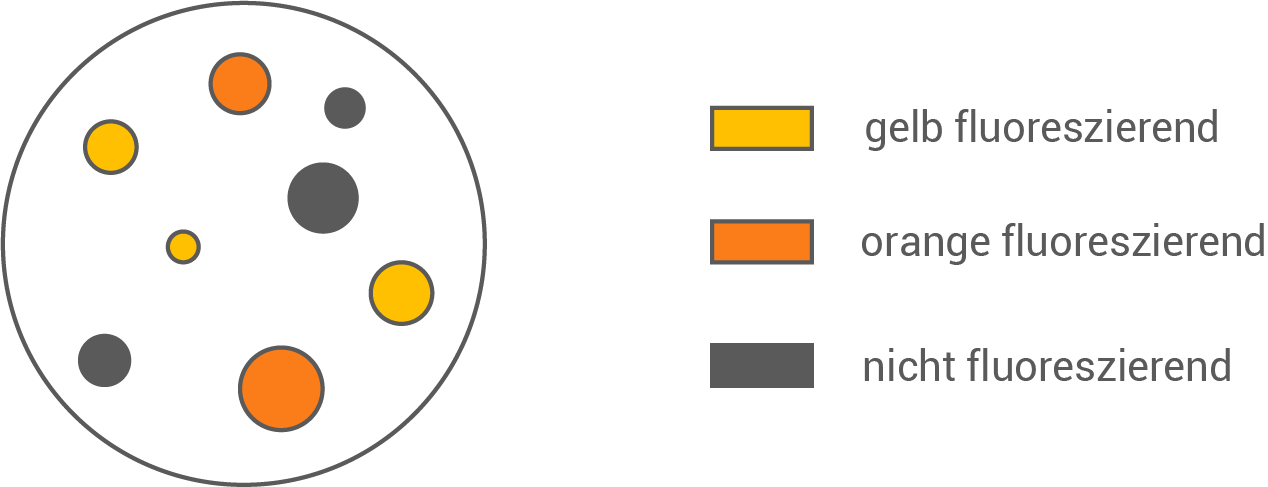
Erkläre anhand der Abbildungen 1 und 2, bei welchen der dargestellten Bakterienkolonien die Aufnahme des modifizierten Plasmids jeweils erfolgreich bzw. nicht erfolgreich war.
Um in eine menschliche Zelle gelangen zu können, bindet das HI-Virus, wie zahlreiche andere Viren, an den Rezeptor CCR5 in der Membran einer potenziellen Wirtszelle. Nach dem Eindringen in die Wirtszelle erfolgt die Vermehrung der Virusbestandteile. Bei der anschließenden Freisetzung zahlreicher neuer Viren wird die Wirtszelle zerstört.
Forschende fanden menschliche Zellen, die gegen eine HIV-Infektion mit einer bestimmten Virusvariante vollständig resistent sind. Weitere Untersuchungen zeigten, dass diese Resistenz auf einer Mutation des Rezeptorgens CCR5 auf Chromosom 3 beruht. Homozygoten Trägern dieser Mutation fehlen die CCR5-Rezeptoren in der Membran der Zellen.
Bei einer genetischen Untersuchung soll ermittelt werden, ob eine Person gegen das HI-Virus aufgrund einer Mutation im CCR5-Gen resistent ist. Hierzu werden Gensequenzen bestimmt und verglichen.
A: Ausschnitt aus dem nicht-codogenen Strang des CCR5-Gens5‘ TTT CCA TAC AGT CAG TAT 3‘ B: Ausschnitt aus dem nicht-codogenen Strang des CCR5-Gens mit Mutationen
5‘ TTT CCA TAC AGC CAG TAC 3‘
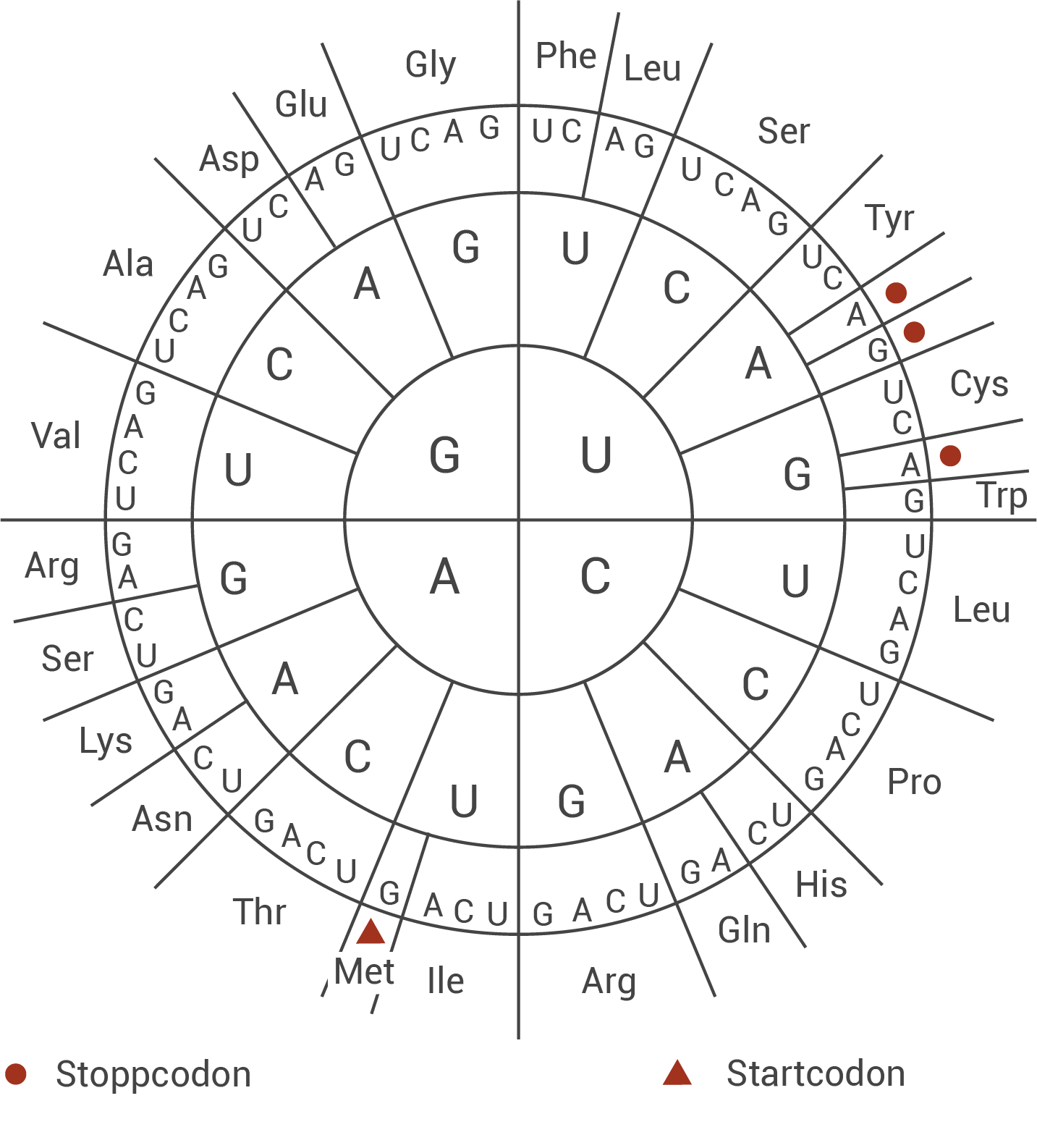
Leite mit Hilfe der Code-Sonne (Abb. 3) ab, ob der Ausschnitt aus dem nichtcodogenen Strang des CCR5-Gens mit Mutationen Ursache für eine Resistenz gegenüber dem HI-Virus sein kann, und benenne jeweils den vorliegenden Mutationstyp.
Der Vergleich einer Testgruppe von heterozygoten Trägern der HIV-Resistenzmutation [he] mit einer Vergleichsgruppe homozygoter Träger des nichtmutierten Gens [ho] lieferte folgende Daten:
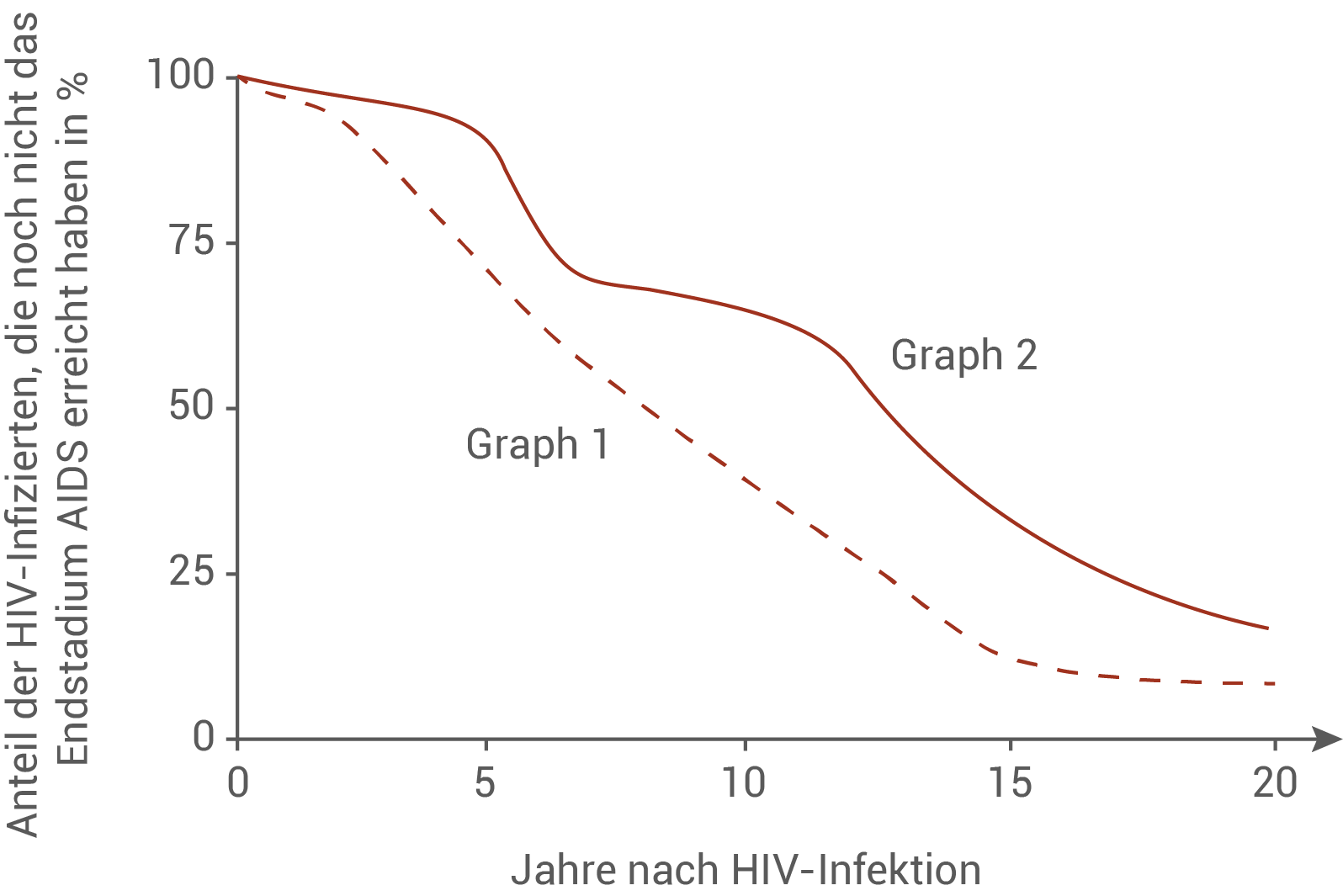
Ordne die beiden Graphen in Abbildung 4 den Testgruppen [he] und [ho] begründet zu.
Ein Mann ist vollständig resistent gegenüber einer HIV-Infektion aufgrund der Mutation des CCR5-Rezeptorgens. Seine Partnerin ist homozygote Trägerin des nichtmutierten CCR5-Rezeptorgens.
Erläutere, mit welcher Wahrscheinlichkeit Kinder dieses Paares gegen das HI-Virus vollständig resistent sind und inwiefern das Geschlecht des resistenten Partners eine Rolle spielt.
Aus historischen Quellen weiß man, dass in Europa zwischen 1347 und 1670 regelmäßig wiederkehrende Seuchen mit starken inneren Blutungen auftraten. Im Norden Europas waren diese sogar bis zum Beginn des 19. Jahrhunderts verbreitet. Heute weiß man, dass diese u. a. von Viren verursacht wurden. In Abbildung 5 ist die geographische Verbreitung der Resistenzmutation des CCR5-Rezeptorgens dargestellt:

Erkläre mithilfe der synthetischen Evolutionstheorie die geographische Verbreitung der Resistenzmutation des CCR5-Rezeptorgens.
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Vergleich von DNA und RNA

In der Abbildung wird der strukturelle Unterschied zwischen RNA und DNA veranschaulicht. Beide Nukleinsäuren bestehen aus einer Helix aus Zucker-Phosphat-Einheiten und enthalten stickstoffhaltige Basen. Die RNA liegt dabei in der Regel einsträngig vor, während die DNA doppelsträngig aufgebaut ist. Bei der DNA werden die beiden Einzelstränge durch Basenpaare zusammengehalten, die über Wasserstoffbrückenbindungen miteinander verknüpft sind, wodurch die typische Doppelhelixstruktur entsteht.
Ein weiterer Unterschied wird anhand der enthaltenen Basen dargestellt. Beide Moleküle besitzen Adenin, Guanin und Cytosin, jedoch unterscheidet sich die vierte Base: In der RNA ist Uracil enthalten, während in der DNA Thymin an die Stelle von Uracil tritt. Dadurch unterscheiden sich sowohl die Basenpaarung als auch die biochemischen Eigenschaften der Moleküle. Die DNA bildet stabile Basenpaare zwischen Adenin und Thymin sowie Cytosin und Guanin, während in der RNA Adenin mit Uracil paart, sodass andere Faltungsformen möglich werden.
Entsprechend der unterschiedlichen Namensgebung ist auch der Zuckeranteil der Nukleotide jeweils unterschiedlich: In der RNA ist Ribose enthalten, während die DNA Desoxyribose besitzt.
Zusammenfassend tragen beide Moleküle genetische Information in Form von Polynukleotiden, unterscheiden sich jedoch deutlich in Aufbau und Stabilität.
Selektion transgener Bakterienkolonien
Um ein Fremdgen, in diesem Fall ein Gen für einen proteinbasierter Wirkstoff, in Bakterien über ein Plasmid einzubringen, muss das Gen zunächst mit einem Restriktionsenzym verdaut werden. Dieser Prozess erzeugt Überhänge an den Enden des Fremdgens, die sogenannten sticky ends. Das Plasmid wird mit dem gleichen Restriktionsenzym geschnitten, sodass es an einer Stelle offen ist, und ebenfalls Überhänge enthält. Diese sind komplementär zu den Überhängen des Fremdgens. Plasmid und Fremdgen werden zusammengebracht, und durch den Prozess der Ligation wird das Fremdgen in das Plasmid integriert. Das Plasmid mit Fremdgen wird anschließend in Bakterienzellen eingeschleust (Transformation).
Die Gene für die Synthese der Fluoreszenzfarbstoffe dienen hierbei als sogenannte Reportergene. Wird das Fremdgen erfolgreich eingebaut, so muss wie in Abbildung 1 dargestellt eine Restriktion innerhalb des Gens für den roten Farbstoff geschehen. Wird dieses Plasmid mit Fremdgen nun erfolgreich in ein Bakterium eingeschleust, so fluoresziert dieses gelb; das Gen für den gelben Farbstoff liegt nämlich außerhalb der Schnittstelle für Restriktionsenzyme und kann nach Einbau problemlos exprimiert werden. Somit sind die gelb fluoreszierenden Kolonien diejenigen, die das Plasmit mit Fremdgen erfolgreich aufgenommen haben und nun den Wirkstoff erfolgreich synthetisieren.
Die Bakterienkolonien die orange fluoreszieren weisen auf eine Exprimierung beider Farbstoffgene hin, was bedeutet, dass bei diesen Bakterien zwar das Plasmid erfolgreich eingeschleust wurde, das Plasmid selbst jedoch nicht das gewünschte Fremdgen trägt. Hier hat entweder die Restriktion nicht geklappt oder das Plasmid ist nach der Restriktion wieder mit sich selbst ligiert.
Zuletzt ist bei den Kolonien ohne jegliche Fluoreszenz festzustellen, dass das Einschleusen des Plasmids hier gänzlich erfolglos war.
CCR5-Gen mit und ohne Mutation
Ohne Mutation lautet die exprimierte Aminosäuresequenz des gezeigten Ausschnitts: Phe–Pro–Tyr–Ser–Gln–Tyr.
Mit Mutation lautet der Ausschnitt: Phe–Pro–Tyr–Ser–Gln–Tyr; genau wie beim unmutierten Gen.
Es handelt sich also um eine stille Mutation, wobei die zwei erkennbaren Punktmutationen der mutierten Sequenz mit ihrem unterschiedlichen Basentriplett weiterhin zur gleichen Aminosäure führt. Die gezeigte Mutation kann somit nicht Ursache für eine Resistenz gegenüber dem HI-Virus sein.
Zuordnung der Graphen
Graph 2 ist der heterozygoten Testgruppe [he] zuzuordnen, Graph 1 der homozygoten Vergleichsgruppe [ho].
Graph 2 verläuft über den gesamten Zeitraum deutlich höher als Graph 1. Das bedeutet, dass auch nach vielen Jahren ein größerer Anteil der HIV-Infizierten noch nicht das Endstadium AIDS erreicht hat. Bei den heterozygoten Trägern liegt auf einem Chromosom das mutierte CCR5-Gen vor, sodass insgesamt weniger funktionsfähige CCR5-Rezeptoren in die Zellmembran eingebaut werden. Das HI-Virus kann dadurch schlechter in die Zellen eindringen, die Virusvermehrung verläuft langsamer und der Übergang in das AIDS-Endstadium wird deutlich hinausgezögert.
Graph 1 mit dem stärkeren Abfall beschreibt dagegen die homozygoten Träger des nicht mutierten Gens [ho]. Diese Personen besitzen ausschließlich normale CCR5-Rezeptoren, sodass das Virus Zellen sehr effizient infizieren kann. Die Viruslast steigt schneller an, das Immunsystem wird früher stark geschädigt und der Anteil der Infizierten, die noch nicht das Endstadium erreicht haben, nimmt deutlich schneller ab.
Immunität der Kinder des Paares
Die Mutation des CCR5-Rezeptorgens, die zu einer vollständigen Resistenz gegenüber bestimmten HIV-Varianten führt, liegt auf einem Autosom (Chromosom 3) und nicht auf einem Geschlechtschromosom. Der Mann ist vollständig resistent, er ist also homozygot für die mutierte CCR5-Variante (mut/mut). Seine Partnerin ist homozygot für das nicht mutierte Gen (wt/wt). Bei der Bildung der Keimzellen gibt der Mann ausschließlich mutierte Allele weiter, die Frau ausschließlich nicht mutierte. Alle Kinder dieses Paares erhalten daher je ein mutiertes und ein nicht mutiertes Allel und sind damit durchweg heterozygot (wt/mut). Heterozygote Träger zeigen zwar einen verlangsamten Krankheitsverlauf, sind aber nicht vollständig resistent, sodass die Wahrscheinlichkeit für vollständig resistente Kinder in diesem Fall 0 Prozent beträgt. Da das CCR5-Gen autosomal vererbt wird, spielt es keine Rolle, ob der resistente Elternteil der Vater oder die Mutter ist; wäre die Mutter homozygot mutiert und der Vater homozygot nicht mutiert, ergäbe sich das gleiche Ergebnis.
Geographische Verbreitung der Resistenzmutation des CCR5-Rezeptorgens
Die Karte zeigt, dass die Mutation des CCR5-Rezeptorgens vor allem in Nord- und Mitteleuropa eine deutlich höhere Allelfrequenz besitzt als in Südeuropa, Westasien oder Nordafrika. Um diese geographische Verteilung zu erklären, kann die synthetische Evolutionstheorie herangezogen werden, die Veränderungen von Allelhäufigkeiten durch Selektion, Mutation, Migration, Rekombination und Gendrift beschreibt.
Historische Quellen belegen, dass in Europa zwischen dem 14. und dem 17. Jahrhundert schwere, wiederkehrende Seuchen auftraten, die mit hoher Sterblichkeit einhergingen und zum Teil von Krankheitserregern verursacht wurden, die den CCR5-Rezeptor zum Eindringen in Wirtszellen nutzten. In Regionen, in denen solche Epidemien über viele Generationen hinweg häufig vorkamen, insbesondere im Norden Europas, hatten Menschen mit der mutierten CCR5-Variante einen deutlichen Überlebensvorteil. Da der veränderte Rezeptor dem Krankheitserreger den Eintritt in die Zellen erschwert, überlebten Personen mit dieser Mutation häufiger und konnten mehr Nachkommen zeugen. Auf diese Weise stieg die Allelfrequenz des mutierten Gens über viele Generationen hinweg stark an.
In Regionen mit weniger intensiven oder seltener auftretenden Epidemien war dieser Selektionsvorteil deutlich geringer, weshalb sich die Mutation dort nicht in gleichem Ausmaß etablierte. Zusätzlich erklärt der begrenzte Genfluss zwischen geografisch getrennten Populationen, dass die erhöhte Allelfrequenz in Nord- und Mitteleuropa langfristig erhalten blieb. In eher kleineren, historisch teilweise isolierten nordeuropäischen Gemeinschaften konnte auch Gendrift zur Verstärkung des Mutationsanteils beitragen.