C1 Chlamydomonas
Hinweis: In der Prüfung musst du von den Aufgabenblöcken A, B und C jeweils einen der beiden Vorschlägen 1 oder 2 bearbeiten.
Chlamydomonas reinhardtii ist eine weltweit verbreitete Süßwasseralge, die in der Lage ist, neben der Fotosynthese verschiedene andere Stoffwechselwege zu betreiben.
Unter Stressbedingungen wechselt die einzellige Grünalge Chlamydomonas reinhardtii zu folgendem Stoffwechselprozess:

Formuliere die Bruttogleichung der lichtabhängigen Reaktionen der Fotosynthese.
Beschreibe anhand von Abbildung 1 zwei Gemeinsamkeiten und einen Unterschied zu den lichtabhängigen Reaktionen der Fotosynthese und erkläre die Auswirkungen dieses alternativen Stoffwechselwegs auf den Aufbau von Biomasse.
Die Hydrogenase aus C. reinhardtii wurde gentechnisch mehrmals verändert. In einem Laborexperiment wurde die Wasserstoffproduktion des Enzyms des Wildtyps mit den Enzymen zweier Mutanten in Abhängigkeit von der Ferredoxin-Konzentration bestimmt (Tab.). Die Ferredoxin-Konzentration stellt ein Maß für die verfügbaren Elektronen dar.
| Wasserstoffproduktion pro mg Enzym in µmol/L in einer Minute | |||
| Ferredoxin-Konzentration in µmol/L | Enzym des Wildtyps | Enzym von Mutante 1 | Enzym von Mutante 2 |
| 0 | 0 | 0 | 0 |
| 5 | 70 | 75 | 20 |
| 10 | 110 | 150 | 22 |
| 15 | 130 | 176 | 24 |
| 20 | 140 | 200 | 26 |
| 25 | 149 | 207 | 26 |
| 30 | 150 | 210 | 26 |
| 35 | 150 | 210 | 26 |
| 40 | 150 | 210 | 26 |
Interpretiere die Messwerte für die Wildtyp-Hydrogenase.
Formuliere eine Hypothese auf Teilchenebene zur Erklärung der Unterschiede der Messwerte zwischen dem Enzym des Wildtyps und den Enzymen der beiden Mutanten.
In einem Experiment wurde das Populationswachstum von C. reinhardtii untersucht. Hierzu wurde gegenüber der Kontrolle (Ansatz 1) bei ansonsten gleichen Bedingungen das Kohlenhydrat Cellulose von Tag 1-10 zugesetzt (Ansatz 2). Ab Tag 11 enthielt auch Ansatz 2 keine Cellulose mehr.
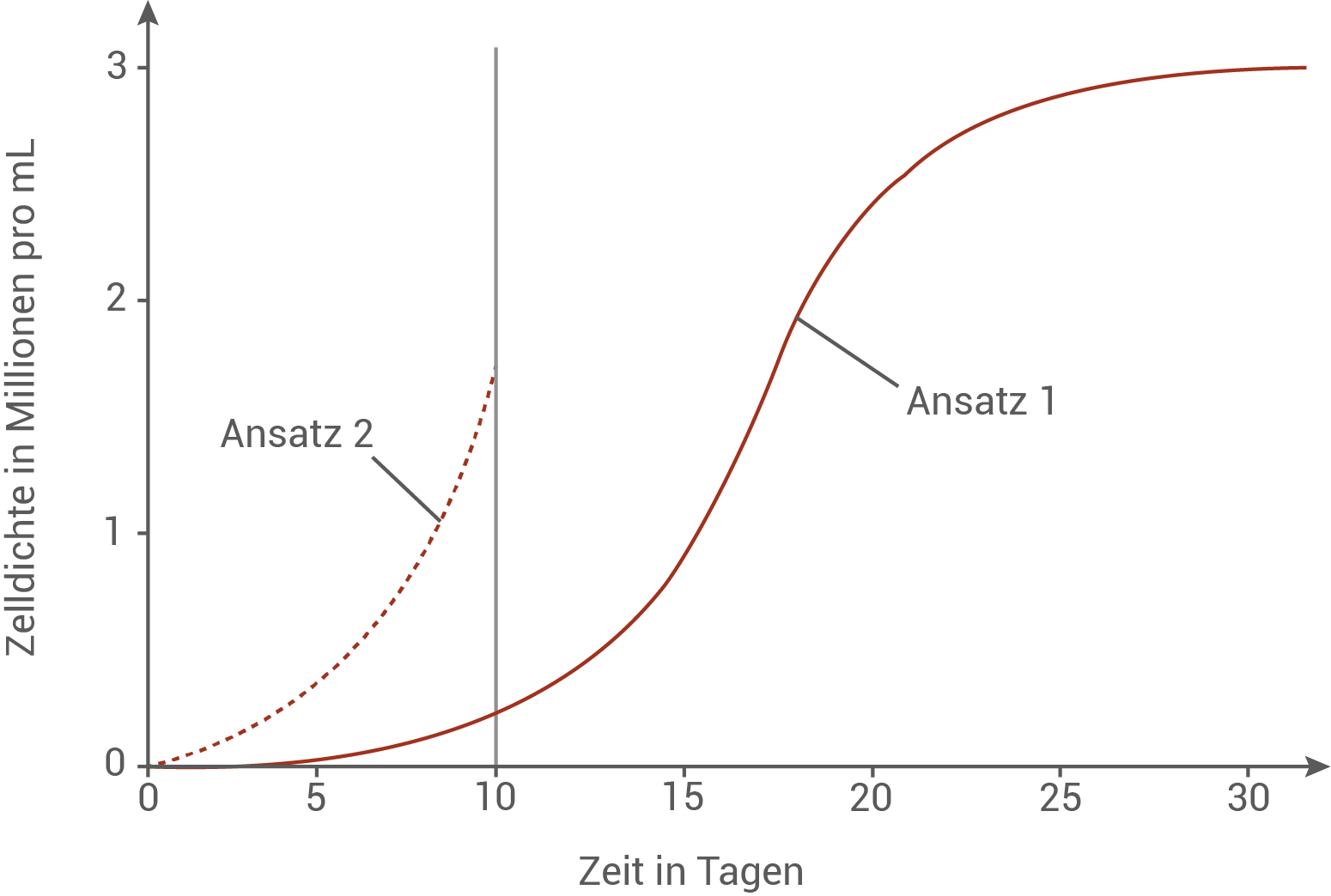
Ordne die Phasen des typischen Populationswachstums dem Kurvenverlauf des Kontrollansatzes (Ansatz 1) begründet zu. Zeichne einen hypothetischen weiteren Kurvenverlauf von Ansatz 2 von Tag 10 bis Tag 30 ein und begründe diesen.
C. reinhardtii besitzt mit dem sogenannten Augenfleck ein lichtsensitives Zellorganell. Dieser ist von einer Biomembran umschlossen, die lichtempfindliche Membranproteine enthält. Fällt Licht auf die Membran, so kommt es zu einem passiven Protonentransport in das Zellorganell.
Erstelle jeweils eine beschriftete Skizze eines Ausschnitts der Augenfleckmembran auf Teilchenebene im beleuchteten und im unbeleuchteten Zustand.
Die Reaktion von Algen auf unterschiedliche Umwelteinflüsse ist Gegenstand vieler Forschungen. Unter anderem werden fotosynthetisch aktive Grünalgen der Gattung Chlamydomonas auf ihre Tauglichkeit hin untersucht, als Bioindikator Umweltgifte anzuzeigen.
Im Rahmen einer solchen Untersuchung wurden Wasserproben mit unterschiedlichen Mengen von Kupfer-Nanopartikeln vermischt und das Wachstum von Chlamydomonaskulturen darin überprüft.
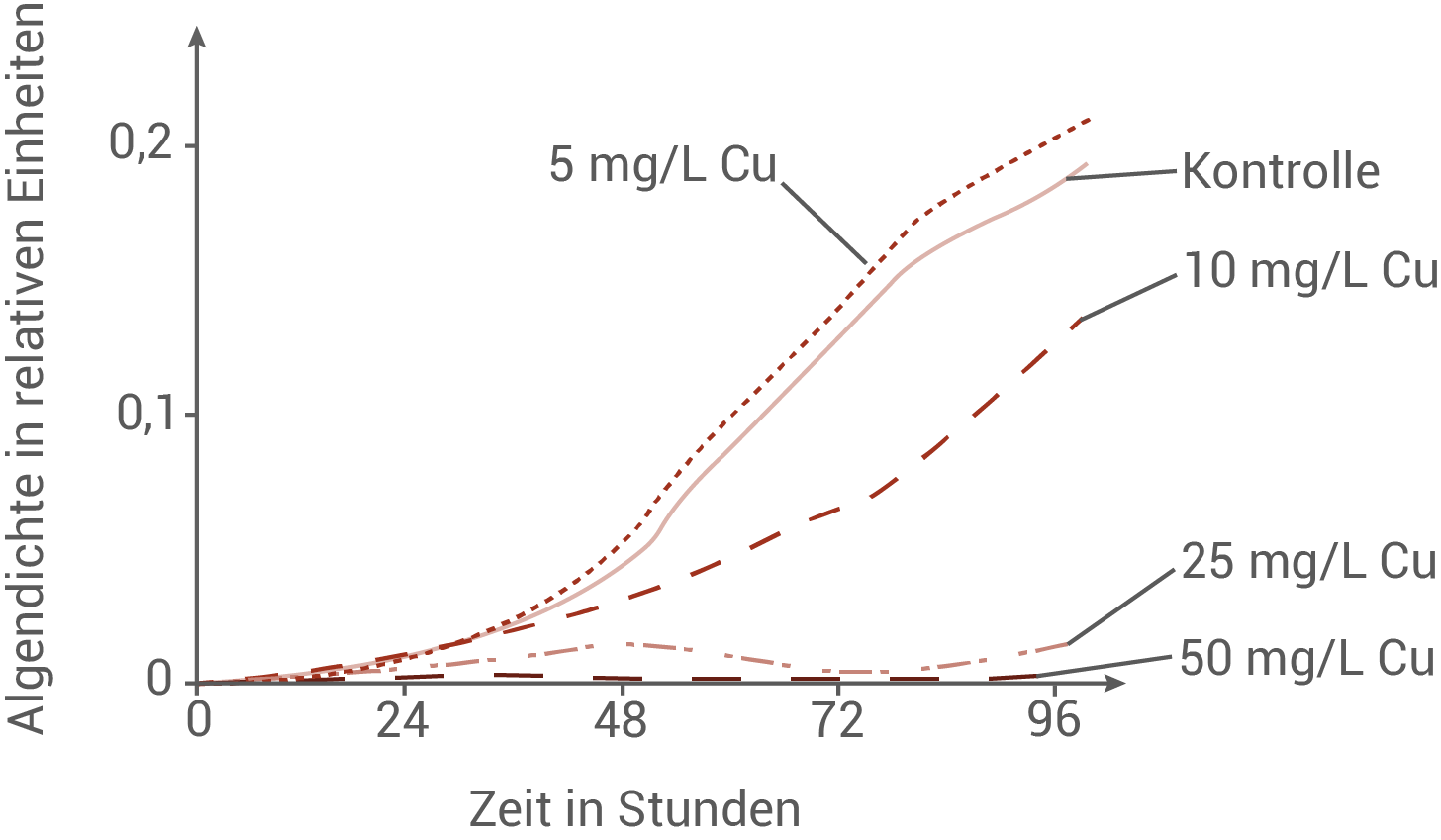
Beurteile auf Basis von Abbildung 3 die Eignung von Chlamydomonas als Bioindikator für Kupfer-Nanopartikel anhand zweier Kriterien.
Zur Bestimmung der Algendichte wurde die Lichtabsorption der Algensuspension bei einer bestimmten Wellenlänge gemessen. Leite mithilfe einer Skizze des Absorptionsspektrums von Chlorophyll eine geeignete Wellenlänge für das Messverfahren ab.
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Bruttogleichung der lichtabhängigen Reaktionen
Stoffwechselprozess von Chlamydomonas reinhardtii
In Abbildung 1 erkennt man zunächst zwei deutliche Gemeinsamkeiten zwischen dem alternativen Stoffwechselweg von Chlamydomonas reinhardtii und den lichtabhängigen Reaktionen der Fotosynthese. Beide Prozesse beginnen mit der Lichtabsorption in Photosystem II und nutzen die Elektronenflusskette, um Energie zu gewinnen. Außerdem wird in beiden Fällen ein Protonengradient über die Thylakoidmembran aufgebaut, der über die ATP-Synthase in die Synthese von ATP überführt wird. Damit sind sowohl der Ort der Reaktionen als auch die grundlegenden bioenergetischen Mechanismen identisch.
Ein zentraler Unterschied betrifft jedoch die Nutzung der freigesetzten Elektronen. Während in der klassischen lichtabhängigen Reaktion die Elektronen letztlich zur Reduktion von NADP⁺ zu NADPH führen, werden sie im alternativen Stoffwechselweg auf die Hydrogenase übertragen, wodurch molekularer Wasserstoff entsteht. Der Wasserstoff verlässt anschließend die Zelle und steht nicht mehr für die Reduktion biochemischer Zwischenprodukte zur Verfügung. Dadurch entsteht zwar weiterhin ATP, jedoch kein NADPH als Reduktionsäquivalent.
Diese Veränderung hat unmittelbare Auswirkungen auf den Aufbau von Biomasse. Für die Kohlenhydratbildung im Calvin-Zyklus werden neben ATP große Mengen NADPH benötigt. Da der alternative Stoffwechselweg kein NADPH bereitstellt und die Elektronen stattdessen als Wasserstoff aus der Zelle entfernt werden, steht weniger Reduktionskraft für die Assimilation von CO2 zur Verfügung. Der Aufbau organischer Substanz und damit das Wachstum der Alge ist unter diesen Bedingungen deutlich eingeschränkt, weil ATP zwar vorhanden ist, aber ohne NADPH kein effektiver Kohlenstoffeinbau erfolgen kann.
Messwerte für die Wildtyp-Hydrogenase
Bei der Wildtyp-Hydrogenase steigt die Wasserstoffproduktion mit zunehmender Ferredoxinkonzentration zunächst deutlich an und erreicht dann ein Plateau. Bei 0 µmol/L Ferredoxin wird kein Wasserstoff gebildet, was zeigt, dass das Enzym ohne Elektronendonator inaktiv ist. Erhöht man die Ferredoxinkonzentration auf 5 bzw. 10 µmol/L, nimmt die Wasserstoffproduktion auf 70 bzw. 110 µmol/L pro Minute zu und steigt bei 20 µmol/L weiter auf etwa 140 µmol/L pro Minute. Ab 30 µmol/L Ferredoxin liegt die Wasserstoffproduktion jedoch konstant bei ungefähr 150 µmol/L pro Minute und erhöht sich bei weiteren Konzentrationssteigerungen nicht mehr. Das spricht dafür, dass die Wildtyp-Hydrogenase bei dieser Ferredoxinkonzentration mit Elektronen gesättigt ist und mit ihrer maximalen Reaktionsgeschwindigkeit arbeitet; Alle aktiven Zentren der Hydrogenase sind mit Elektronen versorgt, sodass weitere Substratkonzentration nicht zu einer höheren Reaktionsgeschwindigkeit führen kann. Genau dieses Verhalten entspricht der Vmax-Phase eines nach Michaelis–Menten arbeitenden Enzyms.
Hypothese bezüglich der Messwerte der Mutanten
Die Messwerte zeigen, dass sich die beiden Mutanten deutlich vom Wildtyp unterscheiden. Beim Enzym der Mutante 1 liegt die Wasserstoffproduktion in allen Ferredoxinkonzentrationen über der des Wildtyps. Schon bei 5 µmol/L Ferredoxin werden etwa 75 µmol/L·min pro Minute erreicht, bei 10 µmol/L etwa 150 µmol/L pro Minute und bei 20 µmol/L rund 200 µmol/L pro Minute. Ab etwa 30 µmol/L bleibt die Rate bei ungefähr 210 µmol/L pro Minute konstant. Im Vergleich zum Wildtyp ist die maximale Reaktionsgeschwindigkeit damit deutlich erhöht, und das Plateau wird bereits bei ähnlich niedrigen Substratkonzentrationen erreicht. Auf Teilchenebene spricht dies dafür, dass die Mutation das aktive Zentrum so verändert hat, dass Ferredoxin besser passt oder stärker gebunden wird und der Elektronentransfer effizienter abläuft. Die Affinität zum Substrat und die Umsatzzahl des Enzyms sind wahrscheinlich erhöht.
Beim Enzym der Mutante 2 verläuft die Kurve dagegen fast waagerecht auf sehr niedrigem Niveau. Bereits bei 5 µmol/L Ferredoxin liegt die Wasserstoffproduktion nur bei etwa 20 µmol/L pro Minute, sie steigt bei 10 und 15 µmol/L nur geringfügig auf 22 µmol/L pro Minute an und erreicht bei 20 µmol/L mit 26 µmol/L pro Minute ihr Maximum, das auch bei höheren Ferredoxinkonzentrationen nicht weiter zunimmt. Dieses Verhalten deutet darauf hin, dass die Mutation das aktive Zentrum so stark verändert hat, dass Ferredoxin nur schlecht binden oder Elektronen nur in geringem Maße übertragen werden können. Auf Teilchenebene ist die Passung zwischen Substrat und Enzym gestört, die Affinität stark herabgesetzt und die katalytische Aktivität insgesamt deutlich vermindert.
Phasen des Populationswachstums
Im Kontrollansatz zeigt die Kurve ein typisches logistisches Populationswachstum mit drei der klassischen vier Phasen. In den ersten Tagen nach Versuchsbeginn verläuft die Kurve sehr flach. In dieser Zeit befindet sich die Population in der Latenzphase, in der sich die Algen an die neuen Kulturbedingungen anpassen, Enzyme synthetisieren und der Stoffwechsel hochgefahren wird, ohne dass bereits viele Zellteilungen stattfinden. Daran schließt sich eine deutlich ansteigende Phase an, in der die Kurve steil nach oben verläuft. Diese Phase ist die exponentielle Phase, in der sich die Algen regelmäßig teilen, genügend Licht und Nährstoffe vorhanden sind und die Zelldichte daher stark zunimmt. Ab einem bestimmten Zeitpunkt flacht die Kurve erkennbar ab und nähert sich einem Plateau. In dieser stationären Phase gleichen sich Teilungsrate und Absterberate ungefähr aus. Die Ressourcen im Medium sind weitgehend ausgeschöpft und die Populationsdichte erreicht die Tragfähigkeit des Systems. Würde der Versuch weiter fortgeführt, wäre nach der stationären Phase mit einer Absterbephase zu rechnen, in der die Kurve wieder abfällt, weil Nährstoffe weiter verbraucht sind, Stoffwechselprodukte akkumulieren und mehr Zellen absterben als neu entstehen.
Hypothetischer Kurvenverlauf für Ansatz 2

Für Ansatz 2 ist bis Tag 10 eine deutlich steilere exponentielle Phase zu sehen als im Kontrollansatz, da den Zellen zusätzliche Cellulose als leicht nutzbare Kohlenhydratquelle zur Verfügung steht. Ab Tag 10 ist diese externe Energiequelle nicht mehr vorhanden, die Algen müssen ihren Stoffwechsel auf reine Fotosynthese umstellen. Ein realistischer hypothetischer Kurvenverlauf von Tag 10 bis Tag 30 sähe so aus, dass die Kurve zunächst etwas weniger steil weiter ansteigt, da die Umstellung auf den ausschließlich assimilatorischen Stoffwechsel kurzfristig das Wachstum verlangsamt. Nach dieser Anpassungsphase steigt die Zelldichte weiter an, allerdings mit geringerer Steigung als in der vorherigen exponentiellen Phase mit Cellulose. Da Ansatz 2 an Tag 10 bereits eine ähnlich hohe Zelldichte erreicht hat wie Ansatz 1 deutlich später, erreicht die Population von Ansatz 2 das gleiche Plateau wie im Kontrollansatz früher und geht bereits vor Tag 30 in eine stationäre Phase über. Dieses Plateau liegt ungefähr auf dem gleichen Niveau wie bei Ansatz 1, da die Tragfähigkeit des Kulturgefäßes durch Licht, Nährstoffe und Raum vorgegeben ist und für beide Ansätze gleich bleibt. Bei weiterem Zeitverlauf würde sich auch in Ansatz 2 nach einiger Zeit eine Absterbephase anschließen, in der die Kurve langsam abfällt.
Hinweis: Beim gezeigten Verlauf der Populationsdichte für Ansatz 2 ab Tag 10 handelt es sich um eine qualitative hypothetische Darstellungsweise. Solange sinnvoll begründet, kann der Kurvenverlauf zur Erreichung der vollen Punktzahl auch hiervon abweichen.
Augenfleckmembran auf Teilchenebene

Eignung von Chlamydomonas als Bioindikator
Auf Basis von Abbildung 3 kann man die Eignung von Chlamydomonas als Bioindikator für Kupfer-Nanopartikel nur eingeschränkt bejahen, weil die Reaktion zwar stark konzentrationsabhängig ist, bei niedrigen Belastungen jedoch kaum unterscheidbar ausfällt. Ein zentrales Kriterium ist die Empfindlichkeit im niedrigen Konzentrationsbereich, denn ein Bioindikator soll idealerweise schon geringe Schadstoffmengen zuverlässig anzeigen. Genau hier zeigt der Graph eine Schwäche: Die Kurve bei 5 mg/L Cu verläuft nahezu wie die Kontrolle, sogar mit leicht gesteigerter Algendichte, und erreicht nach etwa 96 Stunden ebenfalls Werte um 0,2 relative Einheiten. Damit ist bei geringer Belastung kaum eine messbare Wachstumsänderung erkennbar, sodass niedrige Konzentrationen mit diesem System möglicherweise nicht sicher detektiert werden können. Wenn das Ziel darin besteht, sehr kleine Mengen Kupfer-Nanopartikel frühzeitig zu erkennen, wäre eine deutlich stärkere Abweichung von der Kontrolle oder eine messbare Reaktion schon unterhalb von 5 mg/L notwendig. Bei 10 mg/L Cu im Vergleich zur Kontrolle wird hingegen eine deutlich geringere Algendichte erreicht. Bei 25 mg/L ist das Wachstum stark gehemmt, die Algendichte steigt nur minimal an und bleibt über den gesamten Zeitraum sehr niedrig. Bei 50 mg/L ist praktisch kein Wachstum mehr erkennbar, die Kurve verläuft nahezu auf der Nulllinie.
Damit reagiert Chlamydomonas im niedrigen Konzentrationsbereich je nach Anforderungen nicht messbar genug, zeigt jedoch bei höheren Konzentrationen eine sehr starke Hemmung bis hin zum Wachstumsstopp. Anhand der gegebenen Messungen kann eine Konzentration von Kupfer-Nanopartikeln nur ab 10 mg/L mit der Grünalge verlässlich zugeordnet werden.
Ein zweites Kriterium ist die Differenzierungsfähigkeit des Indikators, also ob verschiedene Belastungsstufen eindeutig unterscheidbare Reaktionen auslösen. Entsprechend den beschriebenen Kurvenverläufen ist dieses Kriterium für Konzentrationen zwischen 10 und 25 mg/L Cu erfüllt: Hier ist jeweils ein starker Unterschied zum Kontrollversuch erkennbar. Unter 10 mg/L Cu mag die Auswirkung auf die Algendichte zu klein sein um überhaupt eine signifikante Abweichung vom Kontrollversuch wahrnehmen zu können (siehe Kriterium der Empfindlichkeit). Bei Kupfer-Konzentrationen über 25 mg/L kann ein ähnlicher flacher Verlauf wie bei der Kurve für 50 mg/L Cu erwartet werden, da die Algen ab einer gewissen Kupfer-Konzentration gar nicht mehr wachsen (Algendichte bleibt gleich 0) und somit kann nur angenommen werden, dass die Kupfer-Konzentration über diesem Grenzwert liegt, aber nicht wie weit.
Insgesamt ist Chlamydomonas nach Abbildung 3 nur für einen bestimmten Bereich von Kupfer-Konzentrationen als Bioindikator geeignet.
Hinweis: Der Grenzwert für Kupfer in Trinkwasser beträgt in Deutschland 2 mg/L. Es ist also durchaus denkbar, dass eine genauere Messmethode nötig ist; da diese Information jedoch nicht gegeben ist kann man auch begründet zu einem anderen Schluss kommen und volle Punktzahl erreichen.
Lichtabsorption zur Bestimmung der Algendichte messen
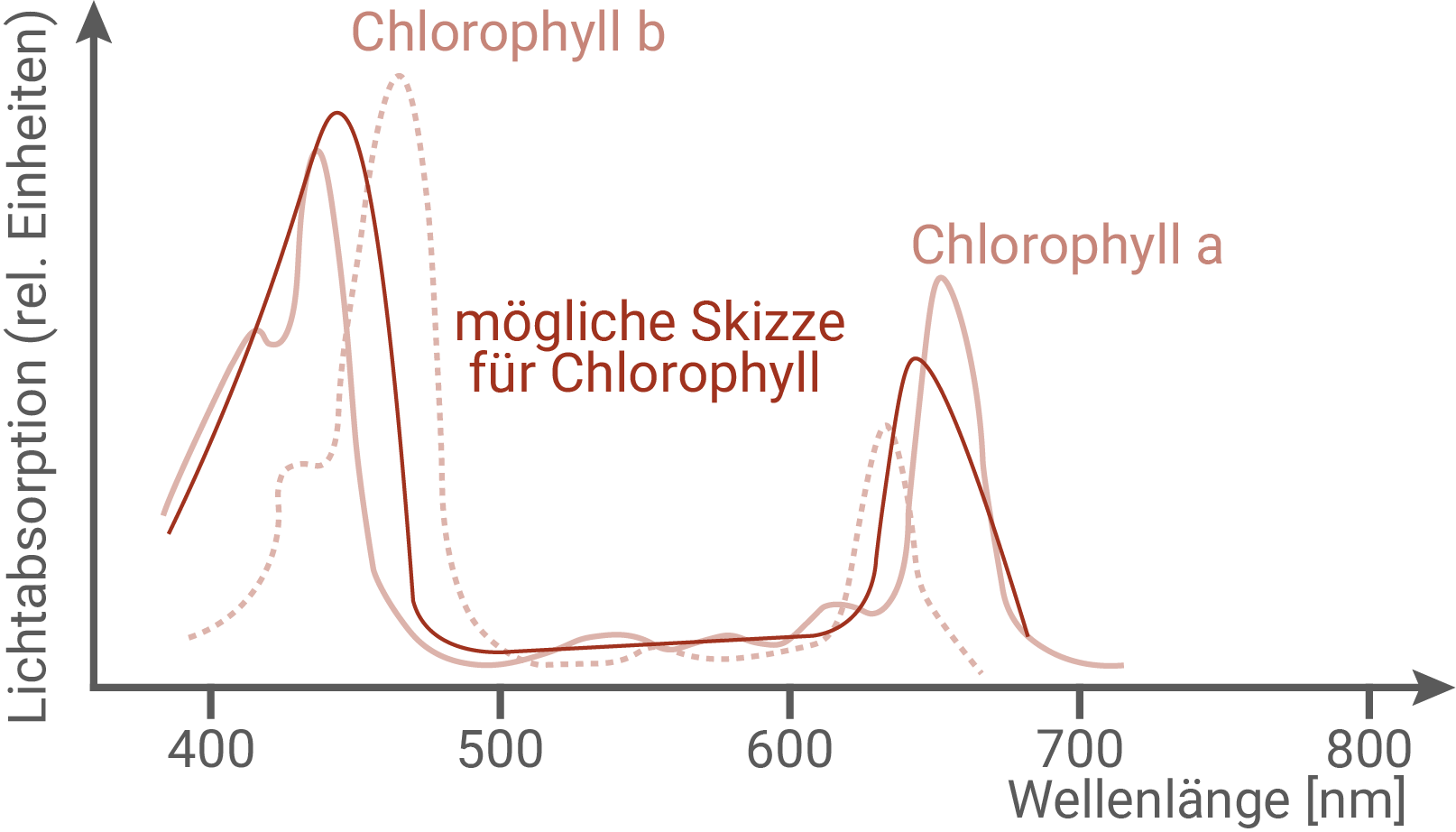
Die Kurve zeigt zwei deutlich ausgeprägte Absorptionsmaxima. Ein starkes Maximum liegt im kurzwelligen, blau-violetten Bereich bei ungefähr 430–450 nm, ein weiteres im langwelligen, roten Bereich bei etwa 650–680 nm. Dazwischen, im grün-gelben Bereich um 500–600 nm, verläuft die Kurve deutlich niedriger, was die geringe Absorption von grünem Licht erklärt. Für die Messung der Algendichte bietet sich einer der beiden Maximalbereiche an. Diese Wellenlängen eignen sich besonders gut, da hier Chlorophyll stark absorbiert und Änderungen der Chlorophyllmenge direkt zu messbaren Änderungen der Lichtabsorption führen.