Enzyme
Enzyme als Biokatalysatoren
Katalysatoren beschleunigen chemische Reaktionen, die auch ohne sie stattfinden könnten. Sie bewirken dies, indem sie die reagierenden Teilchen in einen Zustand erhöhter Reaktionsbereitschaft versetzen, der auf der Geschwindigkeit der Teilchen basiert. Schnellere Teilchen verfügen im Gegensatz zu langsameren über genügend Energie für eine erfolgreiche Reaktion. Katalysatoren senken die Aktivierungsenergie, wodurch mehr Teilchen die erforderliche Energie für die Reaktion besitzen. Dies führt zu einer beschleunigten Reaktionsgeschwindigkeit. Die Katalysatoren bleiben dabei unverändert. Im Organismus wirken Enzyme ähnlich und werden deshalb als Biokatalysatoren bezeichnet. Die meisten Enzyme bestehen aus Proteinen.

Abb. 1: Ablauf einer katalysierten Enzymreaktion
Struktur und Wirkung
Enzyme sind Proteine, die chemische Reaktionen beschleunigen, indem sie Substrate binden und in einen reaktionsfähigen Zustand bringen. Ihr aktives Zentrum enthält spezifische Aminosäurereste, die durch verschiedene Kräfte mit dem Substrat interagieren und dadurch die Reaktion erleichtern. Enzyme können neben ihrem Proteinanteil Cofaktoren enthalten, die aus anorganischen Metall-Ionen wie Eisen, Kupfer oder Mangan bestehen. Diese Cofaktoren sind fest an das Enzymmolekül gebunden und stabilisieren den Übergangszustand im Enzym-Substrat-Komplex. Organische Moleküle, die als Coenzyme dienen, können entweder prosthetische Gruppen sein, die dauerhaft an das Enzymmolekül gebunden sind, oder Cosubstrate, die vorübergehend an das Enzymmolekül binden, während sie ihre Molekülstruktur verändern, um die Reaktion zu erleichtern. Enzyme sind äußerst effizient und wiederverwendbar, da sie nach der Reaktion nicht verbraucht werden und für neue Reaktionen zur Verfügung stehen. Dies ermöglicht eine kontinuierliche Beschleunigung des Substratumsatzes, selbst in geringen Mengen.Substrat- und Wirkungsspezifität (Schlüssel-Schloss-Prinzip)
- Substratspezifität: Enzyme sind substratspezifisch und bilden Enzym-Substrat-Komplexe gemäß dem Schlüssel-Schloss-Prinzip. Die Bindung eines Substrats an das aktive Zentrum eines Enzyms erfolgt aufgrund der spezifischen Anordnung von Aminosäureresten. Diese Anordnung ermöglicht nur die Bindung bestimmter Substratmoleküle, die wie ein Schlüssel in ein passendes Schloss passen. Die Bindung des Substrats führt oft zu einer Veränderung der räumlichen Struktur des Enzyms, was als induzierte Passform bekannt ist und durch das Induced-Fit-Modell erklärt wird.
- Wirkungsspezifität:
Im aktiven Zentrum des Enzymmoleküls interagieren die Aminosäurereste mit dem Substratmolekül und ermöglichen dessen chemische Umwandlung. Diese Interaktion führt immer zur Bildung der gleichen Produktmoleküle. Aufgrund der Tatsache, dass Enzyme immer die gleiche Reaktion ihres Substratmoleküls katalysieren, werden sie als wirkungsspezifisch bezeichnet. Dies bedeutet, dass jedes Enzym spezifisch für eine bestimmte Reaktion ist und nur mit einem bestimmten Substrat oder einer Gruppe von strukturell ähnlichen Substraten interagiert.
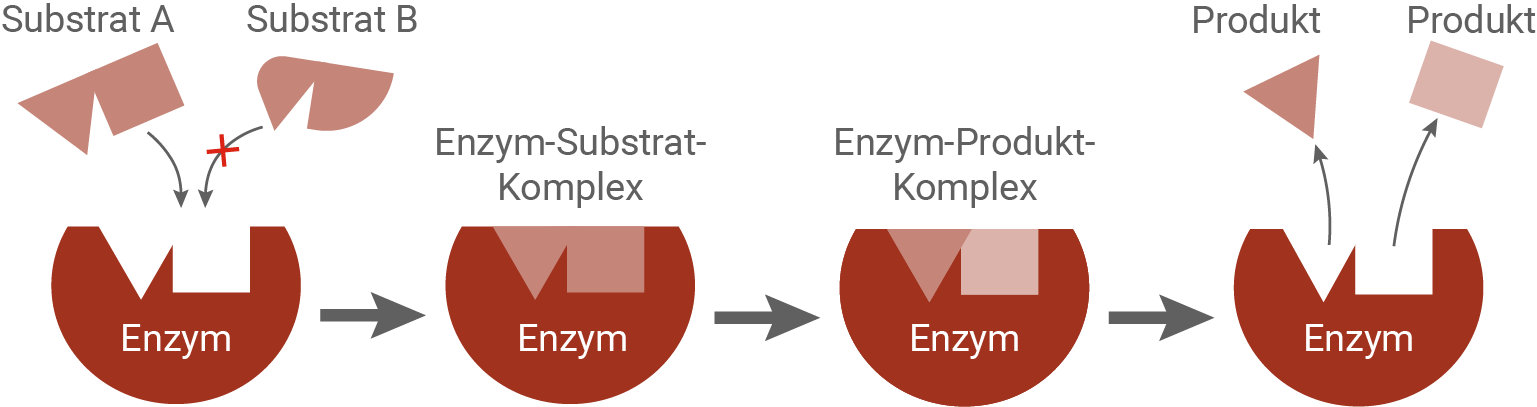 Abb. 2: Ablauf einer Enzymreaktion (Schlüssel-Schloss-Prinzip)
Abb. 2: Ablauf einer Enzymreaktion (Schlüssel-Schloss-Prinzip)
pH- und Temperaturabhängigkeit
- Einfluss des pH-Werts:
Der pH-Wert einer Lösung hängt von der Konzentration an Oxonium-Ionen (H3O+-Ionen) ab und bestimmt die Saure oder basische Natur einer Lösung (pH
7 für sauer). Enzyme sind pH-sensitiv, da Änderungen des pH-Werts die Ladung ionisierbarer Gruppen im aktiven Zentrum verändern können, was die Enzymaktivität beeinflusst. Jedes Enzym hat ein spezifisches pH-Optimum, bei dem es maximale Aktivität zeigt. Zum Beispiel arbeiten Speichel-Amylasen im Mund am besten bei einem pH von etwa 7, während Pepsin im Magen mit einem pH von etwa 2 optimal funktioniert. Extreme pH-Änderungen können Enzyme denaturieren, wodurch ihre Sekundär- und Tertiärstruktur gestört wird. Diese Denaturierung kann sowohl reversibel als auch irreversibel sein und die enzymatische Aktivität beeinträchtigen.
- Einfluss der Temperatur: Eine Erhöhung der Temperatur beschleunigt chemische Reaktionen, da die Moleküle sich schneller bewegen und häufiger zusammenstoßen. Dies erhöht die Reaktionsgeschwindigkeit, da mehr Moleküle die erforderliche Aktivierungsenergie haben. Die Reaktionsgeschwindigkeit erhöht sich typischerweise um das Zwei- bis Dreifache pro 10 °C Anstieg, gemäß der Reaktionsgeschwindigkeits-Temperatur-Regel (RGT-Regel). Bei enzymatischen Reaktionen ist die Anwendung der RGT-Regel nur bei niedrigen Temperaturen sinnvoll, da ab einem bestimmten Optimum die Enzymaktivität schnell abnimmt. Zu hohe Temperaturen führen zur Denaturierung von Enzymen, bei der die Struktur des aktiven Zentrums zerstört wird. Dies verhindert die Bindung von Substraten und stoppt die Reaktion. Jedes Enzym hat ein spezifisches Temperaturoptimum, wobei viele Enzyme im menschlichen Körper bei etwa 37 °C optimal funktionieren, was der Körpertemperatur entspricht.
Klassifizierung
- Oxidoreduktasen: Enzyme, die Redoxreaktionen katalysieren. Das bedeutet, sie beschleunigen Reaktionen, bei denen die Substrate oxidiert oder reduziert werden, wobei Elektronen entweder abgegeben oder aufgenommen werden.
- Transferasen: Enzyme, die die Übertragung chemischer Gruppen von einem Donormolekül auf ein Akzeptormolekül katalysieren.
- Hydrolasen: Enzyme, die die Spaltung des Substrats durch Hydrolyse katalysieren, wobei Wasser in die Reaktion einbezogen wird.
- Translokasen: Enzyme, die den Transfer bestimmter Ionen oder Moleküle durch Biomembranen von einer Seite zur anderen Seite katalysieren. Sie binden den zu transportierenden Stoff in ihrem Substrat-Bindungszentrum. Dadurch verändert sich die Enzymstruktur, und der Stoff wird auf der anderen Seite freigesetzt. Translokasen sind auch als Transmembran-Transportproteine bekannt.
- Ligasen: Enzyme, die die Verknüpfung zweier Moleküle unter Energiezufuhr katalysieren, zum Beispiel durch die Verwendung von ATP (Adenosintriphosphat).
- Isomerasen: Enzyme, die Umlagerungen innerhalb von Molekülen katalysieren. Dabei bleibt die Summenformel der Moleküle erhalten.
- Lyasen: Enzyme, die die Spaltung des Substrats katalysieren, ohne dabei die Hydrolyse (Reaktion mit Wasser) zu verwenden.
Arten der Enzymhemmung
- Kompetitive Hemmung: Die kompetitive Hemmung ist ein enzymatischer Regulationsmechanismus, bei dem ein Inhibitor mit struktureller Ähnlichkeit zum Substrat um die Bindung an das aktive Zentrum konkurriert. Der Inhibitor blockiert das aktive Zentrum vorübergehend, indem er sich an die Bindungsstelle des Enzyms bindet, wodurch die enzymatische Reaktion gehemmt wird. Diese Hemmungsart ist reversibel und kann durch eine Erhöhung der Substratkonzentration überwunden werden.
- Nicht-kompetitive Hemmung: Die nicht-kompetitive Hemmung ist ein enzymatischer Regulationsmechanismus, bei dem ein Inhibitor an eine allosterische Stelle des Enzyms bindet, die sich nicht am aktiven Zentrum befindet. Diese Bindung verändert die räumliche Struktur des Enzyms, was die Substratbindung und die Enzymaktivität beeinträchtigt. Im Gegensatz zur kompetitiven Hemmung konkurriert der Inhibitor nicht direkt mit dem Substrat um das aktive Zentrum. Diese Art der Hemmung ist reversibel und beeinflusst die enzymatische Aktivität durch die Bindung des Inhibitors an eine allosterische Stelle des Enzyms.
- Irreversible Hemmung: Inhibitor-Moleküle können entweder reversibel oder irreversibel an das Enzymmolekül binden. Bei der reversiblen Hemmung können die Inhibitoren vom Enzym abgelöst werden, was die Funktionsfähigkeit des Enzyms wiederherstellt. Im Gegensatz dazu führt die irreversible Hemmung dazu, dass der Inhibitor dauerhaft an das aktive Zentrum bindet und die Bildung des Enzym-Substrat-Komplexes verhindert. Ein Beispiel für irreversible Hemmung ist das Penicillin, das an das aktive Zentrum eines bakteriellen Enzyms bindet und dieses inaktiviert, wodurch das Bakterium am Teilen gehindert wird.